低頻重復經顱磁刺激對血管性癡呆大鼠認知功能的影響
王金華 柯博熙 陳云 張丹紅
血管性癡呆是由各種心、腦血管疾病導致的一種常見的臨床綜合征,主要表現為認知水平的下降[1]。近年來血管性癡呆發病率逐漸上升,已成為僅次于阿爾茨海默病第二常見的癡呆類型[2]。然而,對于血管性癡呆目前仍沒有特效的治療方法。重復經顱磁刺激(repetitive transcranial magnetic stimulation,rTMS)是一種無創的治療方法,其利用磁場影響腦內的各種神經電生理活動和代謝途徑,目前主要用于神經和精神疾病的治療[3-4]。有研究報道了rTMS對于阿爾茨海默病和血管性癡呆認知功能方面的改善作用[5-7]。本研究觀察L-rTMS對血管性癡呆大鼠認知功能的影響并探討其神經保護的機制,現將研究結果報道如下。
1 材料和方法
1.1 實驗動物分組 選取雄性健康SPF級SD大鼠45只,體重220~260g,由河北醫科大學實驗動物中心提供。動物飼養在屏障環境內,動物房環境噪音低于60dB,室溫控制在20~25℃,相對濕度50%~70%,給予大鼠12h光照/12h黑暗交替的環境,自由獲取食物與飲用水。所有動物操作均嚴格遵守國際動物保護與使用指南的相關規定。采用隨機數字表法將45只大鼠分為3組(模型組、治療組、假手術組),每組15只。模型組和治療組利用雙側頸總動脈閉塞法(bilateral common carotid artery occlusion,BCCAO)制作血管性癡呆模型,假手術組給予同樣的麻醉和操作處理,但不進行BCCAO操作。治療組大鼠于造模后給予L-rTMS治療,連續治療14d,假手術組和模型組大鼠同時給予假刺激處理。
1.2 主要儀器與實驗試劑 水迷宮檢測系統(上海欣軟),經顱磁刺激儀(丹麥 Mag Pro30,MagVenture,Farum);主要試劑:丙二醛(MDA)、超氧化物歧化酶(SOD)試劑盒,β-actin抗體、Bcl-2相關X蛋白(Bcl-2-associated X protein,Bax)、B-細胞淋巴瘤-2(B-cell lymphoma 2,Bcl-2)及半胱氨酸天冬氨酸蛋白酶3(Cysteine aspartic acid protease 3,Caspase-3)抗體。
1.3 大鼠血管性癡呆建模 采用BCCAO,具體操作方法如下:所有大鼠于手術前12h開始禁食,可進水。利用10%水合氯醛腹腔注射麻醉大鼠,麻醉劑發揮效果后將大鼠固定于操作臺上,消毒后沿頸部正中切開皮膚,顯露大鼠雙側頸總動脈,分離周圍組織后雙側頸總動脈結扎。術后縫合皮膚并消毒,將動物放入籠中室溫下自然蘇醒,正常進食水。假手術組大鼠只分離頸總動脈不進行結扎。
1.4 L-rTMS方案 血管性癡呆大鼠造模成功后,將治療組大鼠固定于一個圓柱型塑料管內,暴露大鼠頭部,置于MC-B70蝶形線圈下,線圈內徑20mm,外徑100mm,4.2T的最大輸出場強。L-rTMS參數為1.5Hz,1.5T,每個序列300脈沖,連續刺激3個序列,每個序列之間間隔2min冷卻磁頭。L-rTMS于14:00-17:00進行,1次/d,連續14d。假手術組和模型組大鼠給予磁頭反面(無磁刺激影響)刺激,以消除聲音對各組大鼠的影響。
1.5 行為學檢測 采用水迷宮測試檢測各組大鼠空間學習記憶能力的差異。本實驗用水迷宮水池壁高為50cm,水深為 40cm,水溫維持在 20~24°C,水池直徑為150cm。在水迷宮的目標象限正中心位置放置一直徑為10cm的水下隱性平臺,平臺上表面位于水下1cm處。前5d進行定位航行實驗,4次/d,每次從不同入水點放入大鼠。大鼠面朝水池壁放入池中,記錄逃避潛伏期,即大鼠尋找平臺的時間。若大鼠120s內未到達水下平臺,則將大鼠小心引導至平臺上,并讓其逗留15s,該大鼠逃避潛伏期記錄為120s。第6天,撤去水下平臺,記錄每組大鼠目標象限時間。
1.6 海馬MDA、SOD含量及Bax、Bcl-2、Caspase-3蛋白表達量測定 行為學實驗后,采用隨機數字表法在每組中選取5只大鼠測定MDA、SOD含量,每組中選取5只大鼠測定Bax、Bcl-2、Caspase-3蛋白,其余5只大鼠不做處理。麻醉后取腦組織,取海馬備用,利用SOD和MDA試劑盒進行兩者含量的檢測。采用RIPA裂解液進行蛋白裂解,在4°C條件下使用離心機將勻漿離心5min(12 000×g),隨后采用BCA法測定蛋白濃度。取裂解液在室溫下電泳3h,隨后轉膜,TTBS處理1h。再與以下抗體相結合:β-actin抗體(濃度 1∶1 000)、抗 Bax抗體(1∶1 000)、抗 Bcl-2 抗體(1∶1 000)、抗 Caspase-3 抗體(濃度1∶1 000),4°C過夜。洗膜,然后利用二抗于室溫下孵育1h。最后紅外成像系統進行曝光顯影。Bax、Bcl-2、Caspase-3蛋白與β-actin的光密度值比值作為其相對蛋白表達量。
1.7 統計學處理 采用SPSS 19.0統計軟件。符合正態分布的計量資料以表示,多組之間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 3組大鼠造模后與治療后的逃避潛伏期與目標象限時間比較 見表1。
由表1可見,3組造模后與治療后的逃避潛伏期與目標象限時間比較,差異均有統計學意義(均P<0.01)。與假手術組比較,模型組、治療組造模后及治療后的逃避潛伏期均延長,目標象限停留時間減少,差異均有統計學意義(均P<0.05);模型組與治療組造模后上述指標比較,差異均無統計學意義(均P>0.05)。與模型組比較,治療組大鼠治療后逃避潛伏期縮短、目標象限時間延長,差異有統計學意義(P<0.05)。
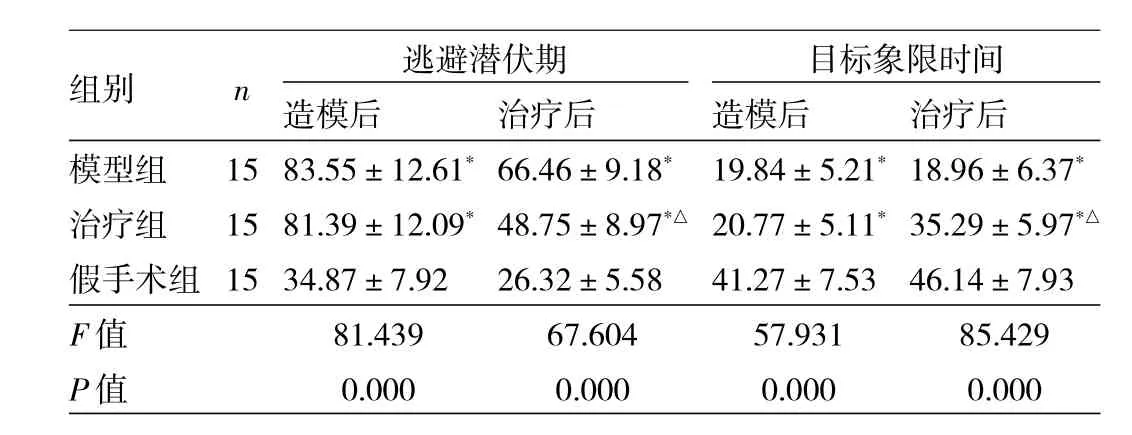
表1 3組大鼠造模后與治療后的逃避潛伏期與目標象限時間比較(s)
2.2 3組大鼠海馬部位MDA和SOD含量比較 見表2。
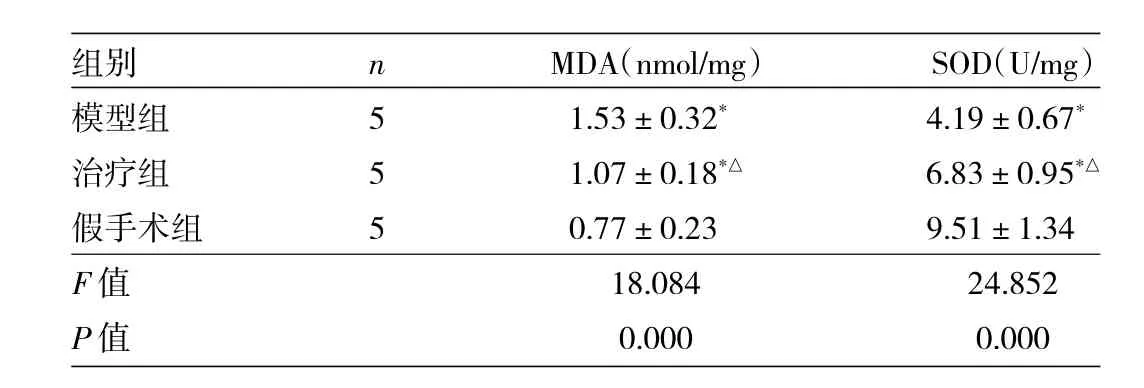
表2 3組大鼠海馬部位MDA和SOD含量比較
由表2可見,3組大鼠MDA、SOD含量比較,差異均有統計學意義(均P<0.01)。模型組、治療組大鼠MDA均高于假手術組,SOD均低于假手術組,差異均有統計學意義(均P<0.05)。與模型組比較,治療組大鼠MDA降低,SOD升高,差異均有統計學意義(P<0.05)。
2.3 3組大鼠海馬Bax、Bcl-2及Caspase-3蛋白的表達比較 見表3。
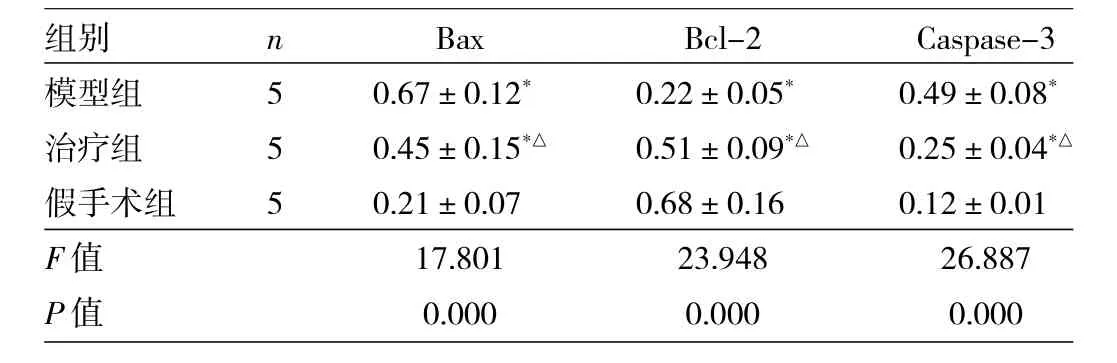
表3 3組大鼠海馬Bax、Bcl-2及Caspase-3蛋白的表達比較
由表3可見,3組Bax、Bcl-2、Caspase-3比較,差異均有統計學意義(均P<0.01)。模型組、治療組Bax、Caspase-3均高于假手術組,差異有統計學意義(P<0.05)。治療組Bax、Caspase-3均低于模型組,差異有統計學意義(P<0.05)。模型組、治療組Bcl-2均低于假手術組,治療組Bcl-2高于模型組,差異均有統計學意義(均P<0.05)。
3 討論
L-rTMS是一種有效改善認知功能且無創的治療方法,其關鍵特性在于它能夠在短時間內產生刺激神經元的電場。L-rTMS不僅對線圈直接刺激部位的神經回路產生興奮或抑制作用,對大腦其它遠隔部位也同樣發揮作用[8-9]。L-rTMS已被廣泛用于研究各種類型腦功能紊亂,如抑郁癥和癡呆[10-11]。L-rTMS不僅在治療神經精神疾病方面臨床療效明顯,還能促使這些患者在認知行為方面獲得更好的表現,如單詞回憶、言語記憶、聯想記憶、選擇性注意、語言功能和其他執行功能[12]。許多研究表明,認知能力的改善可維持至L-rTMS治療后的8周到3個月[13]。本研究發現經過2周的L-rTMS治療后,血管性癡呆大鼠的認知功能得到了明顯的改善。
血管性癡呆是老年人群癡呆的第二常見病因,患者的記憶和執行功能出現嚴重受損[14]。高血壓、糖尿病、高膽固醇血癥和高同型半胱氨酸血癥是血管性癡呆的重要風險因素。氧化應激是體內氧化與抗氧化平衡的變化產生的,這種平衡有利于產生氧自由基或活性氧自由基,而非各種抗氧化劑防御機制[15]。氧化應激是與腦卒中相關的神經損傷和認知功能障礙的調節劑,在大鼠腦梗死灶周圍可發生氧化DNA損傷[16-18]。氧化應激不僅與血管性癡呆有關,與血管性癡呆的危險因素也相關。MDA和SOD在很多研究中都被廣泛地用來代表氧化應激能力[19-20]。血管性癡呆患者MDA含量明顯升高[21]。本實驗結果發現血管性癡呆大鼠海馬MDA表達增多、SOD活性降低,說明血管性癡呆大鼠模型出現了氧化應激損傷,這與之前的研究結果相一致。L-rTMS治療后MDA和SOD水平發生了逆轉,證實了L-rTMS治療改善血管性癡呆大鼠空間學習記憶功能可能與其抗氧化應激損傷密切相關。
凋亡是一種程序性的細胞死亡,在細胞死亡的眾多不同機制中,細胞凋亡被提出用于解釋許多神經障礙中所觀察到的細胞缺失,如阿爾茨海默病、血管性癡呆、帕金森病、肌萎縮側索硬化、腦卒中等等[22]。Bcl-2和Bax是負責調控細胞凋亡的兩個主要基因。Bcl-2是抗凋亡Bcl-2家族的關鍵成員,其對調節線粒體介導的細胞凋亡至關重要[23-24]。Bcl-2的過度表達已經被證明可以保護神經細胞免受神經毒素的傷害[25]。Bax屬于促生存子家族中的一員,其通過轉移到線粒體膜上,促進細胞色素C的釋放,從而促進下游的細胞凋亡過程[26]。Caspase是一種半胱氨酸蛋白酶,是細胞凋亡的重要介質。Caspase參與凋亡過程主要通過兩種不同的途徑:死亡受體途徑和線粒體途徑。無論涉及何種途徑,Caspase-3都扮演著凋亡執行者的作用。Caspase-3是一種促凋亡酶[27-28],通過激活DNA分裂因子,進而激活內切酶分裂核DNA,最終導致細胞凋亡。凋亡已經被證實是與血管性癡呆相關的重要分子生物學機制,大量動物實驗也涉及相關研究[29]。本研究利用免疫印記方法檢測Bax、Bcl-2及Caspase-3的表達,觀察發現血管性癡呆大鼠海馬Caspase-3和Bax的表達增多,而Bcl-2降低,同樣證實了血管性癡呆大鼠海馬凋亡途徑的激活。L-rTMS治療組大鼠海馬Caspase-3和Bax的表達減少,Bcl-2的表達增多,提示L-rTMS治療在治療血管性癡呆大鼠認知障礙過程中發揮了明顯的抗凋亡特性。
總之,L-rTMS治療可明顯改善血管性癡呆大鼠認知功能,降低MDA水平,升高SOD的活性,抑制了血管性癡呆大鼠海馬凋亡相關蛋白的表達,其對血管性癡呆大鼠發揮神經保護作用的機制可能與抑制缺血損傷后凋亡途徑和氧化應激損傷有關。本研究結果證實了L-rTMS治療對于血管性癡呆大鼠的神經保護作用,這為血管性癡呆或其它類型癡呆的基礎和臨床治療提供一定的理論基礎。但本研究發現L-rTMS治療未使血管性癡呆大鼠的認知功能得到完全改善,也顯示了其治療的局限性,今后我們將會對其機制作進一步深入研究。(致謝:感謝河北醫科大學神經內科、河北省腦老化與認知障礙重點實驗室碩士生導師、副主任醫師王華龍對大鼠造模及水迷宮試驗提供的幫助。)

