外泌體研究、轉化和臨床應用專家共識
細胞外囊泡(extracellular vesicles,EVs)是由細胞分泌的具有磷脂雙分子層結構的囊泡,能夠通過其攜帶的生物大分子,調節受體細胞的生物學特性,參與細胞的生理學和病理生理學過程[1-2]。外泌體是EVs一個重要的亞群[1],通常被認為是經由多泡體與細胞膜融合而釋放到細胞外的,直徑為40~100nm的膜性囊泡狀小體[3]。檢測外泌體標志物,能夠實時動態地反映患者的疾病狀態[4-7],因此在疾病的早期篩查、無創診斷、療效監控、輔助用藥等領域有著廣泛的應用前景。此外,其作為藥物載體的潛在形式,在腫瘤等疾病的治療中也展現出誘人的潛力[8-10]。
近年來與外泌體相關的研究呈井噴式發展,以國際細胞外囊泡協會(International Society for Extracellular Vesicles,ISEV)為代表的學術團體通過廣泛合作與探討,針對研究領域中的一些關鍵性問題撰寫了意見書[11-12]。雖然我國科研工作者在外泌體研究領域也作出了重要貢獻,但迄今為止國內還沒有就外泌體研究形成共識或指南。參考基因測序等技術的發展歷程,我們不難發現新的診斷技術在疾病的診斷、治療以及預防方面提供有力支持的同時,也曾因為缺乏統一的標準及規范化流程而走了一些彎路。為響應發改委及有關單位在《“十三五”生物產業發展規劃》中提出以服務民生需求為根本,加速生物產業在各領域廣泛應用的指導思想,中國抗癌協會腫瘤標志專業委員會外泌體技術專家委員會組織專家撰寫了本共識。旨在促進國內外泌體特別是外泌體腫瘤標志物的產學研結合,推動相關標準與規范的建立,理性引導技術轉化,并服務于民生。
1 外泌體經歷了“從無到有,由冷到熱”的發展歷程
共識專家回顧外泌體研究的發展歷史。關于外泌體的報道可追溯到1985年,最早被認為是細胞的“排泄物”并沒有引起重視[13]。直到最近幾年,人們發現這種微小膜泡中含有細胞特異的蛋白、脂質和核酸,能作為信號分子傳遞給其他細胞從而改變受體細胞的功能,才開始逐漸受到大家的關注。隨著里程碑式的研究成果不斷涌現,包括外泌體在內的EVs的研究已進入了一個新的高潮。
(1)1985年,Johnstone研究組首次在體外培養的綿羊紅細胞上清中發現了一種有膜結構的小囊泡,并在1987年的論文中將其命名為Exosome。
(2)1996年,Raposo發現類似于B淋巴細胞能分泌抗原提呈外泌體,能攜帶MHC-Ⅱ類分子、共刺激分子和粘附分子。
(3)1999年,Théry等發現樹突細胞也可以產生有抗原提呈能力的外泌體。
(4)2007年,Valadi等發現細胞之間可以通過外泌體中的RNA交換遺傳物質,這意味著細胞可以通過外泌體影響另外一個細胞。
(5)2013年,Rothman、Schekman和Südhof 3位科學家獲得諾貝爾生理學或醫學獎,以表彰他們在細胞內部囊泡運輸調控機制方面做出的貢獻。
(6)2015年6月,美國M.D.Anderson Cancer Center的研究者發現早期胰腺癌患者血清中外泌體的GPC1(glypican-1)豐度顯著高于正常人群。
(7)2016年1月,Exosome Diagnostics公司推出世界首款外泌體癌癥診斷產品ExoDx Lung(ALK)。
(8)2016年5月,牛津大學開發出名為EvOx的外泌體治療產品。
(9)2017年,Kamerkar等采用外泌體作為載體遞送RNAi,靶向治療胰腺癌。
不難發現,外泌體研究之所以能迅猛發展,一方面得益于本身具有重要的生物學功能,另一方面分析和檢測技術的持續進步也為之奠定了良好基礎。盡管捷報頻傳,但目前對外泌體的了解依舊有限。共識專家認為現有的一些基于單中心、小樣本量的研究結果包括上述里程碑中提到的工作,還需進一步的研究和多中心臨床試驗予以驗證。雖然外泌體研究還存在諸多尚未解決的難題,共識專家堅信,這也正是值得研究與探索的魅力所在,隨著相關知識的逐步積累,外泌體一定有更豐富的奧秘等待我們去發現。
2 外泌體分離方法豐富多樣,但缺乏標準
EVs一詞是ISEV創造的術語,是細胞釋放的囊泡的統稱[11]。EVs有不同的亞群,除外泌體之外,還有質膜來源的囊泡,名稱包括微囊泡、脫落囊泡、外膜囊泡、癌小體以及凋亡小體等。這些EVs亞群在粒徑范圍、內含物類型,以及生物學功能上,存在不同程度的重疊與區分。分離和提取外泌體的方法很多,但都是基于外泌體的某一種或若干種的理化性質來實現的[14-15],包括以下方法[16-23]。
2.1 超速離心法 依據密度特性,通過超高速離心將外泌體從生物流體中分離出來的方法。若結合蔗糖墊使用,能夠讓外泌體富集在密度1.13~1.19 g/mL的餾分中,從而提高產物純度。
2.2 超濾法 根據特定截留分子量的超濾膜,將粒徑較大的外泌體從生物流體中分離出來的方法。
2.3 排阻色譜法 當生物流體通過排阻色譜柱時不同分子量的顆粒或分子會因流速不同而被分配到不同餾分中,可用于外泌體的純化。
2.4 免疫磁珠法 通過將涂覆有抗標記抗體(如CD63、CD81和CD9)的磁珠與外泌體結合,可以選擇性分離外泌體。
2.5 聚乙二醇沉淀法 聚乙二醇能夠在水溶液中形成網狀聚合物結構并通過“劫持”水分子的方式改變外泌體溶解度,在較低的離心力下與外泌體共沉淀。
2.6 微流控芯片技術 利用微流控芯片技術可以將外泌體的分離、回收、檢測等多種操作整合至微米級別的芯片上進行。
2.7 其他分離方法 除上述方法外,還有利用細胞膜親和性、靜電作用、不同水溶性聚合物或有機溶劑對外泌體進行提取的方法,在此不一一贅述。
共識專家認為上述的所有分離方法,都存在各自的局限性。到目前為止,外泌體的分離方法還尚無公認的“金標準”。無論那種方法都不能將外泌體與其他EVs亞群徹底分離。考慮到分離方法還沒有標準化,為確定研究工作中所描述的內含物分子或生物學功能的確來自于EVs而非其他雜質,ISEV提出了最小化實驗要求(MISEV2014),建議對EVs進行必要的鑒定表征和功能學實驗。但我們也認識到這套方法對于非EVs雜質的鑒定并不充分。設計實驗對產物中非EVs雜質含量進行表征,又或者設法耗盡非EVs雜質及其生物學活性,可能有助于提高研究結果的可靠性。
共識專家認為雖然目前還無所謂的“金標準”,但未來出現更好的EVs分離技術是大概率事件。而且,隨著我們對EVs認識的不斷深入,問題也可能以另外的途徑得到解決。例如,有人提議使用sEV(即small extracellular vesicle)這樣的表述來定義直徑小于200 nm的囊泡。雖然看似缺乏生物學意義,實質更具可操作性。共識專家對此持開放態度,實踐是最好的檢驗標準。對于希望開展外泌體研究的科研工作者,建議根據樣本類型和下游的科學問題來選擇提取方法。
3 外泌體分析方法需要“量體裁衣”
3.1 外泌體形貌分析 使用透射電子顯微鏡或原子力顯微鏡,能夠對單個EV的形貌和粒徑進行表征。
3.2 外泌體群體的粒徑分析 納米粒子示蹤分析技術、動態光散射,或電阻脈沖傳感,能夠統計大量外泌體的粒徑分布情況。
3.3 外泌體蛋白質分析 蛋白質印跡、流式細胞儀、ELISA或質譜技術可用于分析外泌體(EVs)所攜帶的蛋白標志物。
3.4 RNA分析 二代測序可以了解外泌體中的RNA組成,對于已知的RNA可以通過qPCR或Northern印跡進行驗證。測序可能因為拼接偏倚,導致轉錄表達錯誤。微陣列技術可用于RNA含量的表達譜分析,但不能用于發現新序列。
3.5 DNA分析 與RNA分析相似,PCR、微陣列技術可以用于分析已知的DNA分子,二代測序可以用于新序列的發現。
3.6 代謝分析 外泌體代謝物包括脂質、糖、氨基酸等小分子,代謝物的變化可以反映來源細胞的生化狀態。
一方面,外泌體因其尺度特點,對原有的分析技術提出了新的挑戰。例如,傳統流式細胞儀無法測量粒徑<300 nm的顆粒,然而結合了瑞利散射和鞘流單分子熒光檢測技術的超高靈敏流式檢測系統可以對粒徑低至40 nm的EVs的進行快速表征[24]。
另一方面,分析外泌體標志物豐度普遍偏低。例如,即使是外泌體中含量較高的microRNA平均每個外泌體內還不足一個拷貝[25]。類似的,為了解決外泌體中蛋白質定量的技術挑戰,新一代的蛋白分析方法正在開發中,如小顆粒流式細胞儀、微核磁共振、納米等離子體外體傳感器等。與傳統的檢測方法相比,這些方法所需樣本量更少,并且操作簡單。
種植抗病品種是最經濟有效的防治方法,目前尚無玉米瘤黑粉病免疫品種,但自交系和雜交種之間抗病性有明顯差異。利用抗黑粉病自交系材料,配制雜交種用于生產。
由此可見,根據外泌體的特性“量身定制”分析方法和檢測手段,未來會成為常態。雖然外泌體有著豐富的內含物,但針對外泌體RNA的報道要多于其他內含物,這一定程度上是檢測技術發展不均衡所導致的結果。隨著技術的不斷進步,分析方法的選擇勢必會擁有更廣泛的空間。于此同時,多學科的交叉,如基于人工智能的多組學算法開發,有望改變傳統單一標志物的概念,以組學的、圖譜式的方式對標志物進行重新定義。共識專家認為實現這一目的,離不開多學科人才的積極參與跟配合。
4 外泌體——液體活檢的“第三駕馬車”
共識專家中許多位既往有或目前從事其他液態活檢技術如循環腫瘤DNA(circulating tumor DNA,ctDNA)和循環腫瘤細胞(circulating tumor cell,CTC)的經歷。我們欣喜的看到在過去短短數年中,液體活檢技術發展迅速,已經向臨床展示了其巨大的便捷性和信息豐度。由于能夠攜帶了母細胞來源的蛋白質、RNA和DNA,外泌體提供了一種可以實時動態監測疾病狀態的新方式,成為繼ctDNA和CTC之后液體活檢領域的“第三駕馬車”[26-27]。
共識專家認為在3大液體活檢技術之中,CTC是從實體腫瘤脫落并侵入外周血循環的腫瘤細胞,不僅攜帶了腫瘤的全部分子特征,還有細胞形態學信息;ctDNA是血液中腫瘤來源的DNA片段,直接來源于實體腫瘤或CTC;外泌體論尺度和所攜帶的信息量均介于二者之間。多數專家認為3種技術雖各有所長(表1),但總體而言,外泌體至少在2個方面更具優勢:①樣本形式更豐富。CTC和ctDNA主要來自于外周血,而幾乎所有體液樣本都含有外泌體,外泌體幾乎“無處不在”;②內含物更穩定,得益于磷脂雙分子層的保護,外泌體內含物具有較好的穩定性,雖然CTC也有細胞膜,但是進入外周血后只有極少數能夠抵達遠端,多數CTC的命運是失巢凋亡或被吞噬。
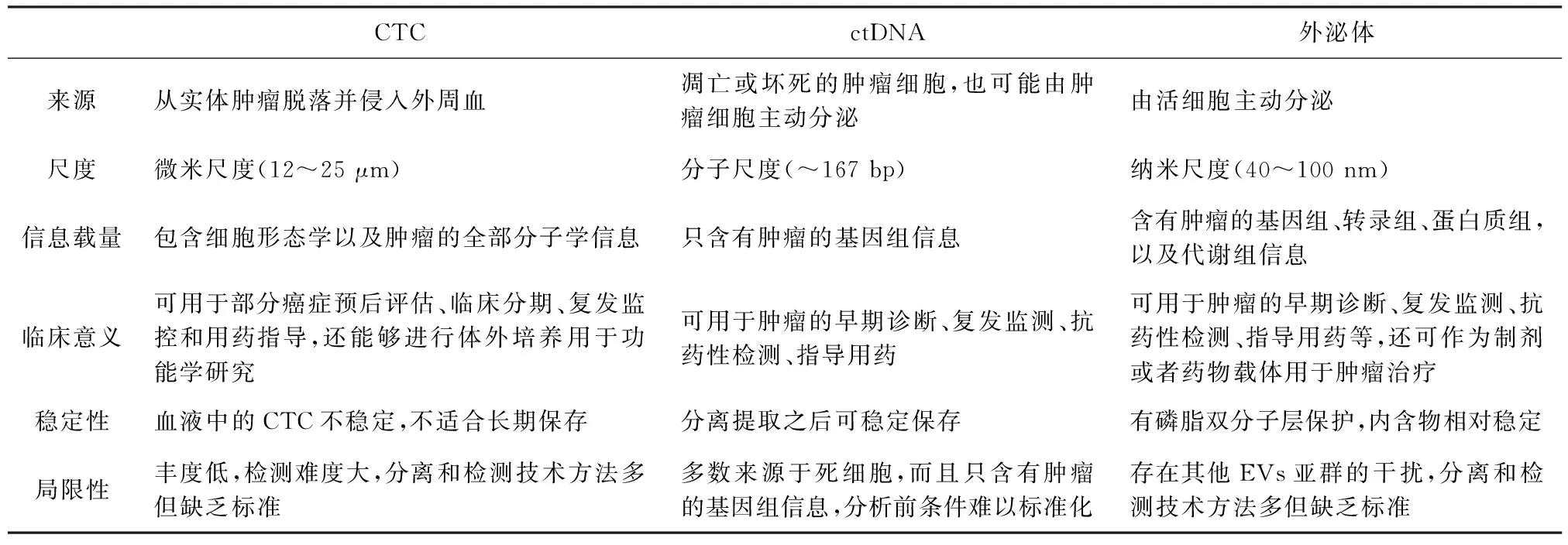
表1 現有液體活檢技術特點及對比
共識專家反復提到外泌體和腫瘤異質性的關系。作為惡性腫瘤的一個特征,腫瘤異質性是目前腫瘤診斷和治療的最大挑戰之一。深入研究腫瘤異質性,可以更好地闡釋腫瘤發生、發展的原因,并可能指導人們制定更精細的治療策略。然而,腫瘤異質性既體現在空間上也體現在時間上。受采樣區域和采樣時間的限制,傳統的組織活檢難以對腫瘤的異質性進行實時動態的反映。液體活檢在很大程度上避免了這兩點限制,能夠涵蓋更廣泛的腫瘤亞群,并且可以多時間點采樣對腫瘤異質性進行動態跟蹤。由于ctDNA只能反映基因組信息,無法全面反映轉錄組、蛋白質組、代謝組以及細胞形態學上的異質性。CTC雖然攜帶了最為豐富的信息,但是因其豐度太低(0~102/mL),需要獲得多少數量的CTC才足夠反映整個腫瘤的異質性,尚且無明確的結論。相比之下,來源于幾乎所有腫瘤細胞,且豐度較CTC更高的外泌體給人們帶來了希望。隨著分離和鑒定技術的發展和完善,外泌體是否能夠更好更全面的反映腫瘤的異質性成為共識專家共同關心的議題。專家期待通過后續研究能夠得出更詳實的答案。
目前,雖然CTC、ctDNA和外泌體3大液體活檢技術在國際上均有診斷產品問世,但缺乏統一的標準似乎是液體活檢領域目前共通的問題,希望在多學科的共同努力之下,能夠盡快突破相應的技術瓶頸,以達成統一的標準規范,將使得上述3種技術的臨床和應用價值得以實質性的體現。
5 外泌體標準化之路——道阻且長
在外泌體研究中,不可避免地會存在來自其他EVs亞群的干擾。此外,生物流體中還存在包括蛋白復合物(AGO2)、脂蛋白(高密度脂蛋白、低密度脂蛋白和乳糜微滴)以及微生物等可能對后續實驗構成影響的干擾物[28]。樣本采集和保存過程中的諸多因素,也可能對外泌體構成未知的影響。共識專家認為目前缺乏標準化的提取和分析技術,外泌體標志物豐度低等一系列問題,為外泌體研究的標準化之路構成了重重障礙。
古語有云“道阻且長,行則將至”。多學科的交叉和相互促進勢必為EVs及外泌體的研究和應用帶來廣闊的前景,包括物理、化學、傳感以及工程學領域的技術進展,將有助于對外泌體的功能和化學計量進行更精確的分析,甚至在單囊泡水平對其組份進行鑒定及表征。人造EVs標準品的研制等工作,將有利于EVs及其內含物回收效率的標準化校驗,并促進獨立驗證結果。隨著新技術的不斷發展,尤其是對外泌體的理化特性、生物學功能的理解進一步加深,多學科的共同關注和研究投入,未來必定會有更好的外泌體分離、分析技術不斷涌現。面對這些標準化問題,各研究團隊應當主動出擊,匯聚多方力量共同尋求突破口。
6 展望
隨著個體化和精準醫療概念的提出,越來越多的研究者開始關注如何做到疾病的精準診斷及治療。外泌體作為一個新的研究熱點,由于它在體內分布的廣泛性和獲取的便捷性,已經成為疾病診斷治療的潛在有效方式,在精準治療上有著光明的前景。未來外泌體標志物不僅能夠用于疾病診斷、指導個性化治療,還可能用于疫苗開發與免疫治療、基因治療、靶向藥物治療等,為人類最終攻克癌癥等醫學難題帶來新的希望。
外泌體技術在臨床應用研究仍然處于初級階段,其面臨的諸多挑戰也伴隨著誕生無數新發現和新技術的可能性。在重大疾病如惡性腫瘤中的功能研究及診療應用已經呈現其巨大的潛力及可能性,新興的領域中,新的認知和共識將不斷出現甚至顛覆。雖然其標準化的產生,可能是一個漫長和反復的過程,但如同礦藏一般,深挖一尺,便有一尺的驚喜。
專家組組長:張 灝
執筆者:張 灝,趙立波,葉國棟
專家組單位和成員(按照單位和姓氏拼音排序)
澳大利亞新南威爾士大學(李 勇)
北京恩澤康泰生物科技有限公司(趙立波)
大連醫科大學(劉婷姣)
廣州金域醫學檢驗集團股份有限公司(李曉華)
國家納米科學中心(孫佳姝)
哈爾濱醫科大學(黃小義)
荷蘭格羅寧根大學(林宇晟)
暨南大學(董宏梅,王 通,葉國棟,張冬梅,張 灝)
南方醫科大學(李 欣)
上海華盈生物醫藥科技有限公司(張慶華)
上海中科新生命生物科技有限公司(寧嬋娟)
深圳大學(李曉武)
四川大學(賈 大)
廈門大學(蔡望宇,顏曉梅)
浙江大學(張 龍)
中國醫科大學(曲秀娟)
中山大學(李 疆,李孟鴻,宋立兵)

