基于聚合酶鏈式反應的腸道病原菌檢測技術
陳 瑩(CHEN Ying),胡 蕊(HU Rui),劉穎勛(LIU Ying-xun),王真真(WANG Zhen-zhen),張林艷(ZHANG Lin-yan),顧 兵(GU Bing),李 穎(LI Ying),王 鑫(WANG Xin)
(1徐州醫科大學醫學技術學院,江蘇 徐州 221004;2西安交通大學醫學部基礎醫學院,陜西 西安 710061;3南京巨鯊顯示科技有限公司市場管理部,江蘇 南京 210036)
腸道感染性疾病重要病原菌,如志賀菌和沙門菌等感染發病率高、傳播速度快、耐藥發生率也高[1-2]。據文獻報道,肝硬化[3]、HIV 感染[4]、炎 癥性腸道病[5]以及血糖調節[6]等均與腸道菌群失調有關。此外,引起胃腸道感染的食源性致病菌是食品安全的嚴重隱患[7],可引起胃腸炎、敗血癥等疾病。因此,快速檢測威脅人類健康的病原菌刻不容緩。目前,臨床常規的病原菌檢測技術多采用傳統細菌培養并進行生化反應及血清學鑒定等,耗時繁瑣,檢測靈敏度低,且檢測技術人員的操作水平和經驗也對檢測結果的準確性有重要影響[8]。研發靈敏度高、特異性強的檢測技術進行病原菌的快速檢測,在疾病預防以及臨床診斷、指導用藥等方面具有重要意義。1985年美國Kary mullis首次提出聚合酶鏈式反應(polymerase chain reaction,PCR)技術,該技術因其高效、靈活以及快速等特點被廣泛應用。由于傳統PCR技術存在一定缺陷,為彌補該檢測方法的不足,一系列基于PCR原理的新型檢測技術不斷研發,為腸道病原菌的鑒定提供了有效的指導與技術支持。本文就基于PCR技術原理的腸道病原菌檢測技術進行歸納綜述,并分析比較各類方法的優缺點。
1 PCR技術的基本原理
傳統PCR技術的基本思路與DNA的天然復制過程相似,包括變性、退火和延伸。擴增過程中,以單鏈DNA為模板,寡核苷酸為引物,在DNA聚合酶的作用下沿5’→3’方向擴增DNA片段,使目的基因得以大量復制[9](見圖1A)。以腸道病原菌特異性靶基因為研究對象,通過PCR引物的設計與合成,以臨床微生物樣本的基因組DNA為模板,可實現腸道病原菌特異性靶基因的PCR快速檢測。通過該技術,可以進行12種志賀菌毒力因子的快速檢測[10]以及該腸道病原菌的耐藥性檢測[11]。盡管傳統PCR技術具有高效、靈活以及快速等優點(見表1),但是該技術仍受采樣過程中無菌操作、樣品預處理以及定量不準確等因素的影響,而作為對傳統PCR技術的補充,基于PCR原理的衍生檢測技術為腸道病原菌的鑒定提供了有效指導與技術支持。
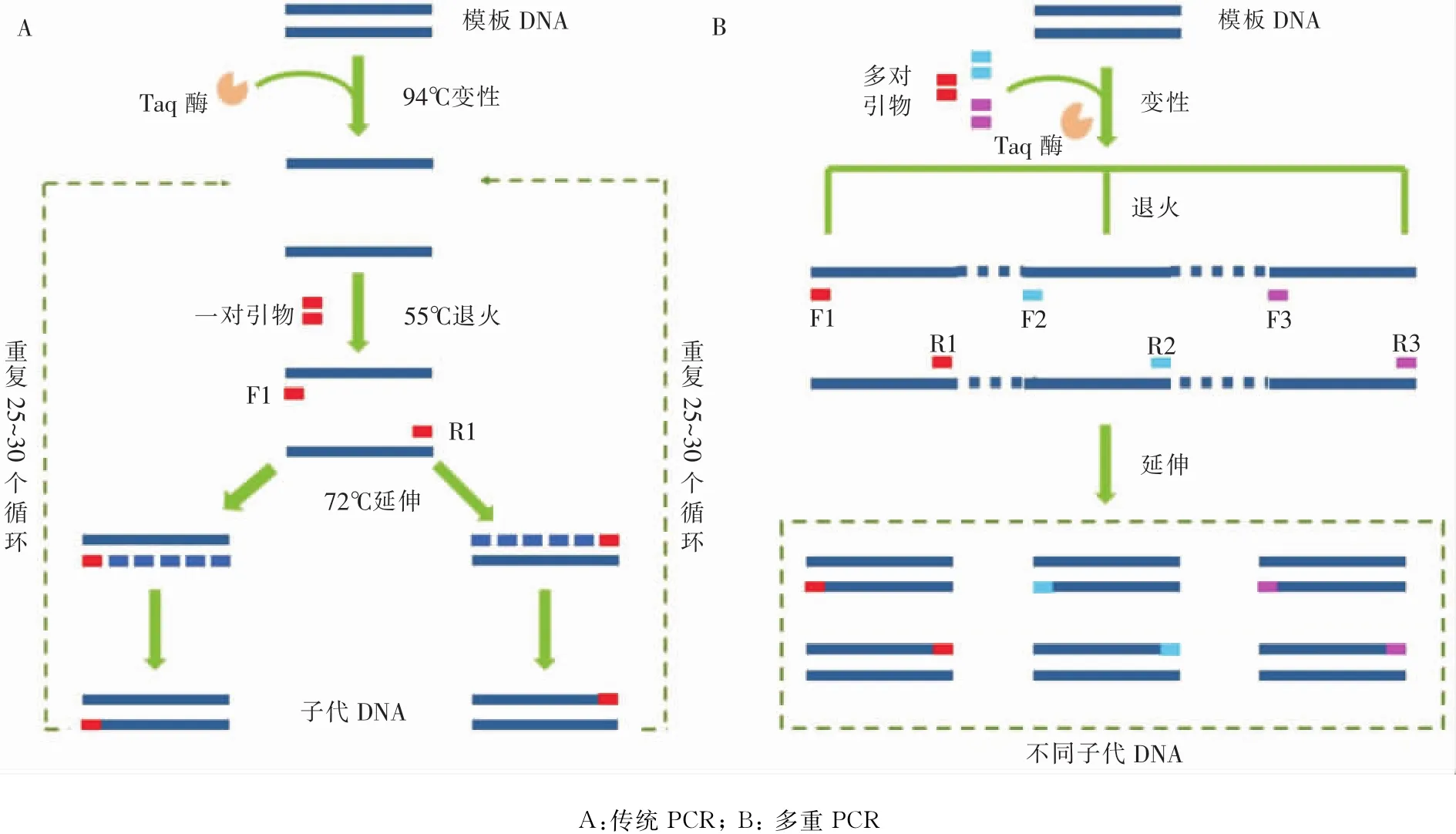
圖1 PCR原理圖
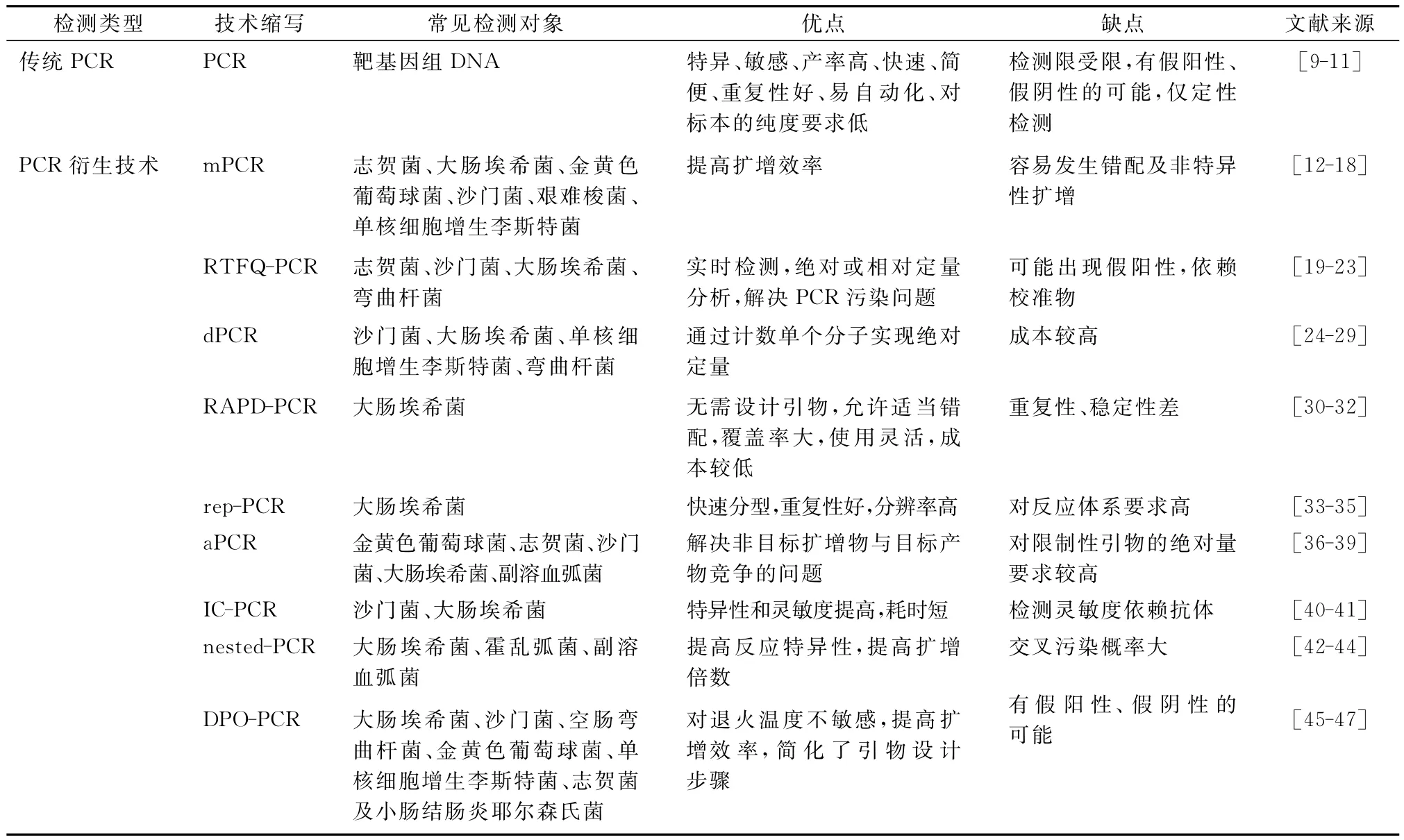
表1 不同PCR方法的優缺點比較
2 基于PCR技術的腸道病原菌檢測
2.1 多重PCR(multiplex PCR,mPCR) Chamberlain于1988年首次設計并命名了多重PCR,該方法是普通PCR技術的延伸,旨在一個擴增體系中添加多對引物,完成多個目的片段的擴增,達到同時進行多種靶基因檢測的目的(見圖1B)。通過多重PCR技術,研究者對志賀菌、侵襲性大腸埃希菌及艱難梭菌進行了快速檢測[12-13]。孟相秋等[14]應用該方法,對腸毒性大腸埃希菌(ETEC)的腸毒素基因STa、STb、LT-I和LT-II同時進行檢測,檢測結果證明了該方法的高效性與特異性。Van等[15]成功建立了食源性大腸埃希菌O157∶H7 stx1、stx2靶基因的快速檢測技術,與傳統培養方法相比,該方法可將檢測時間縮短至2 d。此外,與傳統血清學方法相比,腸道病原菌如沙門菌、大腸埃希菌等分型繁多,多重PCR既可以較大程度地提高致病菌的檢出率,同時還可以鑒定其型別及突變。張曉云等[16]對比多重PCR與血清凝集法鑒定志賀菌,結果顯示,前者的檢出率(55.00%)高于后者(33.33%),表明多重PCR技術有助于提高腸道病原菌檢測的準確性及有效性。此外,有研究團隊[17]結合多重PCR技術與基因芯片技術,進一步嘗試致病菌的高通量檢測。理論上,相較于傳統PCR而言,多重PCR更高效,但李新福團隊在對比傳統和多重PCR檢出限時,發現多重PCR的靈敏度明顯下降[18]。因此,我們通常需要對多重PCR的反應體系,如引物濃度、退火溫度、退火時間以及DNA聚合酶含量等參數進行優化。
2.2 實 時 熒 光 定 量 PCR(real-time fluorescent quantitative PCR,RTFQ-PCR) RTFQ-PCR 是一種能將核酸放大并同時進行核酸產物檢測的方法,以TaqMan探針技術為例,探針完整時,報告基團發射的熒光信號被淬滅基團吸收;PCR擴增時,Taq酶的5’→3’外切酶活性將探針酶切降解,使報告熒光基團和淬滅熒光基團分離,熒光信號產生,即每擴增一條DNA鏈,就有一個熒光分子形成,熒光信號的累積與PCR產物的形成完全同步(見圖2A)。該技術實現了PCR從定性到定量的突破,具有更高的靈敏度、特異度及精確性。與傳統PCR方法相比,該方法最大的優勢是全封閉操作以及不需要后續的分析過程,顯著縮短了檢測時間,并減少了標本污染的可能性。Barletta研究團隊曾利用該方法對志賀菌、沙門菌和彎曲桿菌進行了識別[19]。胡慧等[20]使用該技術對大腸埃希菌O157∶H7特異性基因進行檢測,結果顯示純菌檢測的靈敏度可達2×10 CFU/mL,同時假陽性率降低,其檢出率是普通PCR的兩倍多。高春燕團隊針對志賀菌屬侵襲性質粒抗原H基因(ipaH)建立了志賀菌快速敏感的熒光定量PCR檢測方法,檢測下限可達200拷貝/mL[21]。劉生峰等[22]使用基于TaqMan探針的熒光PCR技術檢測腸出血性大腸埃希菌O157∶H7,實驗顯示該方法的線性范圍為102~108CFU/mL,檢測限達20 CFU/mL。麻麗丹團隊將 Taqman MGB(Minor Groove Binder)探針技術與實時PCR相結合,于2 h內完成水產品中沙門菌的檢測,純菌檢測限達13 CFU/mL[23]。
2.3 數字PCR(digital PCR,dPCR) dPCR是一種定量分析技術(見圖2B),擴增前首先對樣品進行預處理,使含有核酸分子的反應體系被劃分為成千上萬個獨立反應室,每個反應室中含有零、一個至數個待檢靶核酸分子。經PCR擴增后,通過檢測每個反應室,含有單個模板分子的反應室產生陽性信號,其數量可通過絕對定量的方式讀出,根據泊松分布原理及陽性微滴的個數與比例,即可得出靶分子的起始拷貝數或濃度。該方法確保了痕量核酸也可獲得高拷貝的定量結果[24-25]。
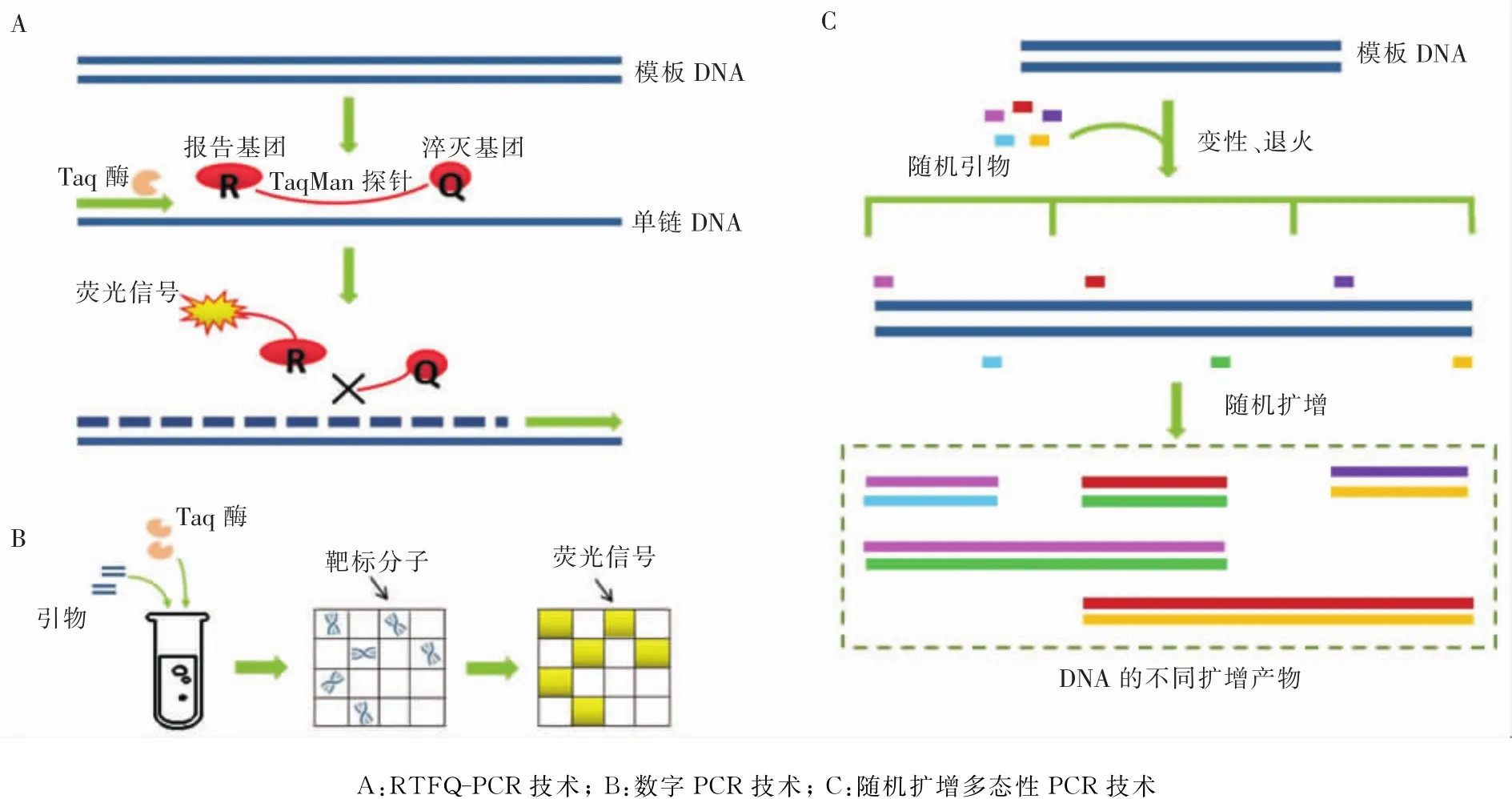
圖2 衍生PCR技術原理圖
董蓮華等[26]通過該方法建立了大腸埃希菌O157∶H7的檢測體系,檢出限可達10 CFU/mL。此方法除靈敏度高,特異性強外,更有無需核酸標準品的優點。王靜團隊將疊氮溴化丙錠與微滴數字PCR技術(ddPCR)相結合,對沙門菌進行檢測,檢出限為8.0拷貝/20μL,在檢測人工污染雞肉樣品時,最低可檢出102CFU/mL的沙門菌[27]。Bian等[28]另選擇了油飽和的聚二甲基硅氧烷與ddPCR技術相結合,對致病性大腸埃希菌O157和單核細胞增生李斯特菌進行檢測,同時對比RTFQ-PCR技術,結果顯示,前者具有高靈敏度的特點,最低檢測限達10 CFU/mL,但該方法的缺點是穩定性和精密度略低于后者;Suo等[29]成功驗證此法,針對大腸埃希菌O157∶H7、腸炎沙門菌、單核細胞增生李斯特菌和空腸彎曲桿菌的不同70聚體寡核苷酸,開發了病原體微陣列檢測技術,結合多重PCR擴增,成功區分了4種病原體,其檢測靈敏度為1×10-4ng(約20拷貝)/每個基因組DNA。
2.4 隨機擴增多態性 PCR(random amplified polymorphic DNA PCR,RAPD-PCR) 1990年,由Williams建立起來的一項DNA多態檢測技術—RAPD-PCR,進入廣大研究人員視野,該技術具有多態性檢測的特點,打破了傳統PCR技術使用特定核苷酸序列作為引物的慣例,采用一系列人工合成的隨機寡核苷酸鏈,對所研究的基因組DNA進行PCR擴增(見圖2C),通過該技術可有效研究腸桿菌亞群之間的遺傳性差異,以及尿路感染(UTI)大腸埃希菌多重耐藥分離株的遺傳分型[30-31]。此外,Alni等[32]利用該技術對人、牛和食品樣品中分離的金黃色葡萄球菌進行基因分型,確定分離株之間的遺傳關系,從而進行感染流行病學的監測與控制。
2.5 基因組重復序列 PCR(repetitive element PCR,rep-PCR) rep-PCR是利用設計好的引物擴增目標DNA間高度保守的重復序列,得到不同區域間的擴增圖譜,分析目標基因組的多態性。該方法具有高分辨力,常用于病原菌的分子分型、基因圖譜制作、溯源性的系統分析等,其中腸桿菌基因間重復共有序列-PCR(ERIC-PCR)是重要的檢測方法之一。Ranjbar等[33]應用ERIC-PCR對地表水大腸埃希菌菌株的基因組指紋圖譜進行分析;Abakpa研究小組應用該方法對從蔬菜、灌溉水等440份樣本中分離的耐藥性大腸埃希菌O157∶H7進行指紋圖譜分析,揭示了發展中國家耐藥性菌株的傳播威脅[34]。張輝團隊利用此方法對分離自食品及住院患者的大腸埃希菌菌株進行檢測,為防控食源性大腸埃希菌引起的疾病提供了有力的實驗依據,但該方法也有不足之處,如對反應體系要求較高[35]。
2.6 不對稱 PCR(asymmetric PCR,aPCR)aPCR技術其反應原理和操作步驟與傳統PCR相似,主要區別是體系中添加了不等量的一對引物。在DNA聚合酶的催化下,通過對不等量引物結合的DNA片段進行擴增,在擴增前期其產物主要是雙鏈DNA,而擴增后期則為大量單鏈DNA[36]。因不存在互補雙鏈的競爭性結合,使得該方法的雜交效率及檢測靈敏度提高[37-38]。王小強團隊利用多重不對稱PCR技術結合基因芯片技術,建立了一種可同時檢測7種常見食源性致病菌的方法,并使基因組DNA的檢測靈敏度達0.1~1 pg,該方法提供了一種特異性檢測單一和混合感染目標菌的手段[39]。
2.7 免 疫 捕 捉 PCR(immuno-capture PCR,ICPCR) IC-PCR是免疫捕捉與傳統PCR相結合的一門技術,在傳染病診斷、流行病學調查等諸多領域有著廣闊的應用前景。該方法首先將特定抗原微生物通過固相或均相抗體特異性捕捉,之后通過加熱等步驟完成PCR模板的制備,再利用基因組序列特異性引物進行PCR擴增,從而對樣本中的病原微生物進行定性或定量分析(見圖3A)。張體銀等[40]采用免疫捕捉-通用引物PCR(IC-UPPCR)對食品中的沙門菌進行檢測,檢測靈敏度可達2×102CFU/mL,該技術表現出特異性好、靈敏度高和高通量等特點,適用于食品衛生監管以及臨床診斷等領域。高濤團隊將免疫磁珠捕獲-通用引物PCR(IMC-UPPCR)與傳統培養法進行比較,結果顯示免疫捕捉PCR與傳統培養法符合率達93.22%[41],說明該方法還有進一步的發展空間和廣闊的應用前景。
2.8 巢式PCR(nested-PCR) nested-PCR又稱套式PCR,即通過兩對PCR引物進行兩輪PCR擴增,得到完整的目的片段。利用第一對PCR引物進行常規PCR擴增,之后利用第二對引物(即巢式引物,設計于第一次PCR擴增產物的內部)進行二次擴增,第二對引物可結合在第一次PCR產物的內部,使得第二次PCR擴增片段短于第一次擴增片段(見圖3B)。該方法特異性強、靈敏度高,可避免由于環境污染造成的假陽性結果,成本也相對較低。樊琛研究小組通過套式PCR技術檢測了10株大腸埃希菌的iss基因,并探討該技術的檢測缺陷和改進方法[42]。陳愛平等[43]通過該方法對外環境水中的致病霍亂弧菌進行監測,在保證霍亂監測數據靈敏度的同時,有助于追蹤霍亂的傳播趨勢。樊曉琳等[44]通過nested-PCR對水產品中的副溶血弧菌進行快速檢測,結果表明該方法對副溶血弧菌純培養物的檢測限為6.62 CFU/mL,對 DNA 的檢測限為200 fg,且該方法與國家標準檢測方法結果一致,但檢測時間更具優勢。
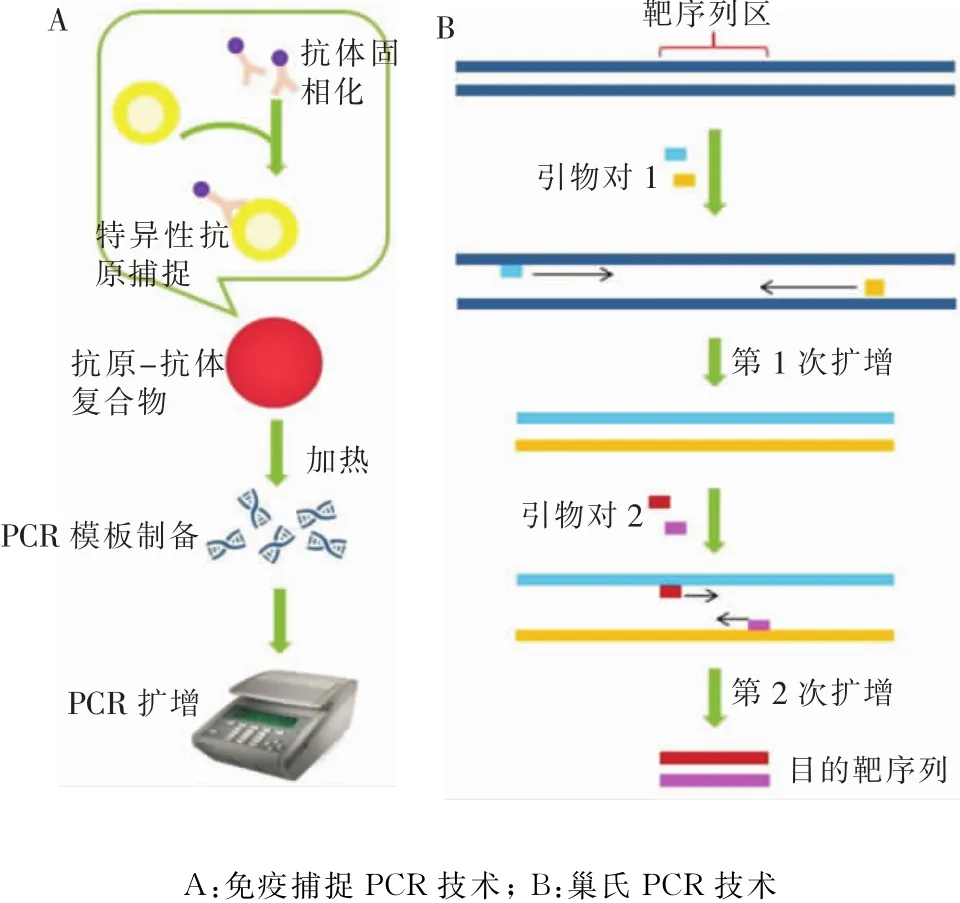
圖3 衍生PCR技術原理圖
2.9 雙啟動寡核苷酸PCR(dual priming oligonucleotide PCR,DPO-PCR) DPO-PCR 是一種融合新型引物設計方法,進行靶基因快速檢測的新技術。在該技術中,DPO引物由三個區域組成:較長的5’-區段、較短的3’-區段,以及橋接5’-和3’-區段的聚肌苷酸[poly(I)]連接物[45]。該檢測技術可以有效消除錯配引發,從而提高PCR擴增的特異性,其檢測結果要比傳統PCR方法更精確。該方法可有效檢測腸出血性大腸埃希菌O157∶H7,其檢測靈敏度低至94 CFU/mL[46]。針對致病性大腸埃希菌,李丹丹研究小組建立的DPO-PCR檢測體系,其靈敏度為97 CFU/mL[47],上述實驗為精準、快速檢測大腸埃希菌提供了新的檢測思路。此外,基于DPO-多重PCR技術可以同時進行沙門菌、空腸彎曲桿菌、金黃色葡萄球菌、單核細胞增生李斯特菌、志賀菌及小腸結腸炎耶爾森菌的快速檢測,為食源性病原菌的快速檢測提供了有效檢測手段[45]。
3 其他PCR技術
其他基于PCR原理的腸道病原菌檢測技術包括與新興檢測技術結合的檢測方法,如隨機PCR結合基因芯片技術[48]、多重PCR結合基因芯片技術[17,49]、傳統PCR與變性高效液相色譜法結合的多重PCR-DHPLC技術[50-51]、PCR 技術結合免疫層析技術(PCR-ICT)[52]和多重熒光PCR結合 Allglo探針技術[53],上述技術在腸道致病菌,如致瀉性大腸埃希菌、艱難梭菌等的快速檢測中發揮著重要作用。
4 討論
PCR技術自問世以來,在醫學檢驗等領域,如臨床疾病診斷,細菌、病毒以及寄生蟲定性和定量檢測等方面取得了巨大成就[54-57],并成為常用臨床快速檢測方法之一。由于傳統PCR技術存在易交叉污染、產生假陽性及定量不準確等缺點,已經不能滿足人們的檢測需求。研究人員研發的各種基于PCR原理的衍生技術,可針對PCR各方面的性能進行不斷地突破:如將變性高效液相色譜及量子點免疫層析技術與 PCR 技術相結合[50,58],提高了檢測速度與靈敏度;將傳統瓊脂糖電泳替換成基于測序儀的熒光毛細管電泳,提高了分辨性[59-60],解決反應產物處理后的污染問題;將熒光基團引入引物擴增便于進行實時監測,改進了時效性[61]并避免相關物質的干擾。盡管現有PCR衍生技術自身仍存在不足,還需要在檢測成本、穩定性等方面進行優化,然而在醫學檢驗診斷中,這些方法因其具有的顯著優勢,仍將發揮重要的作用。總之,隨著創造性地將PCR及其衍生技術與現代分子生物學檢測新技術相結合,以及生物芯片、質譜、拉曼光譜等新技術的不斷推廣及檢測水平的不斷提升,PCR技術的限制正在逐漸被打破,在腸道病原菌檢測方面的應用價值也得到了更大程度的體現,并在感染控制、衛生預防、食品安全監測等領域發揮著巨大作用。

