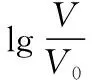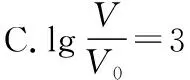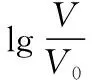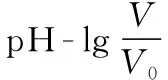突破電解質溶液中的圖象問題
文麗娟 楊恩健
湖北
分析近幾年全國及部分省市高考試題,電解質溶液中的圖象題頻繁出現,此類試題綜合性強,呈現出難度加大、坐標多元化的趨勢,不僅考查學生定性與定量相結合的分析思維,還考查學生數形結合識圖用圖的能力,也要求學生能深入微觀世界認識各種化學過程來解決微粒濃度大小問題。這是高考的重點與難點,對學生能力上的要求不斷提升,包括觀察和分析圖象的能力、分析和處理數據的能力、化學知識綜合遷移的能力等,通常學生對這類問題比較困惑,在進行高考復習備考中較為棘手,應將這類問題進行歸納匯總,以專題的形式進行復習突破。
一、關于滴定曲線的考查
1.一元強酸(堿)滴定一元弱堿(酸)曲線
【例1】用0.1 mol/L的NaOH溶液分別滴定體積均為20 mL,濃度均為0.1 mol/L的HCl溶液和HX溶液,溶液的pH隨加入NaOH溶液體積的變化如圖所示。下列說法正確的是
( )
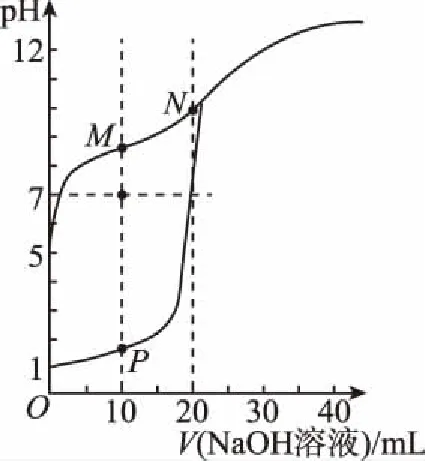
A.HX的電離平衡常數Ka約為1×10-5
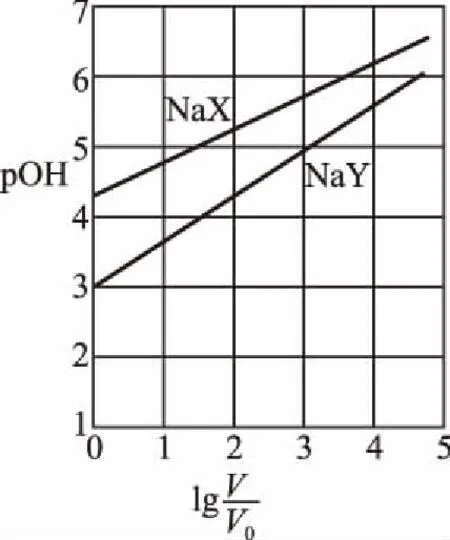
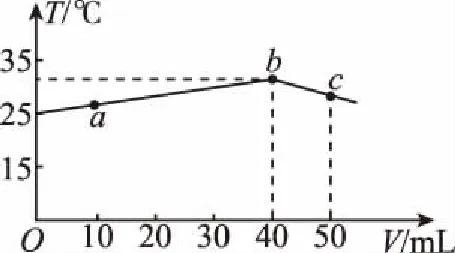
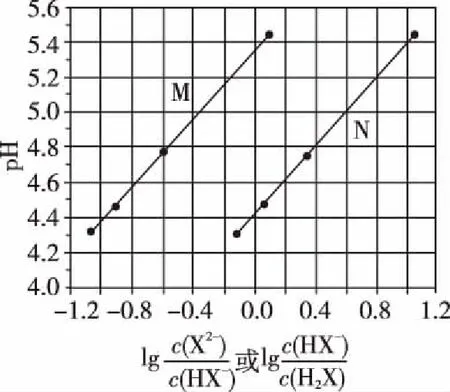
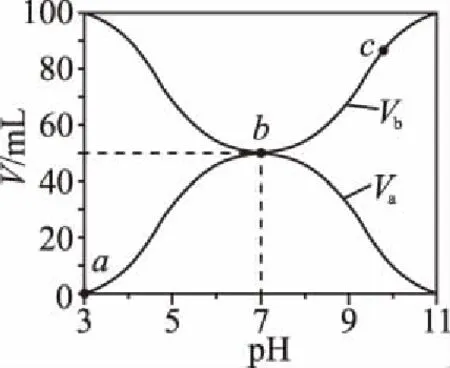
B.M點對應溶液中:c(HX) C.P點對應溶液中:c(Cl-)=0.05 mol/L D.N點對應溶液中:c(Na+)>c(X-)>c(OH-) >c(H+) 【答案】D 【例2】25℃時,向盛有50 mL pH=3的HA溶液的絕熱容器中加入1.0 mol/L pH=14的NaOH溶液,加入NaOH溶液的體積(V)與所得混合溶液的溫度(T)的關系如圖所示。下列敘述正確的是 ( ) A.HA溶液的物質的量濃度為0.10 mol/L B.a→b的過程中,混合溶液中不可能存在:c(A-)=c(Na+) C.b→c的過程中,溫度降低的主要原因是溶液中A-發生了水解反應 D.25℃時,HA的電離常數K約為1.25×10-6 【答案】D 【例3】(2017年高考新課標Ⅰ卷·13題)常溫下將NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH與離子濃度變化的關系如圖所示。下列敘述錯誤的是 ( ) A.Ka2(H2X)的數量級為10-6 C.NaHX溶液中c(H+)>c(OH-) D.當混合溶液呈中性時,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-) 【答案】D 這樣的題目往往有兩條曲線相對應,一定要看清楚圖中縱橫坐標表示的意義,找出關鍵的點并理解其含義。 【例4】25℃時,將濃度均為0.1 mol/L、體積分別為Va和Vb的HA溶液與BOH溶液按不同體積比混合,保持Va+Vb=100 mL,Va、Vb與混合液pH的關系如圖所示。 下列說法正確的是 ( ) A.Ka(HA)的值與Kb(BOH) 的值不相等 B.b點時,水電離出的c(H+)=10-7mol/L C.c點時,c(A-)>c(B+) 【答案】D 【例5】(2018新課標Ⅲ卷·12題)用0.100 mol/L AgNO3滴定50.0 mL 0.050 0 mol/L Cl-溶液的滴定曲線如圖所示。下列有關描述錯誤的是 ( ) A.根據曲線數據計算可知Ksp(AgCl)的數量級為10-10 B.曲線上各點的溶液滿足關系式c(Ag+)·c(Cl-)=Ksp(AgCl) C.相同實驗條件下,若改為0.040 0 mol/L Cl-,反應終點c移到a D.相同實驗條件下,若改為0.050 0 mol/L Br-,反應終點c向b方向移動 【答案】C 【解析】本題應該從題目所給的圖象入手,尋找特定數據判斷題目中沉淀滴定的具體過程。注意橫坐標是加入AgNO3溶液的體積,縱坐標是Cl-濃度的負對數。A.選取橫坐標為50 mL的點,此時向50 mL 0.05 mol/L的Cl-溶液中,加入了50 mL 0.1 mol/L的AgNO3溶液,所以計算出此時溶液中過量的Ag+濃度為0.025 mol/L (按照Ag+和Cl-1∶1沉淀,同時不要忘記溶液體積變為原來2倍),由圖示得到此時Cl-約為1×10-8mol/L(實際稍小),所以Ksp(AgCl)約為0.025×10-8=2.5×10-10,所以其數量級為10-10,選項A正確。B.由于Ksp(AgCl)極小,所以向溶液滴加AgNO3溶液時就會有沉淀析出,溶液一直是AgCl的飽和溶液,所以c(Ag+)·c(Cl-)=Ksp(AgCl),選項B正確。C.滴定的過程是用AgNO3滴定Cl-,所以滴定的終點應該由原溶液中Cl-的物質的量決定,將50 mL 0.05 mol/L的Cl-溶液改為50 mL 0.04 mol/L的Cl-溶液,此時溶液中的Cl-的物質的量是原來的0.8倍,所以滴定終點需要加入的AgNO3的量也是原來的0.8倍,因此應該由c點的 25 mL變為25×0.8=20 mL,而a點對應的是15 mL,選項C錯誤。D.鹵化銀從AgF到AgI的溶解度應該逐漸減小,所以Ksp(AgCl)應該大于Ksp(AgBr),將50 mL 0.05 mol/L的Cl-溶液改為50 mL 0.05 mol/L的Br-溶液,這是將溶液中的Cl-換為等物質的量的Br-,因為銀離子和Cl-或Br-都是1∶1沉淀的,所以滴定終點的橫坐標不變,但是因為AgBr更難溶,所以終點時,Br-的濃度應該比終點時Cl-的濃度更小,所以終點由c點移向b點。選項D正確。 【解題策略】 1.酸堿中和滴定曲線變化較多,解題時首先分析清楚縱橫坐標的含義,圖中曲線關鍵的點(起點、轉折點、交點)與縱橫坐標的含義。計算電離常數用電離常數表達式代入特殊點的數據,比較離子濃度大小先要判斷溶液的酸堿性,注意結合電荷守恒和物料守恒解決問題。這種題型考查的知識點多,靈活性、綜合性較強,有較好的區分度,它能有效地測試出學生對強弱電解質、電離平衡、水的電離、pH、離子反應、鹽類水解等基本概念的掌握程度以及對這些知識的綜合運用能力。解決這類題目必須掌握的知識基礎有:掌握強弱電解質判斷及其電離、鹽類的水解,化學平衡理論(電離平衡、水解平衡),電離與水解的競爭反應,化學反應類型,化學計算,甚至還要用到“守恒”來求解。 2.常溫下,一元強酸(堿)與一元弱堿(酸)滴定曲線是酸堿中和滴定曲線中最簡單的一種,答題時首先要計算出酸堿恰好完全反應時所需酸(堿)的體積。水的電離程度最大的點是酸堿恰好完全反應的點,離子濃度大小比較時先確定溶液顯酸性還是顯堿性,再根據電荷守恒和物料守恒解答。 3.常溫下,一種強堿滴定幾種弱酸的曲線:通過觀察圖象,首先要根據pH判斷出弱酸酸性相對強弱。計算酸的電離常數要找出關鍵的點,求出各微粒的濃度代入平衡常數表達式;根據越弱越水解比較離子濃度大小;注意電荷守恒、物料守恒的應用。 4.在絕熱環境中的反應,需要注意酸堿中和反應是放熱反應,隨著酸(堿)的不斷加入,溶液的溫度逐漸升高。水的電離過程是吸熱過程。 【思維建模】 酸堿中和滴定曲線的分析方法: 以一元強堿(NaOH)滴定一元弱酸(CH3COOH)為例,滴定曲線主要考查以下幾個關鍵點(起點、轉折點、交點): 一元酸和一元堿的中和滴定為例,滴定曲線主要考查 4個點: ①滴定起點,根據酸、堿的濃度及pH可以判斷酸、堿的強弱。 ②恰好反應點,此處為正鹽溶液,往往考查離子濃度大小比較。 ③溶液中性點,此處為中性溶液,往往考查消耗酸溶液或堿溶液的體積。 ④滴定2倍點,此處為等物質的量濃度的酸及其正鹽或堿及其正鹽的混合溶液,往往考查質子守恒。 二元弱酸(或鹽)溶液中離子濃度(或分數)圖象是近兩年高考試題中常出現的題型,主要考查弱電解質電離常數計算、電解質溶液中離子濃度的變化、離子濃度關系等,解題時要看清每條曲線代表的離子種類以及曲線的變化趨勢,計算電離常數時應利用曲線的交點(有兩種離子濃度相等)。 【例6】25℃,向0.1 mol/L H3PO4溶液中不斷加入濃NaOH溶液(溶液體積變化忽略不計),含磷微粒物質的量分數δ隨pH的變化曲線如圖所示。下列說法正確的是 ( ) 【答案】B 【解題策略】 1.讀圖:弄清圖象含義,通過觀察弄清橫坐標、縱坐標的含義及單位;搞清特殊點的意義,如坐標軸的原點,曲線的起點、終點、交叉點、極值點、轉折點等;分析曲線的變化趨勢如斜率的大小及升降。 2.識圖:進行信息提取,挖掘隱含信息、排除干擾信息、提煉有用信息,在統攝信息的基礎上進行邏輯推理或運用數據計算 【思維建模】 這類題型通常有以下幾種考查方式: 1.弱電解質的電離常數計算問題 計算電離常數看清楚是一級電離還是二級電離常數,根據電離方程式,寫出電離常數表達式,再找與電離平衡有關的離子濃度相等的點,代入電離平衡表達式;一般采用表達式中分子分母兩種酸根濃度相同(通常找交點)時的點進行平衡常數的計算。 2.考查溶液中離子濃度變化趨勢 根據溶液中離子濃度或離子濃度比值變化趨勢隨pH變化,先明確變化的pH范圍,用電離平衡或水解平衡的移動解答;離子濃度大小關系則要用物料守恒或電荷守恒解答,同時還要借助圖中曲線進行分析。 3.考查溶液中離子濃度關系 比較溶液中離子濃度大小要注意在哪一點或哪一pH范圍,利用物料守恒和電荷守恒解答,如果是一個不明確的關系式,需物料守恒和電荷守恒結合構造一個新的關系式判斷。離不開反應原理與平衡思想,離不開電荷守恒、物料守恒、質子守恒等守恒關系,離不開挖掘隱含在圖象中各種微粒的定性與定量關系。 ( ) A.HX、HY都是弱酸,且Ka(HX)>Ka(HY) D.分別向稀釋前的兩種溶液加鹽酸至pH=7時,c(X-)=c(Y-) 【答案】A 【解題策略】 1.pH相同的一元強酸與一元弱酸加水稀釋:由于弱酸溶液中存在電離平衡,根據越稀越電離的原則,在稀釋過程中n(H+)逐漸增大,在稀釋相同的倍數后,弱酸的c(H+)大于強酸的c(H+);加水稀釋后pH相同,弱酸中加水的量多。對強酸來說,溶液稀釋到原來的10倍,pH增大一個單位,溶液稀釋到原來的10n倍, pH增大n個單位; 對弱酸來說,由于存在電離平衡,溶液稀釋到原來的10倍,pH增大小于一個單位;對于弱酸來說,升高溫度促進弱電解質的電離。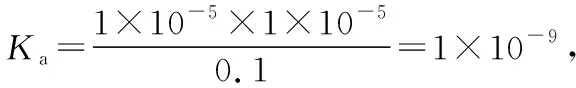
2.絕熱條件下,一元強酸(堿)與一元弱堿(酸)中和的滴定曲線
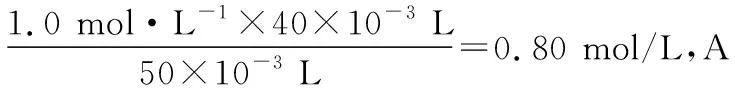
3.一元強堿滴定二元弱酸的曲線
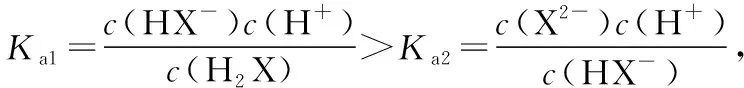
4.酸堿混合后總體積不變的中和滴定曲線
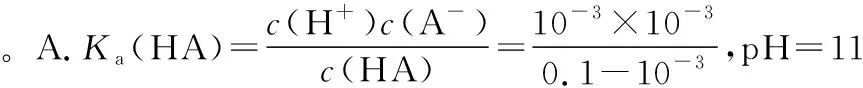
5.沉淀滴定曲線
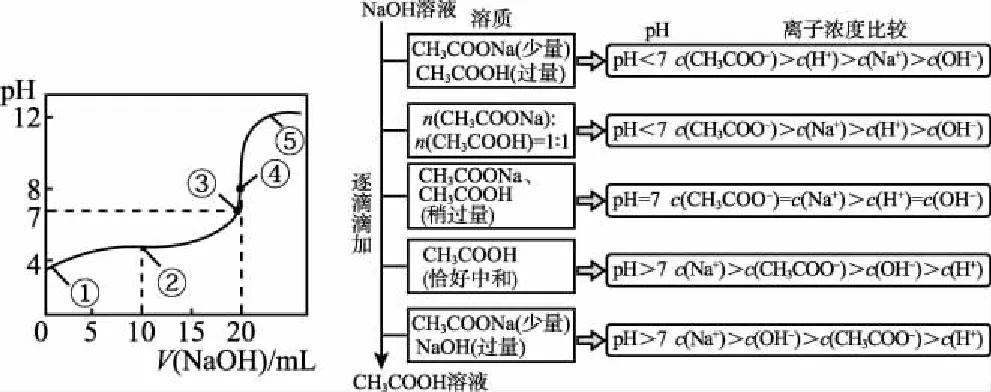
二、分布曲線的考查
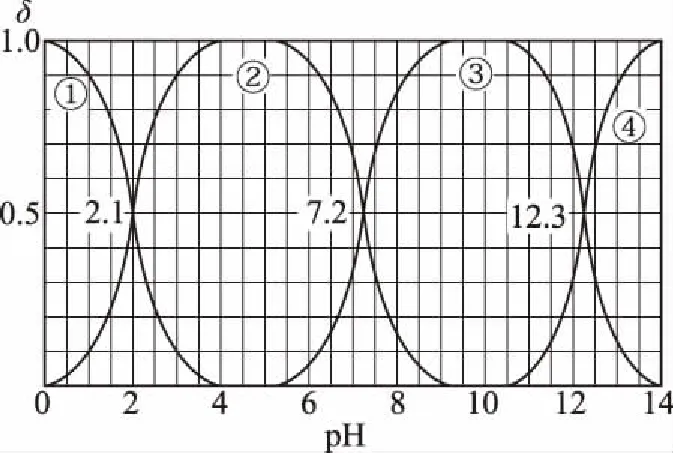

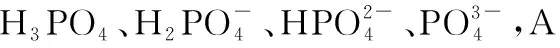
三、稀釋曲線的考查