基于數(shù)據(jù)演繹和認(rèn)知模型構(gòu)建探討化學(xué)平衡——由兩道高考真題及改編題引出的深度思考
李銀秀
湖南
平衡思想是高中化學(xué)核心素養(yǎng)之一。化學(xué)平衡保證了化學(xué)變化有限度,造就了物質(zhì)的多樣性,保持了化學(xué)物質(zhì)在質(zhì)的方面的穩(wěn)定性。化學(xué)平衡是一切平衡的基礎(chǔ),是中學(xué)階段重要的基本理論,也是教學(xué)的難點(diǎn)之一。對(duì)于一個(gè)具體的可逆反應(yīng),化學(xué)平衡狀態(tài)的建立與反應(yīng)途徑無(wú)關(guān),這是化學(xué)平衡的重要特征,其化學(xué)平衡常數(shù)只與溫度有關(guān),這是化學(xué)平衡的定量特征。在學(xué)習(xí)中,若能有效運(yùn)用這些特征,深入運(yùn)用數(shù)學(xué)模型,可深化理解化學(xué)平衡,同時(shí)提高運(yùn)用多學(xué)科知識(shí)解決較復(fù)雜問(wèn)題的綜合能力,促進(jìn)思維的深度發(fā)展,提升科學(xué)素養(yǎng)。根據(jù)2011年江蘇高考化學(xué)卷第15題改編的一道試題,是將數(shù)學(xué)思維模型與化學(xué)認(rèn)知模型充分融合的一道好題,由此也引發(fā)對(duì)2018年高考新課標(biāo)理綜Ⅰ卷第28題中有關(guān)化學(xué)平衡考查的深度思考。
一、 2011年江蘇高考真題節(jié)選及分析

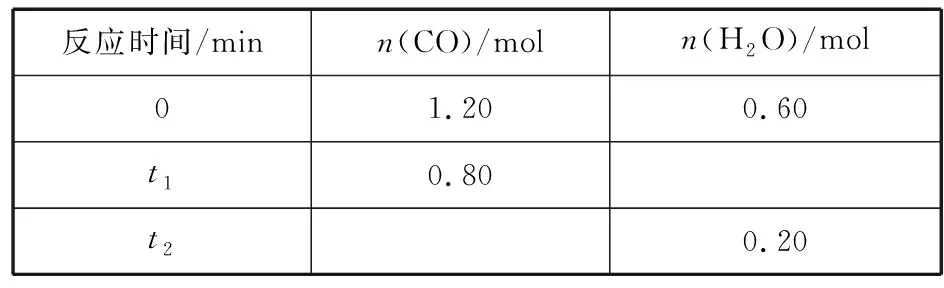
反應(yīng)時(shí)間/minn(CO)/moln(H2O)/mol01.200.60t10.80t20.20
分析“保持其他條件不變,起始時(shí)向容器中充入0.60 mol CO和1.20 mol H2O,到達(dá)平衡時(shí),n(CO2)=0.40 mol”是否正確。
分析:讀取表格信息可知0~t1時(shí)間段內(nèi),CO轉(zhuǎn)化物質(zhì)的量為1.20 mol-0.80 mol=0.40 mol,采用三段式分析法:

n(起始)/mol 1.20 0.60 0 0
n(轉(zhuǎn)化)/mol 0.40 0.40 0.40 0.40
n(t1)/mol 0.80 0.20 0.40 0.40
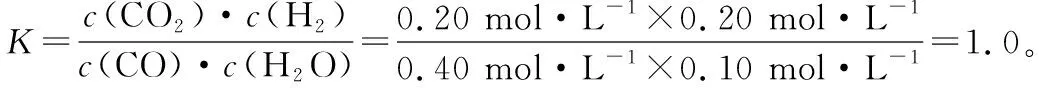
保持其他條件不變,起始時(shí)向容器中充入0.60 mol CO和1.20 mol H2O,用假設(shè)法驗(yàn)證:若達(dá)平衡時(shí),n(CO2)=0.40 mol,則CO平衡時(shí)物質(zhì)的量為0.60 mol-0.40 mol=0.20 mol,也采用三段式分析法:

n(起始)/mol 0.60 1.20 0 0
n(轉(zhuǎn)化)/mol 0.40 0.40 0.40 0.40
n(平衡)/mol 0.20 0.80 0.40 0.40
因?yàn)闇囟炔蛔儯琄為定值,通過(guò)假設(shè)法快速驗(yàn)證該說(shuō)法正確。
由此可見(jiàn),其他條件不變時(shí),將CO、H2O的起始物質(zhì)的量調(diào)換,分別達(dá)平衡時(shí)產(chǎn)物的物質(zhì)的量相等。仔細(xì)分析K的表達(dá)式,不難發(fā)現(xiàn),原因在于化學(xué)平衡常數(shù)只與溫度有關(guān)。
二、2011年江蘇高考改編題及分析
(2011年江蘇高考化學(xué)卷第15題改編題)在一定溫度下,在相同密閉容器中,分別充入氫氣、碘蒸氣2 mol、1 mol和1 mol、2 mol,達(dá)到平衡時(shí),兩密閉容器中碘化氫的物質(zhì)的量是否相同?為什么?
分析方法一:該題與2011年江蘇高考化學(xué)卷第15題 B選項(xiàng)非常相似,都是一個(gè)反應(yīng)前后氣體物質(zhì)的量不變且兩種反應(yīng)物的化學(xué)計(jì)量數(shù)相等的反應(yīng)。基礎(chǔ)比較好的同學(xué)完全可以類比遷移2011年江蘇高考化學(xué)卷第15題的結(jié)論直接判斷出兩種情況下碘化氫的物質(zhì)的量相等。但該題的亮點(diǎn)在于要寫出證明過(guò)程,增加了思維深度,而且要將抽象思維外顯,增大了試題的區(qū)分度。在教學(xué)中,許多學(xué)生覺(jué)得證明過(guò)程有難度,似乎只可意會(huì)不可言傳。本文巧妙借助平衡常數(shù)相等,深入運(yùn)用數(shù)學(xué)思維模型,詳細(xì)展示證明過(guò)程,以提升學(xué)生的證據(jù)推理和模型認(rèn)知核心素養(yǎng)。
為了證明題中的數(shù)據(jù)2 mol、1 mol和1 mol、2 mol并非是固定不變的一組特殊數(shù)據(jù),假設(shè)兩組數(shù)據(jù)分別為任意比值,I2、H2的物質(zhì)的量分別設(shè)為1 mol、nmol和nmol、1 mol(設(shè)n大于1),容器體積為VL,用三段式分析法:

n(起始)/mol 1n0
n(轉(zhuǎn)化)/molaa2a
n(平衡)/mol 1-an-a2a

n(起始)/(mol)n1 0
n(轉(zhuǎn)化)/(mol)bb2b
n(平衡)/(mol)n-b1-b2b
因?yàn)闇囟认嗤瘜W(xué)平衡常數(shù)相等,K1=K2,所以有
4a2[n-(n+1)b+b2]=4b2[n-(n+1)a+a2]
a2[n-(n+1)b+b2] =b2[n-(n+1)a+a2]
na2-(n+1)a2b+a2b2=nb2-(n+1)ab2+a2b2
na2-(n+1)a2b=nb2-(n+1)ab2
na2-nb2-(n+1)ab(a-b)=0
n(a+b)(a-b)-(n+1)ab(a-b)=0
(a-b)[n(a+b)-(n+1)ab]=0
①
因?yàn)榭赡娣磻?yīng)中反應(yīng)物的轉(zhuǎn)化率小于100%,故有0
②
根據(jù)②式,將①中因式[n(a+b)-(n+1)ab]中較大值(a+b)用較小值ab代換,得到:
2nab-(n+1)ab=ab(2n-n-1) =ab(n-1)
③
因?yàn)閚>1,0
④
根據(jù)①式和④式,可知必有a-b=0,可得:a=b,2a=2b。
即假設(shè)n>1時(shí),兩種情況下碘化氫的物質(zhì)的量相等。
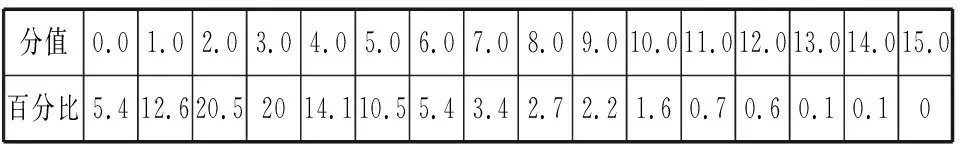
同理可證明0 若n=1,兩種情況下每種反應(yīng)物的物質(zhì)的量對(duì)應(yīng)相等,達(dá)到的自然是完全相同的平衡狀態(tài),不需要證明。 這種分析方法周密嚴(yán)謹(jǐn),大多數(shù)學(xué)生比較容易接受。 2018年3月19日,教育部基礎(chǔ)教育司專家到我校調(diào)研時(shí)強(qiáng)調(diào),教育不是追求每個(gè)學(xué)生的整齊劃一,而是盡量讓不同天賦、不同程度的學(xué)生得到最大限度的個(gè)性發(fā)展。為此,若是基礎(chǔ)比較好的學(xué)生,還可以進(jìn)一步深度運(yùn)用數(shù)學(xué)思維模型,通過(guò)證明函數(shù)在給定區(qū)間內(nèi)的單調(diào)性,來(lái)證明本題的結(jié)論。 ① ② ③ ④ 只要證明在定義域x∈(0,1)內(nèi)f(x)為單調(diào)函數(shù),即每改變一個(gè)n的值,x為唯一確定的值,結(jié)果即得證;而要證明x∈(0,1)內(nèi)f(x)為單調(diào)函數(shù),需要證明x在(0,1)內(nèi)的導(dǎo)函數(shù)恒為正數(shù)或恒為負(fù)數(shù),因此需要求f(x)的導(dǎo)函數(shù)。 根據(jù)求導(dǎo)公式:(Kx2)′=K·2x、(xn)′=nxn-1和③式 因?yàn)槠胶獬?shù)K為正值,分母K(1-x)2恒為正值,由于x∈(0,1),所以4x(2-x)>0,即f′(x)>0恒成立。 可見(jiàn)f(x)>0,f′(x)>0,故f(x)在(0,1)區(qū)間內(nèi)單調(diào)遞增,即碘單質(zhì)與氫氣在題給條件下調(diào)換起始物質(zhì)的量,產(chǎn)物碘化氫的物質(zhì)的量一定相同。 同理可證明當(dāng)0 當(dāng)然,第二種方法雖比第一種方法復(fù)雜,但對(duì)學(xué)生綜合性思維的培養(yǎng)、引導(dǎo)他們自覺(jué)將不同學(xué)科知識(shí)融合,不孤立用單一學(xué)科思維方式思考問(wèn)題。比如,用數(shù)學(xué)的眼光看世界,看到的是舍棄了內(nèi)容的數(shù)和形,用化學(xué)的眼光看世界,看到的是物質(zhì)之間的聯(lián)系和變化。將各種眼光結(jié)合起來(lái),才有可能看到一個(gè)完整的“圖象”。這是全面、深入認(rèn)識(shí)世界所必須秉持的態(tài)度和方法。注重知識(shí)的橫向聯(lián)系,打破學(xué)科之間的壁壘,對(duì)于培養(yǎng)學(xué)生的核心素養(yǎng)具有重要意義。 以上試題著重考查對(duì)于一個(gè)具體的可逆反應(yīng),其濃度平衡常數(shù)只與溫度有關(guān)的特征;近年高考題,也非常重視分壓平衡常數(shù)的考查,下面以2018年高考新課標(biāo)理綜Ⅰ卷第28題為例進(jìn)行分析。 (2018年新課標(biāo)理綜Ⅰ卷第28題節(jié)選)采用N2O5為硝化劑是一種新型的綠色硝化技術(shù),在含能材料、醫(yī)藥等工業(yè)中得到廣泛應(yīng)用。回答下列問(wèn)題: (2)F.Daniels等曾利用測(cè)壓法在剛性反應(yīng)器中研究了25℃時(shí)N2O5(g)分解反應(yīng): 2N2O4(g) 其中NO2二聚為N2O4的反應(yīng)可以迅速達(dá)到平衡,體系的總壓強(qiáng)p隨時(shí)間t的變化如下表所示[t=∞時(shí),N2O5(g)完全分解]: t/min040801602601 3001 700∞p/kPa35.840.342.545.949.261.262.363.1 分析:該小問(wèn)考查分壓平衡常數(shù)的計(jì)算,對(duì)完整理解化學(xué)平衡理論有重要意義。因?yàn)榍皫啄晷抡n標(biāo)卷如2014年新課標(biāo)理綜Ⅰ卷第28題曾以信息形式提到:用平衡分壓代替平衡濃度計(jì)算,分壓=總壓×物質(zhì)的量分?jǐn)?shù)。根據(jù)理想氣體狀態(tài)方程pV=nRT,可知等溫等容下,氣體的分壓之比等于氣體的物質(zhì)的量之比,故此題中不再呈現(xiàn)該完整信息。因?yàn)槠胶鉅顟B(tài)的建立與反應(yīng)途徑無(wú)關(guān),在計(jì)算過(guò)程中可以采用多種不同的思維模型計(jì)算出p(NO2)、p(N2O4),進(jìn)而求出Kp,體現(xiàn)了對(duì)證據(jù)推理與模型認(rèn)知核心素養(yǎng)的考查,也間接考查了對(duì)化學(xué)平衡狀態(tài)的建立、化學(xué)平衡狀態(tài)的理解和應(yīng)用。另外,該題信息t=∞時(shí),N2O5(g)完全分解,意在暗示N2O5的分解達(dá)到化學(xué)平衡需要足夠長(zhǎng)的時(shí)間,隱含了溫度一定時(shí),隨著反應(yīng)的不斷進(jìn)行,濃度減小,反應(yīng)速率遞減的規(guī)律;啟示學(xué)生理解工業(yè)上的許多可逆反應(yīng)不一定追求化學(xué)平衡狀態(tài),同時(shí)深刻領(lǐng)會(huì)學(xué)習(xí)外界條件對(duì)化學(xué)平衡的影響,主要是創(chuàng)設(shè)條件,促使平衡(化學(xué)平衡、電離平衡、水解平衡、沉淀溶解平衡等)向人們期待的方向移動(dòng),也體現(xiàn)了對(duì)變化觀念與平衡思想核心素養(yǎng)的考查。 p(起始)/kPa 35.8 0 0 p(∞)/kPa 0 35.8×2 35.8÷2 p(起始)/kPa 71.6 0 p(轉(zhuǎn)化)/kPa 2xx p(平衡)/kPa 71.6-2xx 因?yàn)閠=∞時(shí),p(總)=63.1 kPa,即p(O2)+p(NO2)+p(N2O4)=63.1 kPa (17.9+71.6-2x+x)kPa=63.1 kPa 解得:x=26.4 kPa 71.6-2x=71.6-2×26.4=18.8 kPa 分析方法二:從原子守恒角度出發(fā),題中反應(yīng)可拆分為下列兩個(gè)反應(yīng),用守恒法分析: 根據(jù)前述分析可知:p(NO2)+p(N2O4)=p(總)-p(O2)=63.1 kPa-17.9 kPa=45.2 kPa 根據(jù)反應(yīng)前后氮原子守恒可知:p(NO2)+2p(N2O4)=2×35.8 kPa=71.6 kPa 解得:p(NO2)=18.8 kPap(N2O4)=26.4 kPa 2 kPa (4-2x) kPaxkPa 1 kPa 35.8 kPa 35.8(2-x) kPa 17.9xkPa 17.9 kPa 因?yàn)閠=∞時(shí),p(總)=63.1 kPa,即17.9+35.8(2-x)+17.9x=63.1 kPa 解得:17.9x=26.4 即35.8(2-x)=71.6-35.8x=71.6-52.8=18.8 即:p(NO2)=18.8 kPap(N2O4)=26.4 kPa 分析方法四:從原子守恒角度出發(fā),題中反應(yīng)可拆分為下列兩個(gè)反應(yīng),用極端假設(shè)法分析。 ① ② 但實(shí)際發(fā)生反應(yīng)①②,設(shè)發(fā)生反應(yīng)①②的N2O5(g)的物質(zhì)的量分?jǐn)?shù)分別為x、1-x,則根據(jù)t=∞ 時(shí),p(總)=63.1 kPa,可列式:89.5x+53.7(1-x)=63.1 通過(guò)以上不同角度分析方法,可幫助學(xué)生從多種角度認(rèn)識(shí)N2O5分解的實(shí)質(zhì),建立靈活多變的化學(xué)平衡思維模型,其實(shí)質(zhì)都是反應(yīng)前后質(zhì)量守恒,平衡常數(shù)只與溫度有關(guān)。該大題對(duì)化學(xué)平衡的原理應(yīng)用進(jìn)行了全方位、多角度的綜合考查,涉及了信息的接受、吸收和整合(表格數(shù)據(jù)理解分析、方程式選用等),文字表達(dá),計(jì)算等,設(shè)問(wèn)層層遞進(jìn),能力層層篩選,是全卷非常靚麗的一道風(fēng)景線。尤其是該小問(wèn)和最后一問(wèn),能很好區(qū)分學(xué)生核心素養(yǎng)上的差異。湖南省答卷該題抽樣情況如下表1。 2018年高考新課標(biāo)理綜Ⅰ卷第28題湖南省答卷抽樣統(tǒng)計(jì)表1 抽樣數(shù):205315 樣品總數(shù):205316 平均分(含零/不含零):3.54/3.74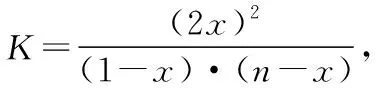
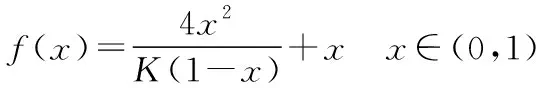
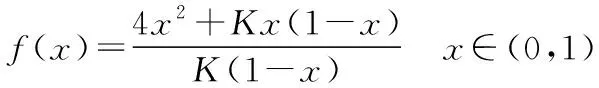
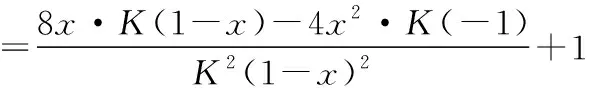

三、2018年高考新課標(biāo)理綜Ⅰ卷真題節(jié)選及分析


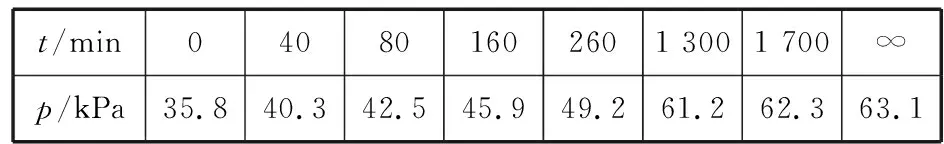











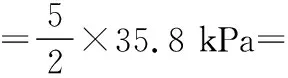

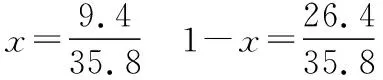
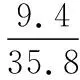
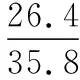

四、教學(xué)啟示


