從高考試題中探究“原子結構”考查熱點
湯 偉
安徽
近年來,高考在考查知識與能力的同時,也特別關注化學學科素養的考查,其中“宏觀辨識與微觀探析”是化學學科素養的主要內容之一。我們研究發現,“原子結構”的知識要點在高考中可以較好的滲透該學科素養中的相關內容,下面通過具體實例,針對該考點做一探究。
一、原子結構中的幾種微粒關系
微觀世界里,人們看不見摸不著,科學家是如何引導我們認識微觀世界里的境界呢?學科素養中“證據推理與模型認知”較好的詮釋了科學研究的過程,最早科學家道爾頓提出了原子的基本結構模型,后來經過眾多科學家的大量實驗推理,不斷完善,得出了我們現在的“原子結構”中的一些經典觀點。目前,在高考中成為熱點之一的就是原子結構中常見的一些微粒的基本關系,具體考查要點有:
1.電性關系
中性原子:核電荷數=核內質子數=核外電子數=原子序數
陰離子:核外電子數=質子數+所帶的電荷數
陽離子:核外電子數=質子數-所帶的電荷數
2.質量關系
質量數=質子數+中子數
3.表示原子結構的“三種方式”
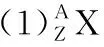
例:
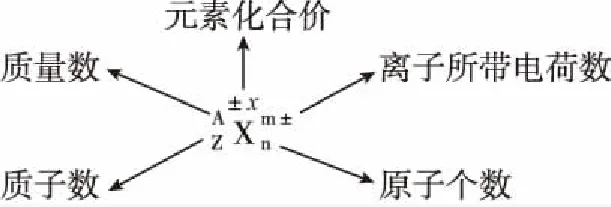
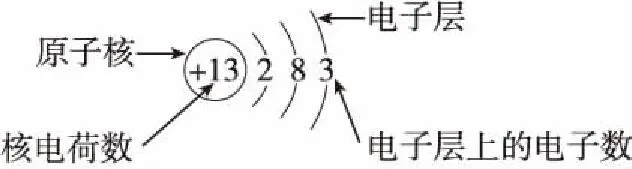
(2)原子結構示意圖著重描述核外電子排布情況
例:
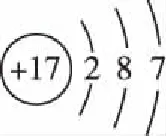
(3)電子式著重描述原子最外層電子或原子構成的物質中最外層電子的成鍵情況
4.易錯點提示
①任何粒子中,質量數=質子數+中子數,但質子數與電子數不一定相等,如陰、陽離子。
②質量數大約等于該原子的相對原子質量。不能夠理解為等于該元素的相對原子質量,有時候二者相差較大。

④質子數相同的粒子不一定屬于同種元素,如NO與CO。
⑤核外電子數相同的粒子,其質子數不一定相同,如Na+、F-等。
例題1(2018年高考題重組)下列相關說法正確的是
( )
A.[2018·全國卷ⅢT8A]24 g 鎂與27 g鋁中,含有相同的質子數
B.[2018·全國卷ⅢT8B]同等質量的氧氣和臭氧中,電子數相同
C.[2018·全國卷ⅢT8C]1 mol重水與1 mol水中,中子數比為2∶1
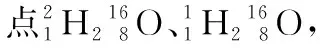
【答案】B
二、幾組易混淆的概念
涉及原子結構的知識點中,常常會出現一些類似“核素、元素、同位素”以及“原子的相對原子質量、元素的相對原子質量”等容易混淆的概念,這些知識盡管近年來已經不是高考的熱點,但是我們學習原子結構的相關知識時,還是要厘清這些不同概念的內涵與外延,這也是學科素養的基本要求。
1.厘清“元素、核素、同位素”概念間的不同及相互關系

2.理解同位素的“六同三不同”
3.熟知幾種重要的核素及其應用
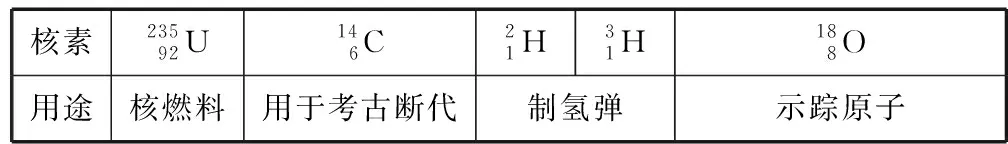
核素23592U146C21H31H188O用途核燃料用于考古斷代制氫彈示蹤原子
4.了解四個“量”的區別

類別定義實例原子質量某元素某種核素的一個原子的真實質量一個168O原子的質量是2.657×10-26 kg原子的相對原子質量原子的質量與一個126C原子質量的112的比值168O的相對原子質量約為16元素的相對原子質量元素的各種天然同位素的相對原子質量與其在自然界中所占的物質的量分數計算出的平均值Ar=Ar(A)·a%+Ar(B)·b%+…(其中a%+b%+…=1)質量數某原子核內質子數與中子數之和188O的質量數為18

( )
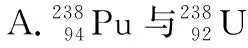
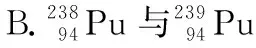
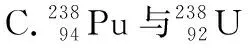
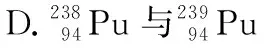
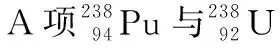
【答案】D
三、從原子結構知識延伸考查電子式與化學鍵
宏觀上所見到的各種物質均是由原子按照一定方式結合在一起的,這也就是學科素養中提到的“宏觀辨識與微觀探析”的要點之一,近年來我們通過研究高考試題,可以發現通過考查電子式或化學鍵能夠較好地考查考生是否真正理解該知識要點,這也是近年來高考一直重點考查的熱點之一。我們學習該知識要點,需要重點把握如下幾個關鍵點:
1.電子式的書寫
(1)書寫電子式需注意的4個問題
①陰離子和復雜陽離子要加括號,并注明所帶電荷數
②要注意化學鍵中原子直接相鄰的事實
③不能漏寫未參與成鍵的電子對
④無論何種粒子,其電子式都是以原子為基本單位組成的,不能出現角碼
(2)書寫電子式常見的幾個誤區
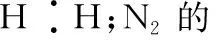
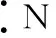
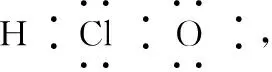
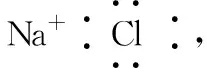
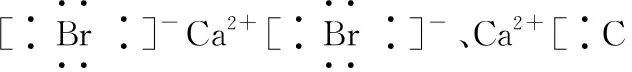
2.化學鍵及其類型的判斷
(1)化學鍵與物質間的關系

注意以下幾個重要的結論:
①存在離子鍵的化合物一定是離子化合物
②離子化合物中一定存在離子鍵,可能存在共價鍵
③共價化合物中只含共價鍵,一定不含離子鍵
④由金屬元素和非金屬元素形成的化合物也可能是共價化合物,如AlCl3
(2)辨清化學鍵與物質類型的關系
除稀有氣體內部無化學鍵外,其他物質內部都存在化學鍵。化學鍵與物質類型之間的關系可概括如下:
①只含有極性共價鍵的物質一般是不同種非金屬元素形成的共價化合物,如SiO2、HCl、CH4等。
②只含有非極性共價鍵的物質是同種非金屬元素形成的單質,如Cl2、P4、金剛石等。
③既有極性鍵又有非極性鍵的共價化合物一般由多個原子組成,如H2O2、C2H4等。
④只含離子鍵的物質主要是由活潑非金屬元素與活潑金屬元素形成的化合物,如Na2S、CaCl2、NaCl等。
⑤既有離子鍵又有極性共價鍵的物質,如NaOH、K2SO4等;既有離子鍵又有非極性共價鍵的物質,如Na2O2等。
⑥僅由非金屬元素形成的離子化合物,如NH4Cl、NH4NO3等。
例題3(2018年高考題重組)下列相關說法正確的是
( )
①[2018·全國卷Ⅰ12TB]鈣的氫化物為離子化合物
②[2018·全國卷Ⅱ10TB]氧元素與N、Na、Cl三種元素分別形成的化合物中只含有離子鍵
④[2018·全國卷ⅢT8D]1 mol乙烷和1 mol乙烯中,化學鍵數相同
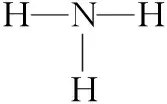
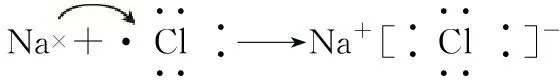
⑦[2018·天津T7]Mg(OH)2的電子式:
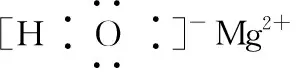
A.①②③⑤⑦ B.①⑤⑥⑦⑧
C.②③⑥⑦⑧ D.②④⑤⑥⑧

【答案】B
四、原子結構與周期表、周期律相結合
高考化學中“位—構—性”一直是高考的熱點和重點,其中“構”指的就是借助原子結構知識,可以推斷原子在周期表中的位置、借助原子結構知識可以推斷出元素相關性質,該知識點能夠較好的體現出化學學科素養的內涵,它們之間的關系可以通過如下方式體現:
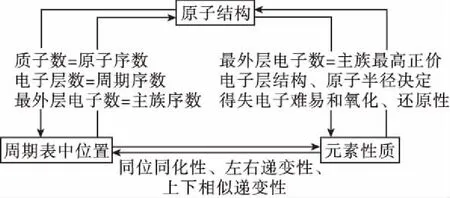
例題4(2018·全國卷Ⅰ·12)主族元素W、X、Y、Z的原子序數依次增加,且均不大于20。W、X、Z最外層電子數之和為10;W與Y同族;W與Z形成的化合物可與濃硫酸反應,其生成物可腐蝕玻璃。下列說法正確的是
( )
A.常溫常壓下X的單質為氣態
B.Z的氫化物為離子化合物
C.Y和Z形成的化合物的水溶液呈堿性
D.W與Y具有相同的最高化合價
【解析】該試題首先簡介了四種不同原子結構的相關知識,“主族元素W、X、Y、Z的原子序數依次增加,且均不大于20。W、X、Z最外層電子數之和為10”,但解題的突破口是物質的性質,借助“W與Z形成的化合物可與濃硫酸反應,其生成物可腐蝕玻璃”可以推斷出HF腐蝕玻璃,所以W為F元素,Z為Ca或K元素,因為“W與Y同族”,所以Y為Cl元素,借助原子結構知識“W、X、Z最外層電子數之和為10”,可以推斷出W為Ca時,X為Na,W為K時,X為Mg,由此可以得出,X為鈉或鎂單質在常溫下不可能為氣態,選項A錯誤;氫化鈣或氫化鉀均為離子化合物,選項B正確;Y和Z形成的化合物為氯化鈣或氯化鉀,其水溶液均顯中性,不可能呈堿性,選項C錯誤;W最高價為+1 或+2,而Y最高價為+7價,二者不可能具有相同的最高化合價,選項D錯誤。


