含有金銀花的3種中藥制劑的微生物限度與控制菌檢查法的建立及方法學驗證
杜春華,張曉南,游燕*,李東嫻,王鵬,曹紅云
藥品微生物限度是藥品安全性的重要指標之一。在中藥制劑處方中,有些藥材自身對微生物細胞有一定抑制作用。不同中藥制劑的抑菌成分與作用強弱不同,供試品中的微生物在抑菌成分存在下可能檢不出,為了消除其對微生物的影響,需對每種樣品建立適宜的微生物限度檢查法[1]。金銀花具有清熱解毒,疏散風熱的功效。用于癰腫疔瘡,喉痹,丹毒,熱毒血痢,風熱感冒,溫病發熱[2]。市面上銷售的很多中成藥都含有金銀花成分[3~4],本研究選取3種含金銀花的中成藥雙黃連口服液、金銀花復方顆粒、金銀花露,依據2015年版《中國藥典》四部中通則1105、1106對3種制劑的微生物限度與控制菌的檢查方法進行方法學驗證,為含該類中藥材的藥品制定微生物檢查提供理論依據。
1 儀器與材料
1.1 儀器
隔水式電熱恒溫培養箱(型號:G S P-9160MBE,上海博迅實業有限公司),生化培養箱(型號:LRH-150,上海一恒科學儀器有限公司),二級生物安全柜(型號:BSC-1100ⅡB2-X,濟南鑫貝西)
1.2 試藥
1.2.1 供試品 雙黃連口服液:(批號:170213012、170104032、170105032),金銀花復方顆粒:(批號:7274507、7274404、7274502),金銀花露:(批號:170404、170405、170406)
1.2.2 培養基 胰酪大豆胨液體培養基,批號170310;胰酪大豆胨瓊脂培養基,批號1706282;沙氏葡萄糖瓊脂培養基,批號170608;沙氏葡萄糖液體培養基,批號3106032;麥康凱瓊脂培養基,批號160303;麥康凱瓊液體培養基,批號161228;pH 7.0無菌氯化鈉 -蛋白胨緩沖液,批號1705184。(以上培養基除沙氏葡萄糖液體培養基來源于廣東環凱微生物科技有限公司其余培養基均來源于北京三藥科技開發公司。)
1.3 試驗菌株
金黃色葡萄球菌[CMCC(B)26003]銅綠假單胞[CMCC(B)10104]、枯草芽孢桿菌[CMCC(B)63501]、白色念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003],均來源于中國食品藥品檢定研究院。
2 方法與結果
按《中國藥典》2015版四部通則1105、1106、1107要求,確定口服給藥項下的固體制劑和液體制劑(不含藥材原粉的中藥制劑)需檢查需氧菌總數,霉菌和酵母菌總數,控制菌檢查大腸埃希菌。
2.1 菌液制備
2.1.1 金黃色葡萄球菌、銅綠假單胞、枯草芽孢桿菌的制備 接種金黃色葡萄球菌、銅綠假單胞、枯草芽孢桿菌的新鮮培養物至胰酪大豆胨液體培養基中,置30~35 ℃培養18~24 h,然后將各菌種分別用0.9%無菌氯化鈉溶液制成每1 ml含菌數不大于100cfu的菌懸液。
2.1.2 白色念珠菌、黑曲霉的制備 接種白色念珠菌、黑曲霉的新鮮培養物至沙氏葡萄糖液體培養基中,置20~25 ℃分別培養2~3天和5~7天,然后將各菌種分別用0.9%無菌氯化鈉溶液制成每1 ml含菌數不大于100 cfu的菌懸液。
2.2 供試液制備
固體制劑取供試品10 g,加pH7.0無菌氯化鈉-蛋白胨緩沖液100 ml中溶解,混勻,作為1:10的供試液。液體制劑取供試品10 ml,加pH7.0無菌氯化鈉-蛋白胨緩沖液90 ml中溶解,混勻,作為1:10的供試液。
3 微生物限度方法驗證
3.1 需氧菌總數計數方法適用性試驗
試驗組:取1:10供試液9.9 ml于滅菌試管中,加入制備好的金黃色葡萄球菌、枯草芽孢桿菌、銅綠假單胞菌、白色念珠菌、黑曲霉菌液0.1 ml,使其終濃度為每1 ml含菌落數不大于100 cfu的菌液,從試管中吸取1 ml注入滅菌平皿中,立刻傾注胰酪大豆胨瓊脂培養基,待其凝固后,倒置于恒溫培養箱中30~35℃培養48 h。每個菌種平行制備2個平皿,測定試驗組的菌落數。
供試品對照組:取1:10供試液9.9 ml于滅菌試管中,加pH7.0氯化鈉-蛋白胨緩沖液0.1 ml,其余按試驗組操作,測定供試品對照組的菌落數。
菌液對照組:取pH7.0氯化鈉-蛋白胨緩沖液9.9 ml于滅菌試管中,加入制備好的金黃色葡萄球菌、枯草芽孢桿菌、銅綠假單胞菌、白色念珠菌、黑曲霉菌液0.1 ml,使其終濃度為每1 ml不大于100 cfu的菌液,其余按試驗組操作,測定菌液對照組的菌落數。
陰性對照組:取pH7.0氯化鈉-蛋白胨緩沖液1ml,加入霉菌平皿中,其余按試驗組操作,平行做兩個皿。
按[回收率=(試驗組平均菌落數-供試品對照組平均菌落數)/菌液對照組平均菌落數]計算回收率,結果見表1、表2、表3。

表1 雙黃連口服液需氧菌總數試驗驗證結果
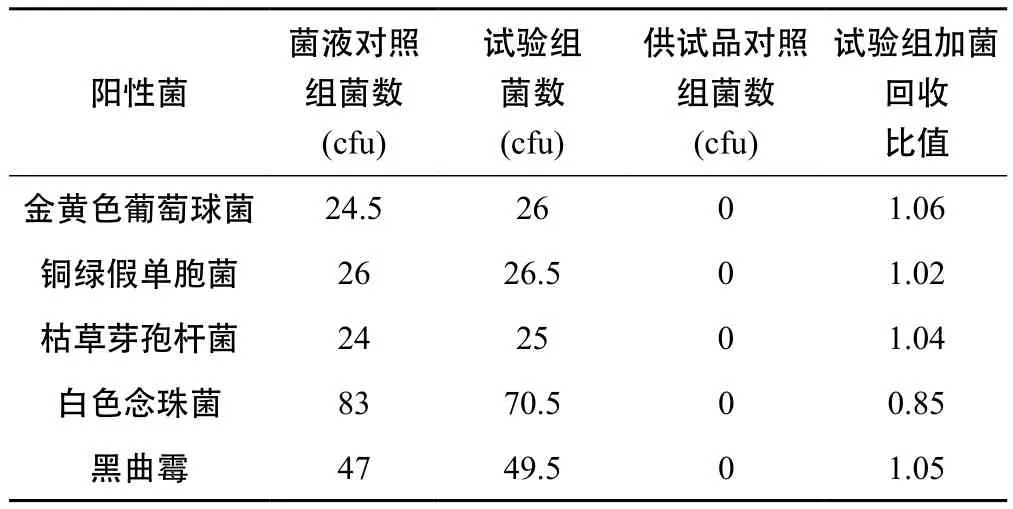
表2 金銀花復方顆粒需氧菌總數試驗驗證結果

表3 金銀花露需氧菌總數試驗驗證結果
由表1、表2、表3得出,5株需氧菌的回收比值均在0.5 ~ 2 之間,符合藥典規定,因此可照此常規法進行雙黃連口服液、金銀花復方顆粒、金銀花露的需氧菌總數計數。
3.2 霉菌和酵母菌總數計數方法適用性試驗
取1:10供試液9.9 ml于滅菌試管中,加入制備好的白色念珠菌、黑曲霉菌液0.1 ml,使其終濃度為每1 ml含菌落數不大于100 cfu的菌液,從試管中吸取1 ml注入滅菌平皿中,立刻傾注沙氏葡萄糖瓊脂培養基,待其凝固后,倒置于恒溫培養箱中20~25 ℃培養72 h。每個菌種平行制備2個平皿,測定試驗組的菌落數。同法測定供試品對照組、菌液對照組和陰性對照組的菌落數。按[回收率=(試驗組平均菌落數-供試品對照組平均菌落數)/菌液對照組平均菌落數]計算回收率,結果見表4、表5、表6。
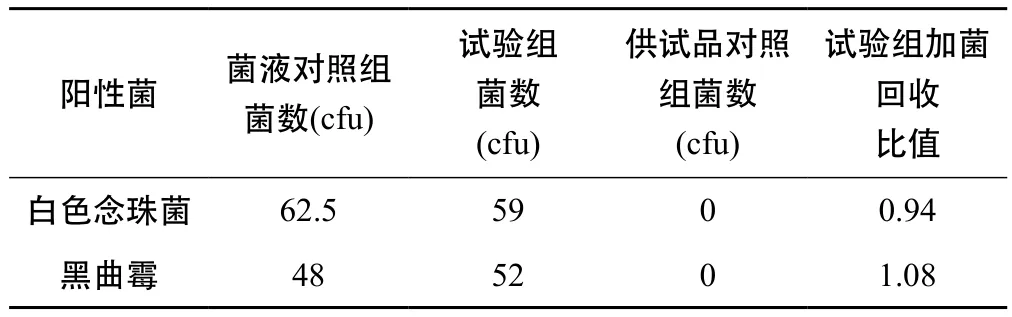
表4 雙黃連口服液霉菌和酵母菌總數試驗驗證結果
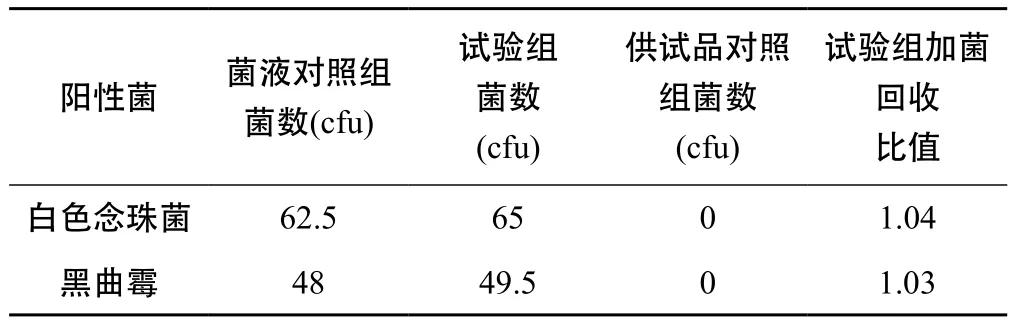
表5 金銀花復方顆粒霉菌和酵母菌總數試驗驗證結果
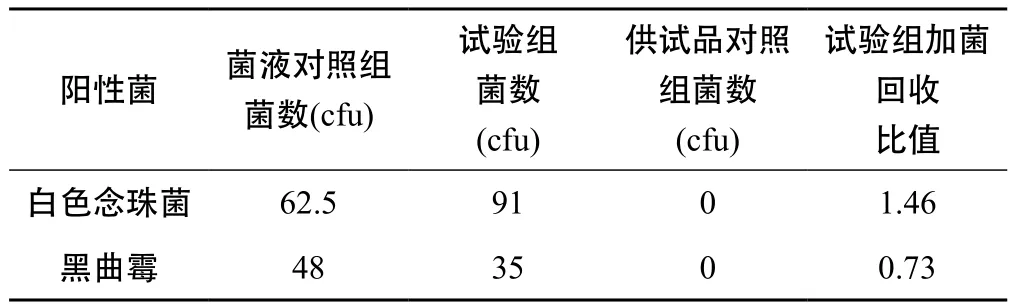
表6 金銀花露霉菌和酵母菌總數試驗驗證結果
由表4、表5、表6得出,2株真菌的回收比值均在0.5 ~ 2 之間,符合藥典規定,因此可照常規法進行雙黃連口服液、金銀花復方顆粒、金銀花露的霉菌和酵母菌總數計數。
3.3 控制菌檢查方法適用性驗證
3.3.1 常規法檢查大腸埃希菌
試驗組
取1:10供試液10 ml及制備好的大腸埃希菌菌懸液1 ml加入到100 ml的胰酪大豆胨液體培養基中,35℃培養24小時后吸取1 ml培養物接種至100 ml麥康凱液體培養基中,42 ℃培養24小時。取麥康凱液體培養物劃線接種于麥康凱瓊脂培養基平板上,35 ℃培養24小時,觀察是否有菌落生長。
陽性對照組
取制備好的大腸埃希菌菌懸液1 ml加入到100 ml的胰酪大豆胨液體培養基中,35 ℃培養24小時。其他操作同試驗組。
陰性對照組
取10 mlpH7.0氯化鈉-蛋白胨緩沖液加入到100 ml的胰酪大豆胨液體培養基中,35 ℃培養24小時。其他操作同試驗組。
供試品對照組
取1:10供試液10 ml加入到100 ml的胰酪大豆胨液體培養基中,35 ℃培養24小時。其他操作同試驗組。

表7 大腸埃希菌檢查方法(胰酪大豆胨液體培養基:100ml)驗證結果
由表7得出,3個制劑的試驗組和陽性對照組檢出大腸埃希菌,陰性對照試驗組無菌生長,3個制劑的大腸埃希菌可用常規法進行檢查。
4 討論
中藥制劑含有多種成分的復合制劑,其中任何成分具有均可影響微生物限度檢查的準確性,因此同其他分析方法一樣,藥品微生物限度檢查也應證明所采用的方法是適宜的,才能保證檢查方法的完整性和準確性[5]。依據2015年版《中國藥典》的規定,為了確認所采用的方法適合用于某制劑的微生物限度檢查,必須對相應檢驗方法進行方法學驗證。本次實驗中所選用的雙黃連口服液、金銀花復方顆粒、金銀花露制劑都進行了微生物限度方法的建立并進行了驗證,確立了檢查方法有效。雖然文獻上[6~8]有記載金銀花內的綠原酸成分,具有極強的抗菌、抗病毒功能,但是實驗結果顯示,3個含有金銀花的制劑對藥典規定驗證用5種試驗菌株(金黃色葡萄球菌、枯草芽孢桿菌、銅綠假單胞菌、白色念珠菌、黑曲霉)的抑菌活性較小,均可采用常規法。對3個含有金銀花的中藥制劑控制菌檢查方法有效性驗證結果表明,3個制劑的控制菌均可使用常規法進行檢查。

