市售鹽酸二甲雙胍片仿制制劑溶出曲線與溶出度研究*
徐 可 ,姜建國 ,朱 娜 ,郝 偉 ,靳茂禮 ,曹鳳習
(1.河北省石家莊市食品藥品檢驗中心,河北 石家莊 050031; 2.河北省藥品檢驗研究院,河北 石家莊 050011)
鹽酸二甲雙胍片屬生物藥劑學分類系統(BCS)Ⅲ類藥物,具有高溶解性和低滲透性。臨床反饋,不同廠家產品臨床療效差異較大[1]。2015 年版《中國藥典(二部)》[2]收載的該藥現行質量標準難以反映企業間工藝控制上的差異。本研究中選擇市售不同廠家生產的鹽酸二甲雙胍片仿制制劑與參比制劑,并對其在多種pH溶出介質中溶出曲線的相似性進行了評價[3-9],為其仿制制劑的生產工藝和內在質量提升提供參考[10],并對溶出度檢查方法及限度的修訂提出了建議。現報道如下。
1 儀器、材料與試藥
儀器:EDT-14Lx型智能溶出試驗儀(上海儀真分析儀器有限公司);LC-20AD型高效液相色譜儀,包括二極管陣列檢測器、Labsolution工作站(日本島津公司);XS105型十萬分之一電子天平(瑞士梅特勒-托利多公司);ZKT-18F型真空脫氣機(天津天大天發科技有限公司)。
試藥:鹽酸二甲雙胍對照品(中國食品藥品檢定研究院,批號為100664-201604,純度為100%,105℃干燥2 h);鹽酸二甲雙胍片均為國內市售仿制制劑(規格均為每片0.25 g,生產企業及批號見表1);甲醇、乙腈(色譜純,美國 Merck公司);氯化鈉、乙酸鈉、磷酸二氫鉀、無水磷酸氫二鈉(分析純,北京化工廠);冰醋酸、鹽酸(分析純,天津市科密歐化學試劑有限公司);試驗用水為去離子純凈水。依據國家食品藥品監督管理總局發布的《仿制藥參比制劑目錄(第五批)》(2017年第89號),采用鹽酸二甲雙胍片原研制劑(日本新藥株式會社,規格為每片 250 mg,批號為 357401,356501,355801)為參比制劑。

表1 鹽酸二甲雙胍片仿制制劑生產企業、規格及批號
2 方法與結果
2.1 色譜條件
色譜柱:Agilent Zorbax Eclipse Plus C18柱(250 mm×4.6 mm,5 μm);流動相:磷酸鹽緩沖液(取己烷磺酸鈉1.88 g,磷酸二氫鈉 0.78 g,加水溶解并稀釋至 1 000 mL,用磷酸調節 pH 至 3.5±0.05)-乙腈(90∶10,V/V);檢測波長:233 nm;柱溫:30 ℃;流速:1.0 mL /min;進樣量:20 μL。
2.2 溶液制備
溶出介質:參照第 17版《日本藥局方》[11],4種溶出介質的配制方法及37℃時鹽酸二甲雙胍在各溶出介質中的溶解度見表2。各溶出介質用水均為真空脫氣機經42℃脫氣40 min處理后立即使用。
對照品溶液:稱取鹽酸二甲雙胍對照品適量,精密稱定。以pH=4.0醋酸鹽緩沖液、pH=6.8的磷酸鹽緩沖液和水為溶出介質溶解并稀釋,制成每1 mL中約含鹽酸二甲雙胍56 μg的溶液;以pH=1.2的鹽溶液為溶出介質時,由于溶劑效應,檢測器響應信號相對較低,稀釋成每1 mL中約含鹽酸二甲雙胍278 μg的溶液,作為對照品溶液。
供試品溶液:取樣品適量,按2015年版《中國藥典(四部)》通則 0931 第二法(槳法),轉速 50 r/min,溶出介質溫度為(37.0 ±0.5)℃ ,分別采用 4 種溶出介質900 mL,依法操作,經30 min取溶液適量,濾過,取續濾液,作為供試品溶液。
空白輔料溶液:稱取生產企業處方中包含的所有輔料適量,精密稱定,按供試品溶液制備方法制成空白輔料溶液。
2.3 系統適用性試驗
精密量取2.2項下供試品溶液、對照品溶液與空白輔料溶液各20 μL(以水為溶出介質),注入液相色譜儀,記錄色譜圖。分別采用4種溶出介質制備的此3種溶液進樣,結果相應色譜圖基本一致,以水為溶出介質的色譜圖見圖1。二甲雙胍峰保留時間約為5.2 min,理論板數按二甲雙胍峰計應不小于3 000,拖尾因子不超過1.5。主成分峰與溶劑、輔料及其他雜質峰分離較好。
2.4 方法學考察
線性關系考察:以pH=4.0的醋酸鹽緩沖液、pH=6.8的磷酸鹽緩沖液和水為溶出介質時,精密稱取鹽酸二甲雙胍對照品適量,精密稱定,分別用溶出介質溶解并稀釋成每1 mL中約含鹽酸二甲雙胍10,20,30,50,70,100 μg 的溶液。各精密量取 20 μL,按 2.1 項下色譜條件進樣,記錄色譜圖,以鹽酸二甲雙胍質量濃度(X,μg/mL)為橫坐標、峰面積(Y)為縱坐標進行線性回歸,得 回歸方程 分別為 Y =79 793.1X+28 251.0,r=0.999 9(n=6),Y=79 836.7X+28 092.4,r=0.999 9(n =6)和 Y =79 881.4X+28 479.5,r=0.999 9(n =6)。結果顯示,鹽酸二甲雙胍質量濃度在10~100 μg/mL范圍內與峰面積線性關系良好。以pH=1.2的鹽溶液為溶出介質時,稱取鹽酸二甲雙胍對照品適量,精密稱定,同法稀釋成每1 mL中約含鹽酸二甲雙胍10,100,150,250,300,400 μg 的溶液,同法操作,得線性回歸方程為 Y =79 832.5X-27 922.0,r=0.999 8(n=6)。結果顯示,鹽酸二甲雙胍質量濃度在10~400 μg/mL范圍內與峰面積線性關系良好。
精密度試驗:取4種溶出介質制備的對照品溶液,分別按2.1項下色譜條件連續進樣6次,測定峰面積。結果 pH=1.2的鹽溶液、pH=4.0的醋酸鹽緩沖液、pH=6.8的磷酸鹽緩沖液和水為介質時的 RSD分別為0.30%,0.34%,0.30% ,0.23% (n =6),表明儀器精密度良好。
穩定性試驗:取供試品溶液(J廠家,批號為3316179)適量,在室溫條件下放置 0,2,4,6,8,12,16,20,24 h,按2.1項下色譜條件進樣,測定峰面積。結果以pH=1.2的鹽溶液、pH=4.0的醋酸鹽緩沖液、pH=6.8的磷酸鹽緩沖液和水為介質時的 RSD分別為0.41% ,0.34% ,0.24%,0.30% (n =9),表明供試品溶液在24 h內基本穩定。

圖1 高效液相色譜圖(溶出介質為水)
回收率試驗:按最大處方量取空白輔料,精密加入相當于樣品含量80%,100%,120%的對照品各適量,每個水平各3份,分別使用4種溶出介質,依法制備供試品溶液,再按2.1項下色譜條件進樣,測定峰面積,計算回收率。結果以pH=1.2的鹽溶液、pH=4.0的醋酸鹽緩沖液、pH=6.8的磷酸鹽緩沖液和水為介質時的平均回收率分別為 99.01%,99.12%,99.27%,99.05% (n =9)。
2.5 溶出曲線測試方法
采用日本《醫療用醫藥品品質情報集》(“橙皮書”)[12]中規定的鹽酸二甲雙胍片溶出曲線測試方法:槳法,轉速 50 r/min,溶出介質 900 mL。考察樣品在 2.2項下4種溶出介質中的溶出曲線。取樣品12片,依法操作,經 5,10,15,20,30,45 min 時,取溶液 5 mL,濾過,精密量取續濾液2 mL,置10 mL容量瓶中,用溶出介質稀釋至刻度,搖勻;以pH=1.2的鹽溶液為溶出介質時,取溶液5 mL,濾過,取續濾液作為供試品溶液。精密量取供試品溶液與對照品溶液各20 μL,分別注入液相色譜儀,按2.1項下色譜條件進樣,記錄色譜圖,按外標法以峰面積計算每片樣品在各時點的累積溶出度(%),以其平均值為縱坐標、時間(min)為橫坐標繪制溶出曲線。
2.6 溶出曲線相似性比較原則
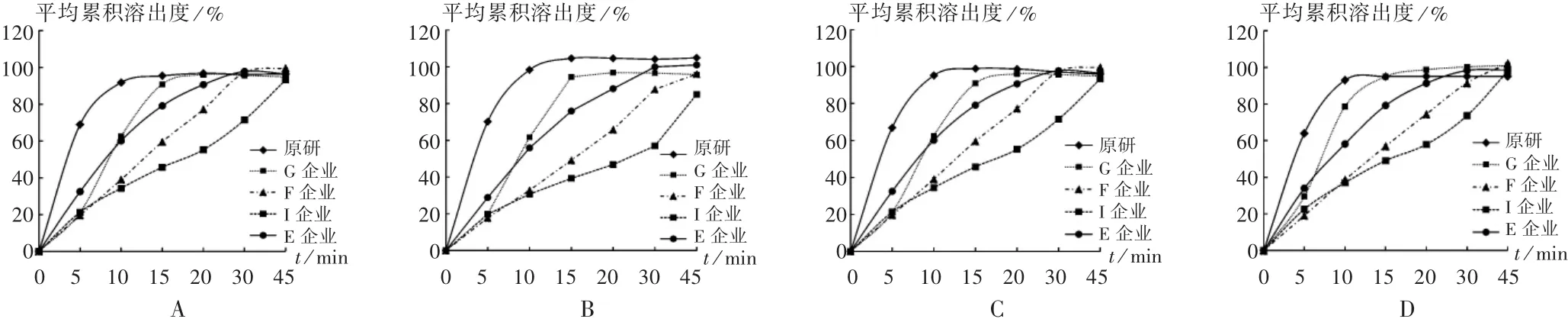
圖2 5家企業仿制藥與原研藥溶出曲線比較
依據《普通口服固體制劑溶出曲線測定與比較指導原則》,采用非模型依賴法中的相似因子(f2)法,比較仿制制劑與原研制劑溶出曲線的相似性及同一生產企業仿制制劑的批間差異。計算公式如下。其中,Rt為 t時間參比樣品平均溶出量,Tt為 t時間受試樣品平均溶出量,n為取樣時間點的個數。
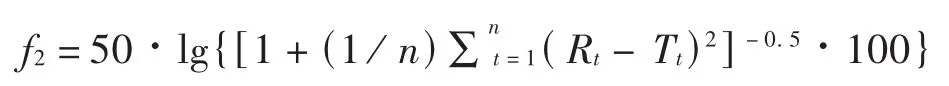
相似性判定標準:當2條溶出曲線 f2數值不小于50,或受試樣品和參比樣品在15 min的平均溶出量均不低于85%時,可認為溶出曲線相似。
f2從統計學上度量了2條溶出曲線之間的相似性,f2值越大,說明2條溶出曲線差異越小,若50≤f2≤100,可以推斷2條溶出曲線相似(完全相同的2條溶出曲線的 f2=100)。
2.7 溶出曲線測定結果與相似性比較
原研制劑溶出曲線與批間差異:在4種溶出介質中,3批次原研制劑在15 min的平均累積溶出度均高于85%,溶出曲線相似。日本“橙皮書”中收載了A、B兩種劑型的溶出曲線,試驗結果證明該原研制劑為B型,屬快速釋放型。原研制劑批間基本無差異,產品質量控制較好。
仿制制劑與原研制劑溶出曲線相似性比較:將12家生產企業的仿制制劑分別與原研制劑比較,詳見圖2至圖4。結果,僅G,J和H企業的仿制制劑在4種介質中15 min的平均累積溶出度均超過85%,與原研制劑溶出曲線相似,占受試仿制藥生產企業總數的25.0%。其余75.0%的企業產品溶出曲線與原研制劑不相似,說明其產品與原研制劑存在質量差異,有待進一步完善生產工藝,提高產品質量。另有個別企業,如B企業生產的仿制制劑與原研制劑差異較大,在pH=1.2的鹽溶液中,45 min內平均累積溶出度不足10%,在pH=4.0的醋酸鹽緩沖液中仍不足40%。溶出量較低將嚴重影響藥效的發揮。該廠家有待進一步完善處方工藝,促進藥物有效成分更好地釋放。

圖3 5家企業仿制藥與原研藥溶出曲線比較

圖4 5家企業仿制藥與原研藥溶出曲線比較
同一企業不同批次仿制制劑批間差異評價:樣中含2批次仿制制劑的生產企業有3家,分別為A,B,F企業,含3批次及以上仿制制劑的生產企業有5家,分別為 E,I,J,K,L 企業,前 3 家企業選所有批次,后 5 家企業隨機選取3批,測定樣品在4種溶出介質中的溶出曲線。以每個企業任一批次產品的溶出曲線做參比,其他受試批次與之進行比較。選擇合適的時間點,計算 f2。結果見表3。依據指導原則,J企業3批次產品在4種介質中15 min的平均累積溶出度均達到85%以上,產品溶出曲線相似,批間差異較小。且與原研制劑的溶出曲線相似,該企業產品質量優于其他生產企業。A,B,E,F,K企業的不同批次產品在各溶出介質中溶出曲線的 f2值均大于50,說明上述各企業產品批間差異都很小,不同批次產品質量基本一致。I,L企業的不同批次產品在各溶出介質中溶出曲線不相似,f2值小于50,批間差異較大。
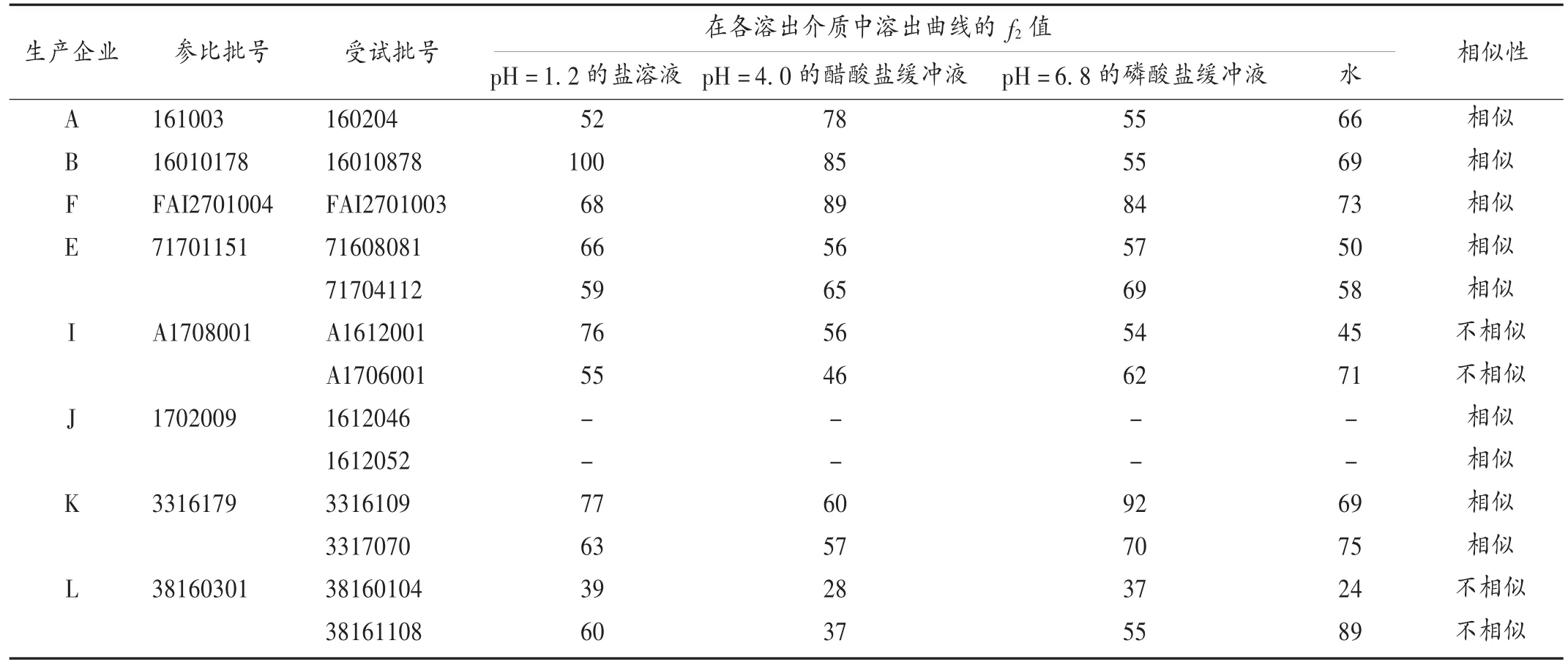
表3 在4種溶出介質中各企業不同批次產品溶出曲線相似性比較
2.8 溶出度檢查項方法與限度修訂建議
仿制制劑按照現行標準[2]檢驗表1中的41批次樣品:籃法,轉速100 r/min,以1 000 mL水為溶出介質,45 min取樣,按2.1項下方法檢測,限度為標示量的70%,合格率為100.0%,對產品質量區分度較小。
依據溶出曲線測定結果,分析鹽酸二甲雙胍片在水中的溶出曲線,結果見圖5。可見,樣品45 min的平均累積溶出度均接近100%,差異很小。3家企業樣品30 min的平均累積溶出度低于85%。

圖5 12家企業仿制制劑在水中的溶出曲線
建議將溶出度測定修訂為:槳法,轉速50 r/min,以900 mL水為溶出介質,30 min取樣,限度為標示量的85%。按擬訂標準對上述41批次樣品進行溶出度檢查,有9家的產品符合規定,占企業總數的75.00%;其中35批次產品符合規定,合格率為85.37%,擬訂標準提高了檢驗標準對不同產品質量的區分度。建議對現行標準進行修訂,并設定更高要求的限度,促進仿制制劑總體質量的提升。
3 討論
針對研究中發現的與原研制劑不相似的情況,與相關企業的生產、質量部門人員就產品的生產工藝、處方篩選、質量控制關鍵點等問題進行溝通。從企業反映的情況與相關文獻資料[12-15]了解到,影響鹽酸二甲雙胍片溶出度的因素主要有2個:一是制片工藝中原料的粒徑。劑量較小的藥物與較多量的親水性輔料共同研磨粉碎,藥物與輔料的粒子逐步變小,最終形成在藥物粒子的周圍黏附著一層親水性輔料粒子的狀態,這樣既能將藥物粉碎得更細,又可使藥物粒子表面的親水性增強,改善藥物的溶出度。二是輔料的成分與配比。潤滑劑如硬脂酸鎂等可增強片劑的疏水性,使水難以透入,致使片劑崩解遲緩。表面活性劑吐溫-80、十二烷基硫酸鈉等的加入,可降低介質的表面張力,改善片劑的潤濕性,加快片劑的崩解。崩解劑如淀粉、羧甲基淀粉鈉、低取代-羥丙纖維素、羧甲基纖維素鈣等都有較強的吸水膨脹性能,促進片劑崩解。黏合劑如淀粉漿、羥丙基甲基纖維素的加入會影響制劑的溶出度。
溶出曲線能反映仿制制劑與參比制劑的質量差異,大部分仿制制劑的內在質量有待進一步提高,個別企業的產品差距較大,有待完善處方與工藝,以促進藥物有效成分更好地釋放,有必要進一步加強對仿制制劑溶出曲線的考察,以確保藥品的質量與療效。

