脫酰胺對熱誘導小麥面筋蛋白構象及凝膠性質的影響
王淑敏 張 鴻 羅水忠 李興江 趙妍嫣 鐘昔陽 姜紹通 鄭 志
(合肥工業大學食品科學與工程學院;安徽省農產品精深加工重點實驗室,合肥 230009)
小麥面筋蛋白是一種營養均衡,食用安全的天然植物蛋白,具有來源廣、成本低等特點。由于其良好的黏彈性、可降解性及成膜性,因而被廣泛應用于焙烤食品、生物基礎材料等領域[1-3]。小麥面筋蛋白是球蛋白結構,且對熱敏感,高溫熱誘導處理會破壞其分子內或分子間相互作用,使位于蛋白質內部的疏水基團得以暴露,導致蛋白質變性或者聚集[4]。有報道稱熱誘導聚集體的形成降低了小麥面筋蛋白在披薩等焙烤食品中的加工性能[5],因而對小麥面筋蛋白進行改性處理,以減少其熱誘導聚集體,對于其加工應用具有重要意義。
蛋白質脫酰胺是通過將蛋白質中的酰胺基團轉化為高疏水性的羧基,增加凈負電荷數,從而改變蛋白質的結構并提升其溶解性及其它功能性質[6-7]。蛋白質脫酰胺的方法主要有化學法和酶法,采用酶法脫酰胺在溫和性、高效性、安全性方面更具有優勢[8-9]。目前可用于脫酰胺的酶有蛋白酶、蛋白質谷氨酰胺轉氨酶、肽谷氨酰胺酶及蛋白質谷氨酰胺酶(PGase)。其中PGase已被用于米谷蛋白、玉米蛋白等食品蛋白質改性,研究發現PGase明顯改善了米谷蛋白在弱酸性及中性條件下的溶解性[10],也增加了玉米蛋白在中性條件下的乳化性[11]。小麥面筋蛋白中富含Gln殘基,利用PGase處理小麥面筋蛋白,可以有效促使蛋白質結構伸展,并降低其致敏性[12]。先前關于PGase脫酰胺結合熱誘導對乳清分離蛋白的影響研究表明,PGase處理后乳清分離蛋白的熱誘導聚集體減少,且凝膠質地更加柔軟[13]。盡管目前已有大量關于熱誘導小麥面筋蛋白的報道[14-15],但采用PGase進行熱誘導前預處理,研究其對熱誘導小麥面筋蛋白構象及凝膠性質影響的報道較少。
采用稀釋的小麥面筋蛋白溶液研究PGase脫酰胺后熱誘導處理對小麥面筋蛋白構象的影響,并利用質構儀、掃描電子顯微鏡等研究PGase處理小麥面筋蛋白熱誘導凝膠樣品凝膠性質及微觀結構的變化,探討其構象與凝膠性質之間的關系。以期拓寬小麥面筋蛋白的應用范圍,為其高值化利用提供參考。
1 材料與方法
1.1 材料與試劑
小麥面筋蛋白:安徽瑞福祥食品有限公司;蛋白質谷氨酰胺酶(SD - C100S,EC 3.5.1.2):阿瑪諾天野酶制劑商貿(上海)有限公司;去離子水為實驗室采用Milli-Q凈水系統進行自制;磷酸氫二鈉、磷酸二氫鈉等化學試劑均為分析純級:國藥集團化學試劑有限公司。
1.2 主要儀器設備
Q200型差示掃描量熱儀:美國Bio-Rad公司;Nicolet 67傅里葉紅外光譜儀:美國熱電公司;JSM-6490LV掃描電子顯微鏡:日本電子公司;TA-XT plus物性測定儀:美國Stable Micro System公司;SHIMADZU RF-5301 PC型熒光分光光度計:島津(香港)有限公司。
1.3 方法
1.3.1 未經熱誘導處理及熱誘導處理脫酰胺小麥面筋蛋白的制備
將小麥面筋蛋白溶于200 mM,pH=7.0的磷酸鹽緩沖液配制成7%(m/V)的懸濁液,分別加入1、3、5、10 U/g的 PGase,于搖床中 40 ℃,110 r/min條件下脫酰胺反應1 h,隨后立即冰浴冷卻。為探究PGase脫酰胺隨后熱誘導處理對小麥面筋蛋白構象的影響,需制備未經熱誘導處理及熱誘導處理的脫酰胺小麥面筋蛋白樣品。脫酰胺反應結束后,將樣品分為兩部分:一部分直接冷凍干燥,即得到未經熱誘導處理的脫酰胺小麥面筋蛋白樣品,分別記為DWG -1、DWG -3、DWG -5、DWG -10;另一部分置于90℃水浴加熱40 min,隨后冰浴冷卻,凍干后得到熱誘導處理的脫酰胺小麥面筋蛋白樣品,分別記為HDWG -1、HDWG -3、HDWG -5、HDWG -10。未處理及只經過熱誘導處理的小麥面筋蛋白分別記為WG、HWG,作為對照。
1.3.2 PGase脫酰胺小麥面筋蛋白熱誘導凝膠的制備
脫酰胺小麥面筋蛋白熱誘導凝膠是采用12%的小麥面筋蛋白懸濁液制備得到。將小麥面筋蛋白加入去離子水中,攪拌30 min分別加入1、3、5、10 U/g的PGase,脫酰胺及熱誘導處理同1.3.1所述,隨后立即冰浴冷卻,即得到脫酰胺小麥面筋蛋白熱誘導凝膠樣品,分別記為 gel-1,gel-3,gel-5,gel-10,未加入PGase相同條件下制備的小麥面筋蛋白熱誘導凝膠記為ck。凝膠樣品于4℃冰箱過夜后用于凝膠性質測定。
1.4 分析方法
1.4.1 脫酰胺度測定
脫酰胺度用脫酰胺反應過程中產生氨的量與小麥面筋蛋白完全脫酰胺產生氨的量之比來表示,其中氨含量的測定采用康威氏擴散皿法[16]。
1.4.2 內源性熒光光譜分析
將DWG及HDWG樣品分別溶于200 mM,pH=8.2的磷酸鹽緩沖液,配制成5 mg/mL的懸濁液,于25℃,8000 r/min離心10 min,取50μL上清液于石英比色皿中,使用熒光分光光度計測定在激發波長為295 nm時,樣品蛋白在320-460 nm范圍內的熒光發射光譜。
1.4.3 紅外光譜分析
采用傅里葉變換衰減全反射紅外光譜法測定DWG及HDWG樣品中各二級結構含量。在Nicolet 67傅里葉紅外光譜儀中對樣品進行32次全波段掃描(400~4 000 cm-1),選擇圖譜中1 600~1 700 cm-1的酰胺 I帶區域進行分析,依據 Wang等[17]對酰胺Ⅰ帶各二級結構的區域劃分,計算出二級結構含量。
1.4.4 熱特性分析
準確稱取3~5 mg DWG及HDWG樣品于鋁盤中,壓盤,以空盤為對照,采用TA-Q200-DSC以10℃/min的升溫速率在20~100℃之間進行熱掃描,氮氣流速為50 mL/min,變性溫度和變性焓由DSC自帶軟件進行分析。
1.4.5 凝膠強度
采用TA-XT plus物性測定儀測定小麥面筋蛋白凝膠樣品的凝膠強度,測定參數為:測前速度5 mm/s;測中速度2 mm/s;測后速度5 mm/s;目標深度為10 mm;探頭對凝膠按壓變形時所產生的最大破壞力作為凝膠強度。
1.4.6 保水性
小麥面筋蛋白凝膠樣品的保水性測定參照Cao等[18]的方法。取3 g樣品切成4 mm×4 mm×4 mm的小塊,置于離心管中,于8000 r/min離心20 min,用濾紙將離心出來的水分吸除,再次稱重。保水性(WHC)計算公式:

式中:W1為離心前凝膠樣品的質量/g;W2為移除水分后凝膠樣品的質量/g。
1.4.7 非可凍結水含量
總含水量(Wt)測定:參照GB 5009.3—2016《食品中水分的測定》中直接干燥法。
可凍結水含量(Wf)測定:參照Chen等人[19]的方法。取3~5 mg小麥面筋蛋白凝膠樣品于鋁盤中,壓盤,以空盤作對照,熱掃描以10℃/min的升溫速率從-50℃升至60℃,氮氣流速50 mL/min,變性焓由DSC自帶軟件進行分析。可凍結水含量為每克濕凝膠樣品的變性焓與純水變性焓(334 J/g)的比值。非可凍結水含量(Wnf)計算公式:

1.4.8 微觀形貌觀察
將小麥面筋蛋白凝膠樣品切成3 mm×3 mm×1 mm的小塊,經凍干后進行噴金處理,采用掃描電子顯微鏡在25 KV的加速電壓下觀察其微觀結構。
1.5 數據統計分析
所有實驗均進行至少三次重復,數據以平均值±標準差表示;采用SPSS軟件進行顯著性(P<0.05)分析,通過Origin Pro 2016軟件作圖。
2 結果與分析
2.1 小麥面筋蛋白PGase脫酰胺處理
為研究PGase對小麥面筋蛋白的影響,測定了不同酶添加量時DWG樣品的脫酰胺度(DD)及水解度(DH),結果如表1所示。DWG樣品的DD和DH值均隨著酶添加量的增加而增加;但相比于脫酰胺度,水解度增加較緩慢,且處于較低水平(<2%)。有報道稱PGase處理會促使蛋白質發生水解反應[20]:一方面脫酰胺反應將Gln轉化為Glu,分子內靜電斥力增加,導致蛋白質分子裂解。另一方面脫酰胺導致蛋白質分子伸展,從而釋放一些小肽片段。這與 Suppavorasatit等[9]的結果一致,在 PGase脫酰胺反應的同時伴隨著較小程度的水解反應發生。
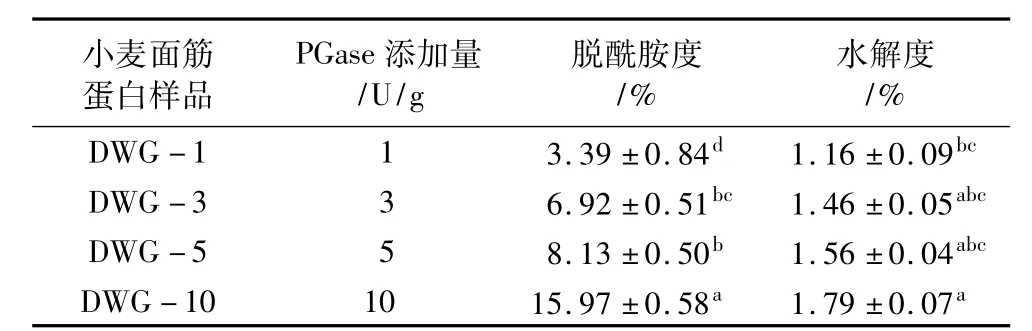
表1 PGase處理小麥面筋蛋白樣品脫酰胺度和水解度的變化
2.2 PGase脫酰胺與熱誘導處理對小麥面筋蛋白構象的影響
2.2.1 內源性熒光光譜分析
色氨酸、酪氨酸等氨基酸能夠發射熒光,通過分析DWG和HDWG樣品內源性熒光曲線,可以表征小麥面筋蛋白氨基酸微環境及結構的變化[21]。由圖1可知,隨著酶添加量增加,DWG樣品的熒光強度(FI)顯著增加,其中DWG-10的FI值是WG的3.5倍。這是由于PGase處理后負電荷增多,分子內或間靜電斥力增加導致蛋白質結構伸展,暴露出更多的色氨酸殘基至親水環境中,因而蛋白質色氨酸微環境極性增加。HDWG樣品的 FI值變化趨勢與DWG樣品相同,不同的是,熱誘導處理后脫酰胺小麥面筋蛋白的FI值減小,這可能是由于熱誘導處理導致小麥面筋蛋白發生熱變性聚集[13]。隨著酶添加量增加,DWG和HDWG樣品的最大發射波長(λmax)均未發生明顯的變化。但與DWG樣品相比,HDWG樣品的λmax發生紅移,表明熱誘導處理使小麥面筋蛋白結構發生了改變。
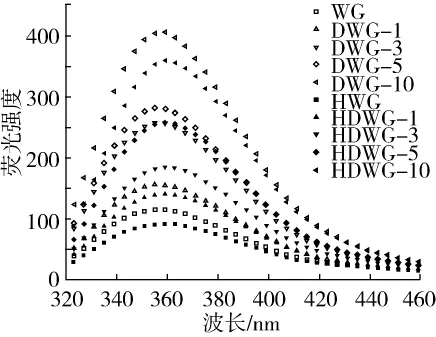
圖1 脫酰胺及熱誘導處理小麥面筋蛋白樣品內源性熒光光譜
2.2.2 傅里葉紅外光譜分析
傅里葉紅外光譜(FTIR)可以表征蛋白質的構象,其中酰胺Ⅰ帶(1 600~1 700 cm-1)是分析蛋白質二級結構最靈敏的區域。DWG及HDWG樣品二級結構含量如圖2所示,可以看出小麥面筋蛋白二級結構主要由β–折疊組成。隨著PGase添加量增加,DWG樣品α–螺旋和β–轉角結構含量增加,而β–折疊結構含量降低。有報道稱β–折疊結構相對穩定,而α–螺旋、β–轉角和無規則卷曲結構比較靈活[22],表明PGase處理使小麥面筋蛋白結構靈活性增加。另外Glu是組成β–轉角結構的主要成分,隨著脫酰胺反應產生更多的Glu,DWG樣品β-轉角結構含量增加。與 WG相比,HWG樣品α-螺旋結構含量減少,β-折疊結構含量增加,這歸因于小麥面筋蛋白的熱誘導聚集。楊芳[23]在對豆腐凝膠形成機理的研究中提到,分子間β-折疊結構與蛋白聚集體的形成有關。在圖2a中 DWG樣品β-折疊結構含量降低,表明脫酰胺處理后蛋白質聚集體減少;同時HDWG樣品的β-折疊結構含量也具有同樣的變化趨勢,即隨著酶添加量的增加而減少,且通過比較發現DWG樣品的β-折疊結構含量較HDWG樣品稍低,從而表明PGase處理在一定程度上能夠抑制小麥面筋蛋白熱變性聚集。此外,我們通過分析α-螺旋與β-折疊結構含量的比值(數據未給出)的變化,也得出了相同的結論。
2.2.3 熱特性分析
DSC圖譜中變性溫度Td和熱焓值ΔH能夠反映蛋白質變性狀態:ΔH能夠表示蛋白質結構的有序程度,ΔH值越大,則蛋白質結構更加有序;Td能夠表示蛋白質聚合程度,Td值越大,則蛋白質結構更加緊密[24]。DWG和HDWG樣品的DSC圖譜及熱特性參數如圖3和表2所示。由圖3可知,DWG和HDWG樣品均呈現向上的吸熱峰,表明小麥面筋蛋白變性是一個吸熱過程。在表2中,隨PGase添加量增加,DWG樣品Td值先降低后增加,說明PGase處理后小麥面筋蛋白結構伸展,但并不會發生持續伸展,當達到一定的DD后又有所聚集;這可能是由于蛋白質伸展過程中疏水區域的暴露,導致疏水相互作用增加,促使蛋白分子聚集。與WG相比,HWG樣品Td值增大,表明小麥面筋蛋白發生熱變性聚集;而ΔH值則顯著降低,說明熱誘導處理后其蛋白結構變得更加無序。與HWG相比,HDWG樣品Td值隨著酶添加量的增加而降低,而ΔH值則持續增大,說明脫酰胺能夠抑制小麥面筋蛋白的熱誘導聚集行為,使蛋白質結構更加有序。
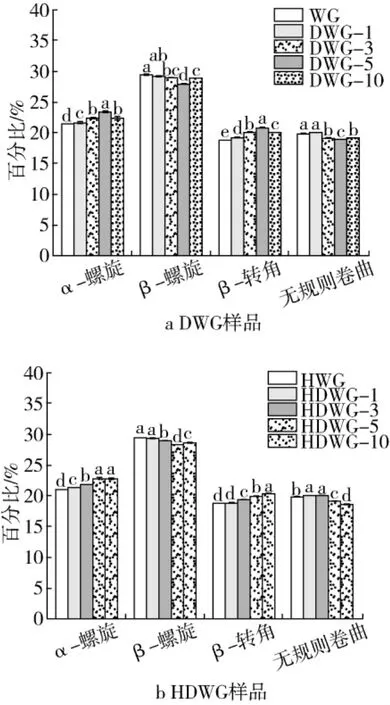
圖2 DWG樣品及HDWG樣品二級結構含量的變化
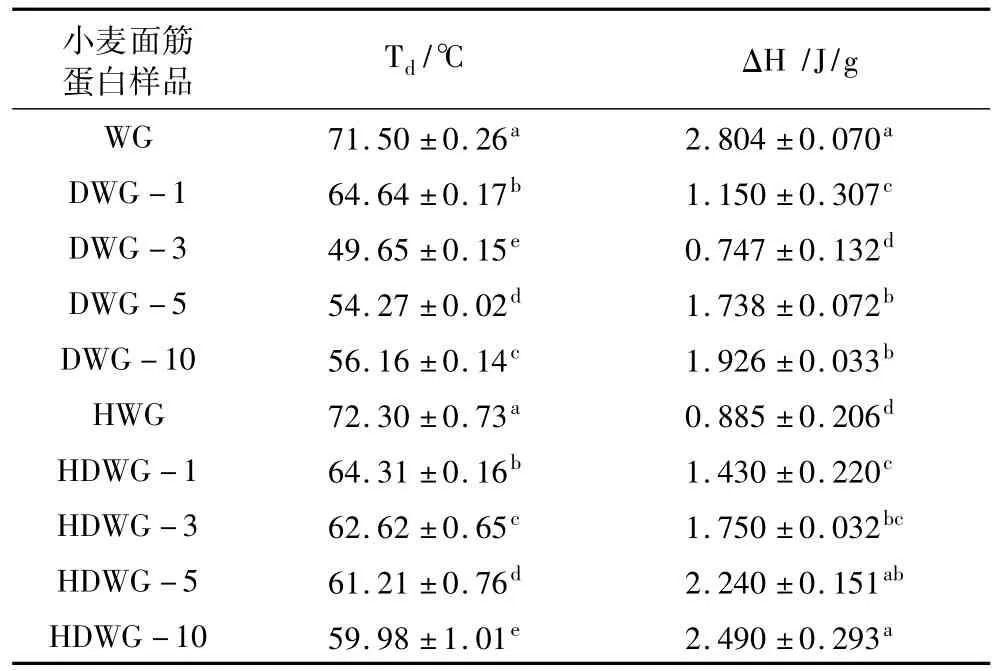
表2 脫酰胺及熱誘導處理小麥面筋蛋白樣品的熱特性參數
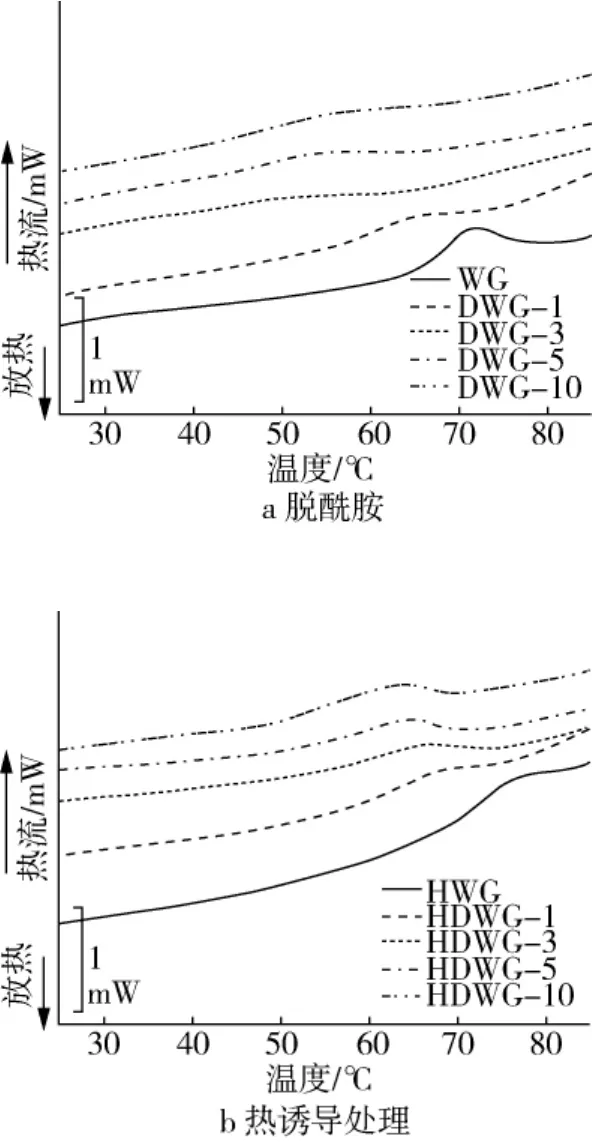
圖3 脫酰胺及熱誘導處理小麥面筋蛋白樣品DSC圖譜
2.3 PGase脫酰胺對小麥面筋蛋白熱誘導凝膠的影響
2.3.1 凝膠強度和保水性分析
凝膠強度和保水性是兩個重要的凝膠特性,能夠反映凝膠體系中蛋白質與水之間相互作用[25]。小麥面筋蛋白凝膠樣品的凝膠強度和保水性如圖4所示,可以看出隨著PGase添加量增加,小麥面筋蛋白凝膠樣品的凝膠強度和保水性呈現先增大后減小的趨勢,但均明顯高于相應對照組,表明PGase改性有助于提高小麥面筋蛋白熱誘導凝膠的凝膠性質;其中gel-3的凝膠強度和保水性均最大,分別為903.27 N和78.70%。一方面PGase處理后小麥面筋蛋白結構伸展,暴露出更多的疏水殘基,而后疏水相互作用導致蛋白結構重排,從而形成更加均勻有序的凝膠網絡;另外脫酰胺反應導致Glu殘基增多,同時蛋白分子內靜電斥力及親水區域也增加,從而凝膠強度和保水性增加。酶添加量繼續增多,凝膠強度和保水性反而稍有降低,這可能是由于更多的酶添加量、更大的脫酰胺程度導致蛋白質分子聚集,從而進一步影響了其凝膠樣品的凝膠性質。這說明PGase能夠一定程度上抑制小麥面筋蛋白的熱變性聚集。
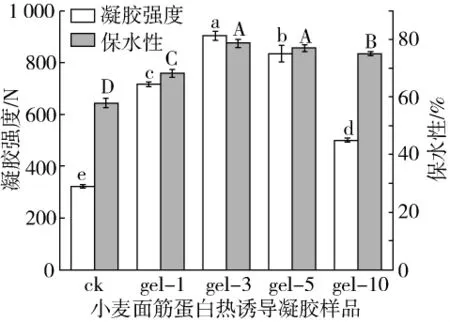
圖4 脫酰胺小麥面筋蛋白熱誘導凝膠樣品凝膠強度和保水性的變化
2.3.2 非可凍結水含量分析
在蛋白質凝膠中,凝膠網絡-水相互作用能夠對其結構及功能產生顯著影響,從而對于決定和維持蛋白質三維網絡結構至關重要。有報道將凝膠中的水分為非可凍結水及可凍結水(包括可凍結結合水、自由水)兩類,并認為水分分布會顯著影響凝膠的質構及穩定性[26]。如圖5所示,隨著PGase添加量增加,小麥面筋蛋白凝膠樣品中凍結水含量降低,非可凍結水含量相應增加;這是由于PGase改性后較高的電荷密度使得可凍結水與肽鏈相互作用增加,轉換為非可凍結水;另外PGase處理后,蛋白質與水結合能力增加,導致小麥面筋蛋白凝膠網絡持水性增大,親水基團相互作用也促使更多的非可凍結水形成。此外,小麥面筋蛋白凝膠樣品中總水含量與非可凍結水含量變化一致,也隨著酶添加量的增大而增加。有報道稱凝膠樣品中較高的總水含量及非可凍結水含量一般與其較高的保水性有關[19],在本研究中當酶添加量為5 U/g時,總含水量及非可凍結水含量更高,其中gel-5中非可凍結水含量為19.56%,是對照組的2倍。
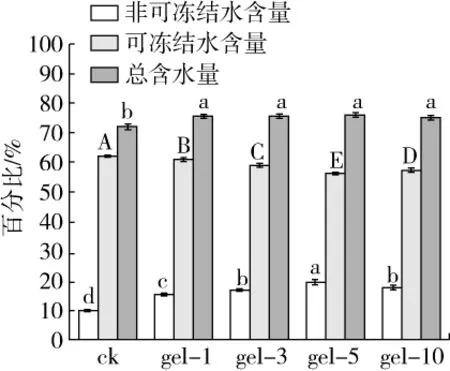
圖5 脫酰胺小麥面筋蛋白熱誘導凝膠樣品水分分布
2.3.3 微觀結構分析
脫酰胺小麥面筋蛋白熱誘導凝膠樣品的微觀形貌如圖6所示。由圖6可知,未經脫酰胺改性的小麥面筋蛋白熱誘導凝膠的結構孔徑較大,且分布不均,呈海綿狀結構。隨著PGase添加量增加,小麥面筋蛋白凝膠樣品孔徑減小,形成了多孔且更加有序的網狀結構;這與Cao等[18]的測定結果相一致,較高的非可凍結水含量對應著更高凝膠強度且更緊密結構的凝膠網絡,這對于小麥面筋蛋白凝膠產品的生產提供了依據。

圖6 脫酰胺小麥面筋蛋白熱誘導凝膠樣品的掃描電子顯微鏡圖(×250)
3 結論
3.1 PGase脫酰胺導致小麥面筋蛋白構象發生不同于熱誘導處理所導致的變化:PGase脫酰胺使小麥面筋蛋白結構伸展;熱誘導處理使得小麥面筋蛋白發生熱變性聚集而導致結構變得無序;但PGase脫酰胺能夠在一定程度上抑制小麥面筋蛋白的熱誘導聚集。
3.2 PGase脫酰胺提高了小麥面筋蛋白熱誘導凝膠的凝膠強度和保水性;且PGase處理后小麥面筋蛋白與水相互作用增加,使得其凝膠樣品的非可凍結水含量增加。此外,適度的PGase脫酰胺有利于熱誘導小麥面筋蛋白形成更加有序的凝膠網絡結構。

