響應面法優化油茶粕培養里氏木霉酶系活力條件及發酵工藝研究
陳曉媛 于 達 朱 凱 宋廣磊
(浙江工商大學食品與生物工程學院,杭州 310018)
自然界中的細菌、真菌和放線菌等微生物均能產纖維素酶降解纖維素,但里氏木霉因其產酶量高、易于培養控制及其代謝物安全無毒,被認為是產纖維素酶的良好菌株,對纖維素原料具有較高的降解力[1-2]。里氏木霉生產的纖維素酶具有重要的應用價值,在提取植物材料生物活性化合物中顯示出巨大的潛力,也可用于纖維素類生物乙醇和其他生物能源的生產[3];在果蔬業上,利用纖維素酶水解可溶性果膠和細胞壁[4];在釀酒業上,促進釋放葡萄糖,改善啤酒的質感;另外在農業、醫藥業、飼料工業[5-7]等方面都有所應用。
油茶粕是油茶籽經過提取油脂后的殘渣,是一種富含多種營養成分的副產品。油茶粕營養豐富,主要含脂肪、蛋白質、多糖、茶皂素、粗纖維等物質,其中粗脂肪為5% ~8%,粗蛋白為12% ~18%,糖類物質為30% ~60%,茶皂素為10% ~14%,粗纖維為5% ~8%[8]。油茶粕主要被應用于飼料的開發[9-10],在水產養殖中作為清塘劑[11],還用于生產沼氣[12]。近幾年,研究者們分析制備油茶粕中的茶皂素[13-14]、蛋白質[15-16]、多糖[17-18]等多種活性成分,不僅提高了油茶粕的利用率,同時也產生了一定程度的經濟價值和生態效益。但是對油茶粕纖維素鮮有研究,油茶粕的開發層次仍然較低,其價值還沒有得到充分利用。
本研究以油茶粕為原料,選擇油茶粕比例、微晶纖維素添加量、接種量和初始pH為研究因素,測定不同發酵條件下纖維素酶活力,并以微晶纖維素作為酶系誘導底物,比較培養條件對里氏木霉纖維素酶的影響,在單因素的基礎上,通過響應面分析,優化以油茶粕為底物的里氏木霉發酵制備可溶性膳食纖維的工藝條件,探索酶系活力與發酵條件的關系。
1 材料與方法
1.1 材料與試劑
里氏木霉(Trichodermareesei):中國工業微生物菌種保藏管理中心,命名為Trichodermareesei CICC;油茶粕;纖維二糖;微晶纖維素;乙醇、羧甲基纖維素鈉、酒石酸鈉、3,5-二硝基水楊酸、硫酸銨、磷酸二氫鉀、亞硫酸鈉均為分析純。
1.2 儀器與設備
303系列電熱恒溫培養箱;SHZ-82A水浴恒溫振蕩器;BOXUN立式壓力蒸氣滅菌器;DK-S24電熱恒溫水浴鍋;XM-800Y多功能小型粉碎機;SWCJ-1D潔凈工作臺;KQ-80TDB超聲波清洗器;TG18KR離心機;UV-2550紫外分光光度計。
1.3 實驗方法
1.3.1 油茶粕的預處理
將油茶粕烘干后,用粉碎機進行粉碎,以1∶9的比例加入80%乙醇,90℃水浴4 h,為脫除油茶粕中的抗營養因子茶皂素,不斷攪拌最大程度脫除油茶粕中的茶皂素。水浴后冷卻至室溫,抽濾取濾渣并烘干,冷藏于冰箱備用。
1.3.2 培養基的配制
PDA培養基的配制:稱取洗凈去皮后的馬鈴薯200 g,切成約1 cm3的小塊,于沸水浴30 min,用紗布過濾,加入15 g瓊脂,加熱攪拌均勻。待瓊脂完全溶解后,加入20 g葡萄糖,攪拌均勻,加蒸餾水至1 000 mL。分裝,121℃滅菌30 min,備用。
液體培養基的配制:葡萄糖20 g,硫酸銨5 g,磷酸二氫鉀15 g,硫酸鎂0.6 g,氯化鈣0.6 g,硫酸亞鐵0.005 g,加蒸餾水至1 000 mL。分裝,121℃滅菌30 min,備用。
1.3.3 菌株的活化
取里氏木霉(Trichodermareesei CICC)菌株的凍干管,用接種環蘸取少量菌株凍干粉,于液體培養基中,30℃、200 r/min搖床震蕩培養72 h。蘸取少量菌液,劃線涂布于PDA固體培養基平板上,30℃,培養72 h。按上述方法重復2次,液體轉平板,完成菌株活化。
1.3.4 菌懸液的制備
將PDA固體培養基上長勢較好的綠色菌落移接到液體培養基中,于30℃、130 r/min搖床中振蕩培養3 d。每隔2 h在549 nm條件下測量菌液的紫外吸光值。以時間為橫坐標,吸光值為縱坐標,繪制菌體生長曲線。培養至對數生長期后,用血球計數板進行計數,鏡檢稀釋至適宜濃度,以108cfu/mL為宜。
1.3.5 單因素試驗
1.3.5.1 油茶粕比例對發酵的影響
根據預實驗,初步確定油茶粕添加比例為:2.0%、4.0%、6.0%、8.0%、10.0%、12.0%,微晶纖維素添加量為1.0%,接種量為12.0%,pH值為5.0,于30℃、130 r/min搖床中振蕩培養96 h后,分別測定發酵液中纖維素酶活力。
1.3.5.2 微晶纖維素添加量對發酵的影響
根據預實驗情況,初步確定微晶纖維素添加量為:0.2%、0.6%、1.0%、1.4%、1.8%、2.2%,油茶粕比例為8.0%,接種量為 12.0%,pH 值為 5.0,于 30℃、130 r/min搖床中振蕩培養96 h后,分別測定發酵液中纖維素酶活力。
1.3.5.3 接種量對發酵的影響
根據預實驗情況,初步確定里氏木酶的接種量為:2.0%、4.0%、6.0%、8.0%、10.0%、12.0%、14.0%,油茶粕比例為8.0%,微晶纖維素添加量為1.0%,pH 為5.0,于30 ℃、130 r/min 搖床中振蕩培養96 h后,分別測定發酵液中纖維素酶活力。
1.3.5.4 pH 對發酵的影響
根據預實驗情況,初步選擇 pH 為 2.0、3.0、4.0、5.0、6.0、7.0、8.0,油茶粕比例為 8.0%,微晶纖維素添加量為 1.0%,接種量為 12.0%,于 30℃、130 r/min搖床中振蕩培養4 d后,分別測定發酵液中纖維素酶活力。
1.3.6 粗酶液的制備
發酵完成后,取發酵液在8 000 r/min的條件下離心10 min,收集上清液,即為粗酶液。獲得的粗酶液放置于0.05 mol/L的(NH4)2SO4溶液中,于4℃冰箱中保存不超過48 h。
1.3.7 纖維素酶活力的測定[19]
1.3.7.1 羧甲基纖維素酶活力(CMCA)的測定
以0.1 mol/L pH5.0的磷酸氫二鈉-檸檬酸緩沖液配制1%羧甲基纖維素鈉(CMC-Na)底物溶液。取0.5 mL酶液加入1.5 mL CMC-Na溶液中,于40℃水浴保溫30 min,測定還原糖的含量。空白對照組加等體積酶液于蒸餾水中,沸水浴10 min,滅酶活。
酶解反應中每小時由底物產生1.0 mg還原糖所需的酶量定義為一個活力單位,用U/mL表示。
1.3.7.2 微晶纖維素酶活力(MCCA)的測定
在試管中加入0.25 g微晶纖維素和1.5 mL磷酸氫二鈉-檸檬酸緩沖液,再加入0.5 mL適當稀釋的酶液(空白對照加等體積滅活酶液),40℃水浴反應30 min,測定還原糖的含量。
酶解反應中每小時由底物產生1.0 mg還原糖所需的酶量定義為一個活力單位,用U/mL表示。
1.3.7.3 纖維二糖酶活力(CBA)的測定
以0.1 mol/L pH5.0磷酸氫二鈉-檸檬酸緩沖液配制0.5%纖維二糖溶液。取1.5 mL纖維二糖底物溶液,加入0.5 mL適當稀釋的酶液(空白對照加等體積滅活酶液),40℃水浴反應30 min,測定還原糖的含量。
酶解反應中每小時由底物產生1.0 mg還原糖所需的酶量定義為一個活力單位,用U/mL表示。
1.3.7.4 濾紙酶活力(PFA)的測定
于試管底部預先放置0.1 g新華濾紙,40℃水浴預熱5 min,然后將相同溫度下預熱5 min的適當稀釋酶液0.5 mL(空白對照加等體積滅活酶液)和1.5 mL磷酸氫二鈉-檸檬酸緩沖液,40℃水浴保溫30 min,測定反應后還原糖的含量。
酶解反應中每小時由底物產生1.0 mg還原糖所需的酶量定義為一個活力單位,用U/mL表示。
1.3.7.5 還原糖測定
采用3,5 -二硝基水楊酸(DNS)法[20]。
3,5-二硝基水楊酸(DNS)試劑的配制:稱取酒石酸鈉182.0 g,500 mL蒸餾水中溶解,然后加入6.3 g 3,5 -二硝基水楊酸和21.0 g NaOH,再加入5.0 g重蒸酚和5.0 g亞硫酸鈉,45℃水浴,期間不斷攪拌至完全溶解,溶液清澈透明,冷卻后,加蒸餾水定容至1 000 mL,貯于棕色瓶中,一周后即可使用,常溫保存,可保存6個月。
葡萄糖標準曲線:取 0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.45、0.50 mg/mL 葡萄糖標準溶液各1.0 mL分別置于25 mL具塞試管中,各加入3,5-二硝基水楊酸溶液(DNS)2.0 mL,5 min沸水浴(DNS在堿性條件下與還原糖反應時生成有色化合物),然后迅速冷卻至室溫,補加蒸餾水至25 mL,充分搖勻,在波長為549 nm處測定吸光度值(以空白溶液進行調零),以葡萄糖溶液濃度為橫坐標,吸光度值為縱坐標,繪制標準曲線。
酶解液中還原糖含量的測定:在水浴中酶解反應后,迅速在沸水浴中加熱5 min,冷卻后加入4.0 mL DNS試劑,搖勻,沸水浴加熱5 min,然后迅速冷卻至室溫,補加蒸餾水至25 mL,充分搖勻。波長549 nm處測其紫外吸光度值,根據葡萄糖標準曲線的回歸方程,計算樣品中還原糖的濃度,進而計算纖維素酶活力。
1.3.8 響應面設計
為了確定最優的發酵條件,運用Box-Behnken中心組合試驗設計,在相應的最佳單個條件的基礎上,設計成四因素三水平的試驗和響應面分析實驗。
1.3.9 驗證試驗
通過對響應面設計對得到發酵條件的結果加以驗證,做3個平行,以此確定發酵工藝條件。
2 結果與分析
2.1 葡萄糖標準曲線
以 0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.45、0.50 mg/mL 葡萄糖濃度為橫坐標,549 nm 處測定的吸光度值為縱坐標繪制的標準曲線如圖1所示。
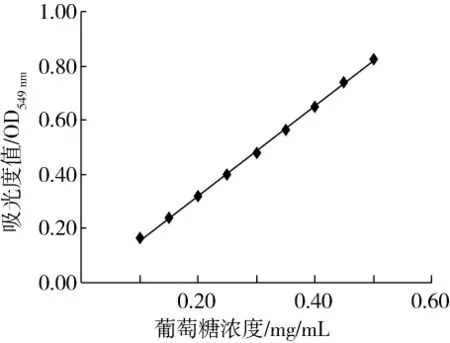
圖1 葡萄糖標準曲線
由圖1可知,在549 nm波長處,葡萄糖濃度與其吸光度值呈線性關系,得到的線性函數關系式為y=1.654 7x-0.009 8,其中 y表示 OD 值,x 表示葡萄糖濃度,R2為0.999 1,表明該曲線的線性關系良好,可用作葡萄糖的標準曲線使用。
2.2 單因素試驗
2.2.1 油茶粕比例對纖維素酶活力的影響
以油茶粕作為發酵底物,設計了不同油茶粕添加量 2.0%、4.0%、6.0%、8.0%、10.0%、12.0% 配制發酵培養基,分別測定發酵液中纖維素酶活力,探究油茶粕比例對纖維素酶活力的影響,結果如圖2所示。

圖2 油茶粕比例對纖維素酶活力的影響
由圖2可知,油茶粕比例對4種酶活力有不同程度的影響。當油茶粕比例為2.0% ~8.0%,隨著油茶粕添加量的增加,4種酶活力均呈升高趨勢。其中當油茶粕比例為8.0%時,CMCA、MCCA和CBA分別達到最大值為 8.12、7.45 和 4.71 U/mL。當油茶粕比例為 8.0% ~10.0%時,CMCA、MCCA 和 CBA呈下降趨勢,而FPA繼續上升,當油茶粕質量分數為10.0%時,FPA達到最大值為4.33 U/mL。當油茶粕比例為10.0% ~12.0%時,CMCA、MCCA 和 CBA 變化趨于平緩,而FPA呈下降趨勢。綜合考慮,8.0%可視為較佳的油茶粕比例。
2.2.2 微晶纖維素添加量對纖維素酶活力的影響
以微晶纖維素作為里氏木霉發酵的誘導劑,根據預實驗結果,設計了微晶纖維素添加量分別為0.2%、0.6%、1.0%、1.4%、1.8%、2.2%配制發酵培養基,測定發酵液中纖維素酶的酶活力,探究微晶纖維素添加量對纖維素酶活力的影響,結果如圖3所示。
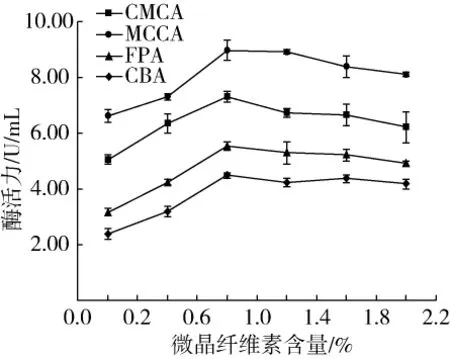
圖3 微晶纖維素添加量對纖維素酶活力的影響
由圖3可知,當微晶纖維素添加量為0.2% ~2.2%時,隨著微晶纖維素添加量的增加,4種酶活力呈先上升后下降的變化。當微晶纖維素添加量為1.0%時,CMCA 最大值為7.31 U/mL,MCCA 最大值為8.98 U/mL,FPA 最大值為 5.55 U/mL,CBA 最大值為4.48 U/mL。當微晶纖維素添加量為0.2% ~1.0%時,4種酶活力上升顯著,當微晶纖維素添加量大于1.0%時,4種酶活力下降不顯著。綜合考慮,1.0%可視為最佳的微晶纖維素添加量。
2.2.3 接種量對纖維素酶活力的影響
一般來說,接種量與酶濃度有密切關系。不同的接種量(2.0%、4.0%、6.0%、8.0%、10.0%、12.0%、14.0%)的菌種分別接種于發酵培養基中(其余條件均相同),以發酵液中纖維素酶活力為評價指標,探究接種量對纖維素酶活力的影響,試驗結果如圖4所示。
由圖4可知,當接種量為2.0% ~14.0%時,隨著接種量的增加,4種酶活力均先升高后下降。當接種量為8.0%時,MCCA達到最大值為8.44 U/mL,此時,CMCA 為7.62 U/mL,FPA 為 4.41 U/mL,CBA為4.31 U/mL。當接種量為 8.0% ~12.0% 時,MCCA呈下降趨勢,而CMCA繼續上升,當接種量為12.0%時,CMCA 達到最大為 8.26 U/mL,此時 MCCA 為7.83 U/mL,FPA 為 4.37 U/mL,CBA 為 5.50 U/mL。當接種量為10.0%時,FPA達到最大值為5.24 U/mL,此時 CMCA 為 7.93 U/mL,MCCA 為8.13 U/mL,CBA 為 4.71 U/mL。綜合考慮,12.0%可作為較合適的接種量。
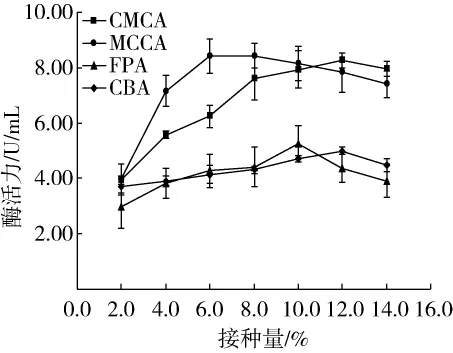
圖4 接種量對纖維素酶活力的影響
2.2.4 pH對纖維素酶活力的影響
發酵培養基中的pH起到調節離子酸堿度的作用,它影響著菌體生長速率和產酶能力,微生物只能在一定pH范圍內條件下的生長。試驗以不同的pH值:2.0、3.0、4.0、5.0、6.0、7.0、8.0,探究其對纖維素酶活力的影響,結果如圖5。
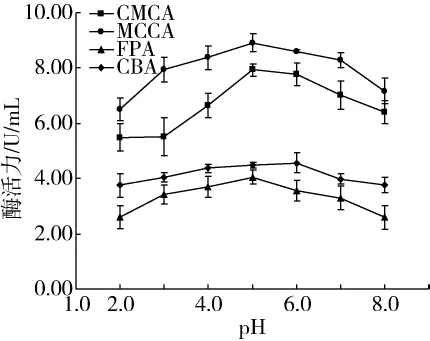
圖5 pH對纖維素酶活力的影響
由圖5可知,當 pH 值為2.0~5.0時,隨著 pH的增大,CMCA、MCCA和FPA均呈上升趨勢,但CMCA和MCCA上升較為顯著。當pH值為5.0時,3種酶活力均達到最大值,分別為 7.93、8.91、4.05 U/mL。當pH 值為5.0~8.0時,隨著 pH 的增大,CMCA、MCCA和FPA均呈下降趨勢。當pH值為2.0~6.0時,隨著pH值的增大,CBA的幾乎沒有變化,當pH值大于6.0時,CBA呈下降趨勢。
綜合考慮,pH 5.0可作為較佳的pH條件。
2.3 響應面優化里氏木霉發酵工藝
根據單因素試驗結果可知,油茶粕比例為8.0%、微晶纖維素添加量為 1.0%、接種量為12.0%、pH為5.0為較佳的發酵條件。運用Box-Behnken中心組合試驗設計,在相應的單個條件的基礎上,選取附近的兩個條件,確定3個水平,從而設計成四因素三水平的試驗,見表1。
根據上述單因素試驗發現,CMCA受油茶粕比例、微晶纖維素添加量、接種量和pH這四個因素的影響,與另外3種酶活力相比,更為顯著,因此以CMCA為響應值,試驗設計與響應值結果見表2。
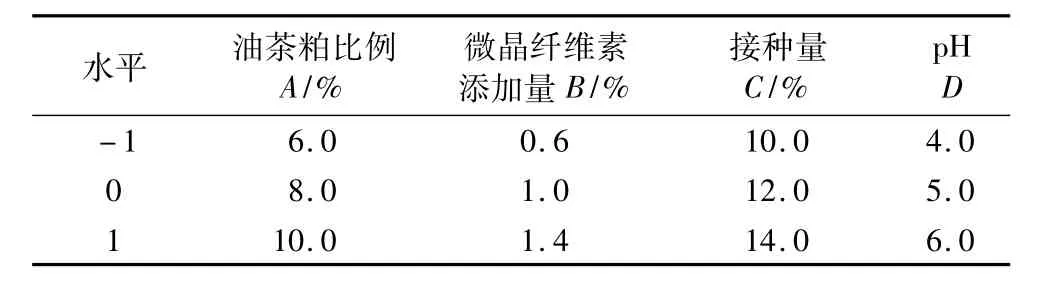
表1 Box-Behnken試驗設計因素水平
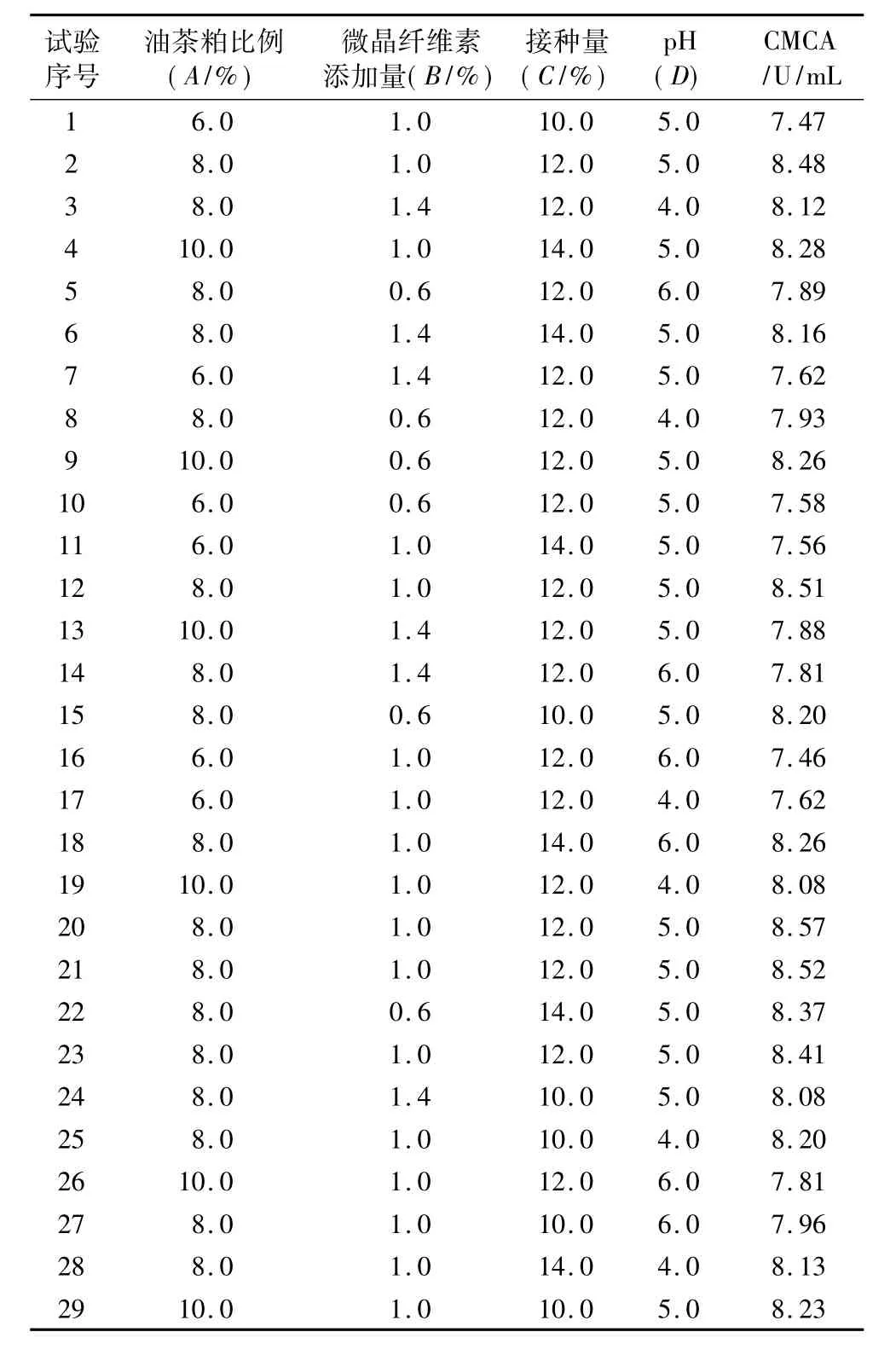
表2 Box-Behnken試驗設計與響應值表
以里氏木霉的CMCA為響應值,利用Design Expert8.0軟件進行回歸分析和方差分析,結果見表3,擬合得到回歸方程:
CMCA=8.50+0.27A - 0.047B+0.052C -0.074D -0.11AB -0.010AC -0.028AD -0.022BC -0.067BD+0.092CD -0.47A2-0.22B2-0.093C2-0.30D2
由表3可知,模型P<0.000 1,表示該模型達極顯著水平;失擬項 P=0.098 6>0.05,結果差異不顯著,說明無其他因素顯著影響本項研究,即模型合適。試驗中一次項A、二次項A2和二次項D2均呈極顯著。各因素影響程度從大到小依次為:A>D>C>B,即油茶粕比例>pH>接種量>微晶纖維素添加量。本模型決定系數R2=0.950 8,說明響應值CMCA測定值和預測值間擬合度良好,校正系數=0.901 6,說明模型能解釋90.16%的響應值變化。
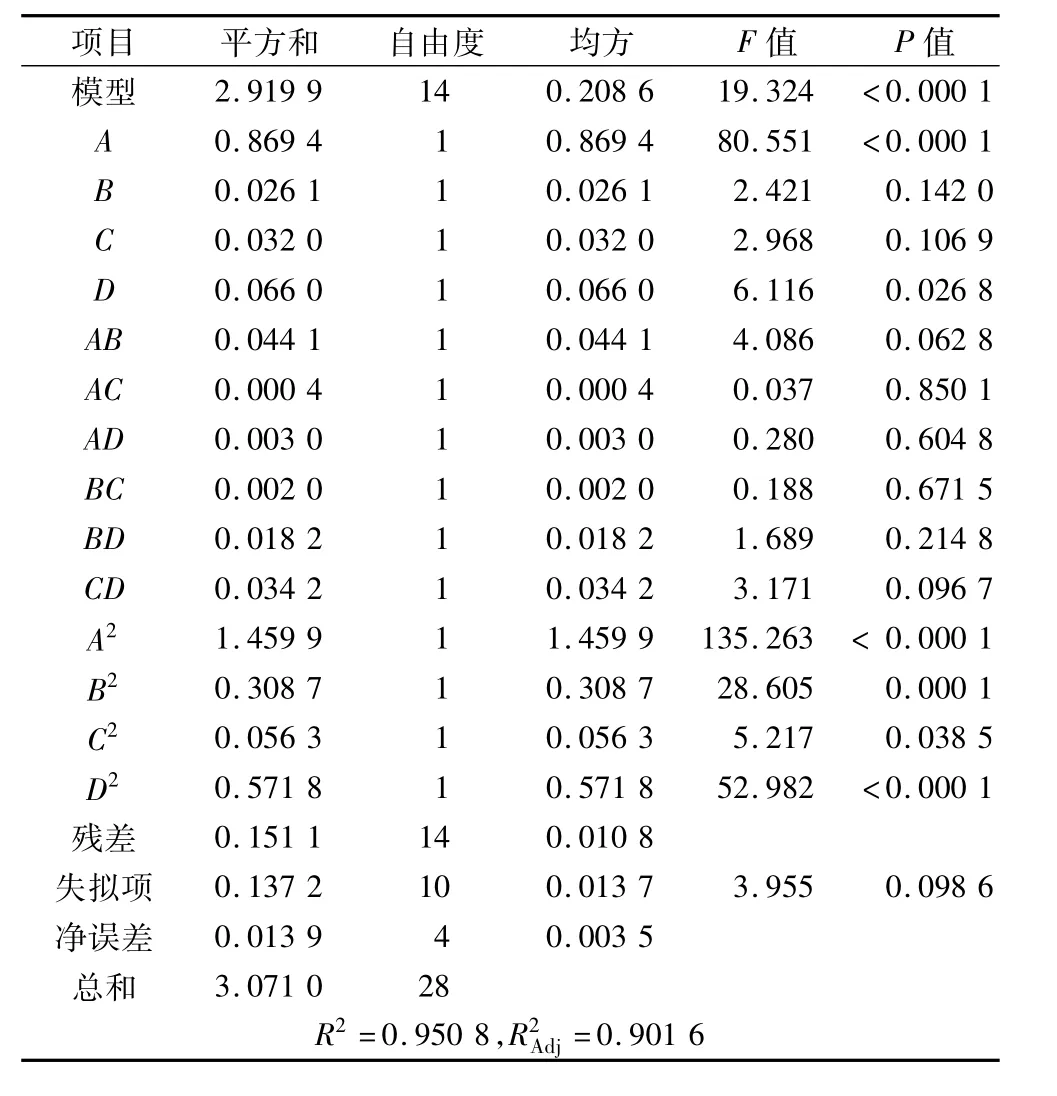
表3 CMCA方差分析
2.4 綜合優化分析
根據回歸分析結果,運用Design-expert 8.0尋找產酶的最高點以及相對應的因素水平,所擬合的響應曲面能夠比較直觀地反映各個因素之間的交互作用,以及對響應值即CMCA的影響,極值條件在曲面的圓心處[21]。等高線可以直觀地反映出,兩個因素交互作用的顯著程度,橢圓表示兩因素交互作用顯著,而圓形則表示兩個因素交互作用不顯著[22]。
根據Design-Expert 8.0軟件優化分析,發現油茶粕比例(A)與微晶纖維素添加量(B)、油茶粕比例(A)與接種量(C)、微晶纖維素添加量(B)與pH(D)和接種量(C)與pH(D)的等高線呈橢圓形,說明這些因素的交互作用較為顯著。通過對回歸方程求極值,可得出當 A=8.6%,B=0.93%,C=12.48%,D=4.9時,即油茶粕比例為8.6%,微晶纖維素添加量為 0.93%,接種量為 12.48%,pH 值為 4.9,此時模型預測的酶活力達到的最大為8.55 U/mL。
2.5 響應面結果驗證
按照模型得到的發酵條件進行驗證試驗,做三次平行實驗,得到的CMCA平均值為8.47 U/mL,與理論預測值相比,相對誤差小于1%,說明該模型可以較好地反映出羧甲基纖維素酶活力的影響。此外,最優條件下,微晶纖維素酶活力為9.28 U/mL,纖維二糖酶活力為5.05 U/mL,濾紙酶活力為5.44 U/mL。
3 討論
里氏木霉酶系水解油茶粕受多種因素的影響,如底物濃度、接種量、溫度、pH 值、發酵時間[23-24]等,通過控制這些因素,優化發酵條件,選擇最佳的產纖維素酶條件。底物是菌株的主要營養物質的來源,其含量直接影響著菌株的生長繁殖。接種量也對菌株發酵產酶有一定的影響。當接種量較低時,菌株產酶量較少,不利于發酵的進行;當接種量過高時,菌體密度過大,培養基營養成分消耗較快,造成后續發酵難以進行,不利于發酵持續推進。每種菌株都有其最適的生長環境,因而發酵溫度、pH值也會影響發酵產酶效果。另外,纖維素酶是誘導酶,研究發現槐糖、微晶纖維素、乳糖、纖維二糖對里氏木霉產纖維素酶均有誘導作用,其中以槐糖和微晶纖維素的誘導效果最好,但槐糖的價格較高,不適合實際應用[25-26]。
試驗發現分油茶粕比例、微晶纖維素添加量、接種量和pH,對羧甲基纖維素酶活力、微晶纖維素酶活力、纖維二糖酶活力和濾紙酶活力都有不同程度的影響,油茶粕比例對4種酶活力影響較顯著。在單因素試驗中,當油茶粕比例為8.0%時,4種酶活力均達到最大。微晶纖維素添加量對4種酶活力的影響較為相似。接種量和pH值對羧甲基纖維素酶活力和微晶纖維素酶活力影響較為顯著,而對纖維二糖酶活力和濾紙酶活力的影響并不顯著。這可能是因為里氏木霉的纖維素酶是一種誘導型的復合酶系,羧甲基纖維素酶和微晶纖維素酶在纖維素酶系列中含量較大,易于表達,而纖維二糖酶所含的比例較小[27-29]。因此為了增強里氏木霉的纖維素酶活力,誘變選育出高產纖維素酶的突變菌株至關重要。
4 結論
以油茶粕為底物,對里氏木霉發酵進行培養,研究了油茶粕比例、微晶纖維素添加量、接種量和pH對里氏木霉纖維素酶活力的影響。在單因素實驗的基礎上,采用響應面分析,優化得到發酵條件為:油茶粕比例為8.6%,微晶纖維素添加量為0.93%,接種量為12.48%,pH值為4.9。在該條件下,羧甲基纖維素酶活力為8.47 U/mL,微晶纖維素酶活力為9.28 U/mL,纖維二糖酶活力為 5.05 U/mL,濾紙酶活力為5.44 U/mL。

