脾切除對原發(fā)性膽汁性肝硬化小鼠肝組織纖維化影響研究*
郭曉霞,郭琲婷,孔祥璐
原發(fā)性膽汁性肝硬化(primary biliary cirrhosis,PBC)是一種病因未明的進行性非化膿性膽管炎性疾病,女性發(fā)病率較高,以肝內膽汁淤積為特征,常并發(fā)其他自身免疫性疾病,肝組織病理學表現(xiàn)為肝內膽管進行性破壞,伴匯管區(qū)炎癥和纖維化,發(fā)生門脈高壓癥,最終導致肝硬化[1]。門靜脈壓力越高,患者肝臟病變程度、肝功能減退程度和出現(xiàn)臨床并發(fā)癥的風險越大[2]。脾功能亢進癥是繼發(fā)于肝硬化門靜脈高壓癥的一種常見臨床表現(xiàn),此類患者易發(fā)生胃食管靜脈曲張破裂出血而危及生命。因此,PBC患者伴脾功能亢進癥的臨床治療不容忽視[3]。脾切除術對門靜脈高壓的療效日益受到廣大學者的關注,有學者指出,在門靜脈高壓癥早期脾臟具有抗肝纖維化功能,而到進展期則無此作用。因此,在門脈高壓早期應當保留脾臟,而在進展期則應切除脾臟[4]。本研究以聚肌胞苷酸腹腔注射制備PBC小鼠模型,探討了脾切除術對PBC小鼠肝組織纖維化程度的影響。
1 材料與方法
1.1 動物、試劑與儀器雌性 C57BL/6小鼠40只,5~6周齡,SPF級,體質量為18±2 g,購自北京華阜康生物科技股份有限公司【許可證號:SCXK(京)2014-0004】。飼養(yǎng)于山西省中醫(yī)藥研究院中心實驗室,室溫控制在22~25℃,保持濕度為40%~60%,12 h晝夜交替光照,給以充足的標準實驗飼料(北京科澳協(xié)力飼料有限公司,產(chǎn)品批號:15043311)和水飼養(yǎng)。依據(jù)山西省中醫(yī)院中心實驗室操作指南,所有受試動物均受到良好的待遇,本研究經(jīng)山西省中醫(yī)院動物倫理委員會審核通過。聚肌胞苷酸(太原博科生物有限公司,批號CAS24939-03-5),檢測小鼠腸組織 TNF-α 的ELISA試劑盒(上海酶聯(lián)生物科技有限公司),兔抗TGF-β1多克隆抗體、RNA提取試劑盒(EasyPure RNA Kit,北京全式金生物技術有限公司,批號J20519),cDNA 逆 轉 錄 試 劑 盒(TransScript First-Strand cDNA Synthesis SuperMi,北京全式金生物技術有限公司,批號J31212),熒光定量PCR試劑盒(QuantiFast SYBR Green PCR Kit,德國QIAGEN公司,批號151039406)。AU5821全自動生化分析儀(日本Olympus公司),Image-Pro Plus 6.0多功能圖象分析管理系統(tǒng)(美國Media Cybernetics公司),CX41正置顯微鏡(OLYMPUS公司),Auegrax-30k低溫臺式離心機(美國Beckman Coulter公司),Addcare ELISA 600酶聯(lián)免疫吸附檢測分析工作站(煙臺艾德康生物科技有限公司),F(xiàn)inesse325石蠟切片機(美國ThermoScientific公司),9902 Veriti定性PCR分析儀(美國 Applied Biosystems公司),T25 ULTRA-TURRAX組織勻漿機(德國IKA公司)。
1.2 PBC小鼠模型的制備 將40只雌性C57BL/6小鼠隨機分為正常對照組、模型組、脾切除組和假手術組,每組10只。參照文獻[5]給予模型組、脾切除組和假手術組動物1%聚肌胞苷酸(poly I:C)5 mg·kg-1腹腔注射,2次 /w,建立 PBC 模型,給予正常對照組等體積生理鹽水腹腔注射。在第20 w時,各組隨機抽樣行組織病理學檢查證實PBC形成。在制備PBC模型成功后,參照文獻方法[6]行脾切除術,給予脾切除組小鼠3.5%水合氯醛(0.01 ml·g-1)腹腔注射,腹部剃毛、消毒。沿腹中線自劍突下1 cm處行橫行切口,進入腹腔,游離脾臟,結扎脾動脈和脾靜脈,切除脾臟;假手術組小鼠行腹壁切開后,輕微翻動脾臟,不切除;正常對照組小鼠不行任何處理。繼續(xù)普通飼養(yǎng)喂養(yǎng)各組動物至32 w。
1.3 標本采集與處理 在20 w和32 w,各組隨機抽取5只小鼠送檢,禁食24 h,眼眶取血。稱體質量,處死動物,采集小鼠全部肝臟、末端回腸,用生理鹽水沖洗。將肝臟用濾紙吸干水分,稱量肝臟濕質量,計算各組小鼠肝臟指數(shù)[肝臟質量(mg)/體質量(g)]。將部分肝組織置入4%多聚甲醛溶液中固定,常規(guī)制片,HE和Masson染色,光鏡下觀察肝組織病理形態(tài)學變化。將剩余肝組織和末端回腸組織迅速置于-80℃冰箱中保存,以備組織蛋白和mRNA提取。
1.4 血生化指標檢測 將全血3000 r/m離心10 min,取上層血清,送至山西省中醫(yī)院檢驗科檢測。
1.5 肝組織 TGF-β1 mRNA水平檢測 采用RT-PCR 法,提取組織總 RNA,取 RNA 5 μg,行逆轉錄反應,合成cDNA,總反應體系為20μl。采用SYBR Green染料PCR法,反應體系為25 μl。應用 Primer Premier 5引物設計軟件設計篩選各基因特異性引物。所有引物均交由上海生工生物工程技術服務有限公司設計、合成。TGF-β1引物:上游5'-TGCTAATGG TGGACCGCAA-3', 下 游 5'-CACTCTTCCCGAATGTCTGA-3',擴增產(chǎn)物 100 bp;β-actin引物:上游5'-AGGCCAACCGTGAAAA-GATG-3',下游 5'-ACCAGAGGCATACAGGGACAA-3',擴增產(chǎn)物101 bp;TβRI引物:上游5'-ATGGTTCCGAG AGGCAGAGAT-3', 下 游 5'-CCATGTCCCATTGTCTTTGTTG-3', 擴 增 產(chǎn) 物 97 bp;TβRII引物:上游5'-CCAGAAGTCCTGCATGAGCAA-3',下游 5'-TGGCAAACCGTCTCCAGAGT A-3',擴增產(chǎn)物117 bp。擴增條件:95℃預變性5 min,95℃變性 10 s,60℃退火延伸 30 s,擴增設定為40個循環(huán)。在反應結束后,由電腦自動分析各樣本的Ct值,通過2-△△Ct計算mRNA相對水平,并由熔解曲線判斷PCR反應的特異性。
1.6 末端回腸TNF-α水平檢測 自-80℃冰箱取出回腸組織,恢復至室溫,稱量后用0.9%生理鹽水20倍稀釋,勻漿,所得混懸液經(jīng)5000 r/m離心15 min,取上清液,采用ELISA法檢測,在酶標儀450 mn波長下測定吸光度(OD值),用標準品繪制標準曲線,獲得樣品TNF-α水平。
1.7 統(tǒng)計學方法 應用SPSS 21.0統(tǒng)計軟件進行統(tǒng)計學處理,計量資料以±s表示,組間比較采用單因素方差分析,組間兩兩比較采用LSD-t或SNK檢驗,等級資料采用秩和檢驗,P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 各組小鼠肝臟指數(shù)和肝功能指標變化比較 術前,各組小鼠肝臟指數(shù)之間差異無顯著統(tǒng)計學意義(P>0.05),模型組、脾切除組和假手術組血清ALT和AST水平均顯著高于對照組(P<0.05);術后,模型組、脾切除組和假手術組肝臟指數(shù)均較正常對照組顯著下降,差異具有統(tǒng)計學意義(P<0.05),脾切除術組肝功能指標有所改善,顯著低于模型組(P<0.05,表1)。
表1 各組小鼠臟器指數(shù)和肝功能指標(±s)比較

表1 各組小鼠臟器指數(shù)和肝功能指標(±s)比較
與對照組比,①P<0.05;與模型組比,②P<0.05
例數(shù) 肝臟指數(shù) ALT(U/L) AST(U/L) ALP(U/L)術前 對照組 5 34.6±4.6 33.5±5.6 146.3±31.1 131.0±26.8模型組 5 37.5±1.6 49.1±10.7① 167.5±25.0① 148.6±20.2①脾切除 5 37.2±5.0 47.3±17.1① 169.8±29.5① 146.4±29.8①假手術 5 37.4±53.9 48.6±12.5① 165.3±21.9① 150.1±23.6①術后 對照組 5 53.2±2.1 40.0±0.3 154.0±4.1 175.8±9.0模型組 5 39.1±1.0① 52.0±9.0 183.4±12.4 195.3±62.6脾切除 5 41.5±5.2① 43.5±6.4② 157.7±20.9② 178.1±38.0②假手術 5 39.6±7.5① 53.4±11.2 186.5±15.8 198.9±41.5
2.2 各組小鼠肝組織病理學變化 術前,正常對照組小鼠肝小葉結構清晰,無炎性細胞浸潤和膠原纖維沉積。模型組、脾切除組和假手術組小鼠肝組織內均可見肝小葉結構紊亂,匯管區(qū)周圍淋巴細胞浸潤明顯,有少量細小的膽管增生、畸形,匯管區(qū)周圍可見藍色膠原纖維環(huán)繞形成的纖維間隔(圖1、圖2);術后,正常對照組肝小葉結構清晰,無明顯炎性細胞浸潤和膠原纖維沉積。模型組和假手術組肝小葉結構紊亂,匯管區(qū)及損傷的膽管周圍淋巴細胞浸潤,類上皮樣肉芽腫圍繞損傷膽管,界板出現(xiàn)碎屑樣壞死,匯管區(qū)周圍有大量的藍色膠原纖維環(huán)繞,形成明顯的纖維間隔。脾切除組小鼠肝組織匯管區(qū)周圍部分膽小管畸形、擴張,有少量的藍色膠原纖維沉積(圖3、圖 4)。
2.3 各組肝組織TGF-β1、TβRI和TβRII mRNA水平比較 術前,模型組、脾切除組和假手術組小鼠肝組織 TGF-β1、TβRI、TβRII mRNA 水平明顯升高,與對照組比較差異具有統(tǒng)計學意義(P<0.05)。脾切除組、假手術組與模型組之間差異無明顯統(tǒng)計學意義(P>0.05);術后,脾切除組小鼠肝組織TGF-β1、TβRI、TβRII mRNA 水平明顯降低,與模型組比,差異有統(tǒng)計學意義(P<0.05,表2)。
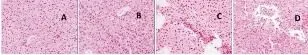
圖1 各組小鼠肝組織病理學表現(xiàn) 術前(HE,100×)

圖2 各組小鼠肝組織病理學表現(xiàn) 術前(Masson,100×)

圖3 各組小鼠肝組織病理學表現(xiàn) 術后(HE,100×)

圖4 各組小鼠肝組織病理學表現(xiàn) 術后(Masson,100×)
表2 各組小鼠肝組織TGF-β1 、TβRI和TβRII m RNA水平(±s)比較

表2 各組小鼠肝組織TGF-β1 、TβRI和TβRII m RNA水平(±s)比較
與對照組比,①P<0.05;與模型組比,②P<0.05
例數(shù) TGF-β1 TβRI TβRII術前 對照組 5 0.4±0.03 0.4±0.15 0.3±0.01模型組 5 1.0±0.02① 1.0±0.07① 1.0±0.06①脾切除 5 1.0±0.09① 1.0±0.06① 1.0±0.11①假手術 5 0.9±0.05① 1.1±0.09① 0.9±0.05①術后 對照組 5 0.5±0.13 0.4±0.03 0.4±0.11模型組 5 1.0±0.10 1.0±0.08 1.0±0.09脾切除 5 0.5±0.09② 0.5±0.05② 0.5±0.09②假手術 5 1.0±0.11 1.1±0.08 0.9±0.07
2.4 PBC小鼠末端回腸TNF-α水平變化 術前,模型組、脾切除組和假手術組小鼠末端回腸TNF-α水平均明顯高于正常對照組,差異具有統(tǒng)計學意義(P<0.05);術后,脾切除組小鼠回腸TNF-α水平明顯降低,與模型組比差異有統(tǒng)計學意義(P<0.05,表3)。
表3 各組小鼠末端回腸TNF-α水平(±s)比較

表3 各組小鼠末端回腸TNF-α水平(±s)比較
與正常組比,①P<0.05;與模型組比,②P<0.05
例數(shù) TNF-α(ng/L)術前 對照組 5 147.5±22.8模型組 5 237.9±33.6①脾切除 5 234.9±35.6①假手術 5 240.3±29.8①術后 對照組 5 58.9±30.6模型組 5 106.8±19.8脾切除 5 50.0±8.6②假手術 5 110.9±20.5
3 討論
PBC是以膽管上皮細胞損傷為特點的自身免疫性肝病,可發(fā)生于所有的種族和民族。文獻報道,本病年發(fā)病率為0.33/10萬~5.8/10萬,患病率為1.91/10萬~40.2/10萬,其中北美和北歐國家發(fā)病率較高[7]。近年來,我國文獻報道的PBC病例數(shù)呈快速上升趨勢[8]。PBC后期可發(fā)生肝硬化和門靜脈高壓的一系列并發(fā)癥,甚至在疾病早期就可出現(xiàn)門靜脈高壓癥[9]。新發(fā)門脈高壓是預后不良的征象,發(fā)生靜脈曲張后的1 a和3 a生存率分別為83%和59%[10]。門靜脈高壓癥的臨床表現(xiàn)為脾腫大、脾功能亢進癥和腹水等。治療門靜脈高壓癥的外科方法有脾切除、斷流術、分流術和肝移植手術等[11]。有學者指出,脾切除術可快速有效地緩解脾功能亢進癥,減緩肝硬化進程,降低肝癌發(fā)生率[12]。
本實驗結果顯示脾切除組、假手術組和模型組肝臟指數(shù)明顯增加,肝功能異常,肝組織病理學損傷明顯,提示肝硬化模型制備成功。在此基礎上行脾切除術,術后脾切除組肝臟體積明顯大于假手術組和模型組,肝功能及肝組織病理學損傷均較模型組有明顯的改善,與文獻報道結果一致[13],提示腫大的脾臟對患者肝功能有損害作用,脾切除術可促進肝再生,改善肝功能,延緩肝纖維化發(fā)生。
TGF-β/Smads信號通路被認為在PBC發(fā)病過程中起關鍵作用[14]。研究表明肝硬化時脾臟合成TGF-β1和TNF-α增加,可能是引起肝臟纖維組織過度增生的關鍵所在[15]。TNFα和TGF-β等能觸發(fā)或參與了肝臟炎癥反應[16]。有學者發(fā)現(xiàn)脾切除可降低血清 TGF-β1水平而改善肝功能,延緩肝纖維化發(fā)展[17]。本研究結果發(fā)現(xiàn)術前脾切除組和模型組肝組織 TGF-β1、TβRI、TβRII mRNA水平明顯高于正常對照組,術后脾切除組肝組織TGF-β1、TβRI、TβRII mRNA 水平有所下降,提示脾切除可下調TGF-β1表達,從而抑制PBC進展。
臨床上,高達80%肝硬化患者存在不同程度的胃腸道癥狀,門靜脈高壓性腸病發(fā)病率約為25%~70%[18],腸道分泌TNF-α和IL-6等增加,進一步破壞腸道免疫功能,是影響患者生活質量和預后的重要原因[19,20]。本研究發(fā)現(xiàn)術前脾切除組和模型組小鼠末端回腸TNF-α水平均明顯高于正常對照組,提示TNF-α在肝臟疾病的進展中發(fā)揮了重要作用。脾切除術后回腸TNF-α有所下降,或許能減輕腸道免疫損傷。

