慢性阻塞性肺疾病患者肋間外肌線粒體相關功能的臨床研究
葉斌 李福祥
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是一種局部氣流受限為特征的肺部疾病,表現為呼吸道或肺實質炎性反應,可進一步發展成為肺心病和呼吸衰竭,嚴重影響患者的日常生活和工作[1-3]。COPD發病率和死亡率較高,居全球致死性疾病第四位[4-5],預計到2020年,其將上升至第三位[6]。因此,加強對COPD的防治意義重大。
COPD主要是多種細胞因子和炎癥介質(如IL-1、IL-8、TNF-α等)[7-10]以及黏附分子(如CD11b/CD18、β2整合素等)[11-15]共同參與和發展所致。COPD不僅會導致肺部受損及肺功能下降,也常會引起肺外不良反應,尤以營養不良和呼吸肌功能障礙為主。線粒體作為機體活動和代謝所需能量和自由氧主要提供者,在呼吸肌功能障礙中起到至關重要的作用[16]。那么營養不良是否會導致機體所需能量不足,從而加重COPD病情,目前尚無相關研究。本文旨在探討不同營養狀況COPD患者呼吸肌線粒體功能,以期為COPD防治提供指導。
資料與方法
一、研究對象
于2016年1月至2016年12月收治于成都軍區總醫院呼吸科及胸外科且符合入選條件的COPD患者20例。其中低BMI COPD(BMI<18.5)患者10例,年齡46~84歲,平均年齡(58.4±14.8)歲;正常BMI COPD患者10例(18.5 診斷標準參照慢性阻塞性肺疾病全球倡議(global initiative for obstructive lung disease, GOLD)頒布的《慢性阻塞性肺疾病診治指南(2016修訂)》和中華醫學會呼吸病學會慢性阻塞性肺疾病學組織的《慢性阻塞性肺疾病診治指南(2013修訂)》:對患者進行詳細的病史采集,包括癥狀、接觸史及既往史和系統回顧,癥狀包括慢性咳嗽、咳痰和氣短,既往史和系統回顧包括童年期有無變態反應性疾病、感染及其他呼吸道疾病史,接觸史包括吸煙史、職業環境等,并根據上述資料綜合分析確定;COPD確診的金標準:肺功能檢查,吸入支氣管擴張劑后,FEV1/FVC%<70%,可以確定患者存在持續氣流受限。 1. 納入標準: ①符合上述診斷標準者;②年齡40~85歲者;③無肺心病者;④患者完全知情且能積極配合本實驗者。 2. 排除標準: ①伴有支氣管哮喘或其他呼吸系統疾病患者;②伴有冠狀動脈疾病;③伴有慢性代謝性、腎、心臟疾病或神經肌肉疾病;④近3個月內有全身類固醇治療史,或影響肌肉結構和功能的藥物;⑤近1月有呼吸道感染史;⑥胸廓畸形。 1. 三組患者基本情況評估 (1)肺功能檢查: 所有患者均接受常規肺功能檢測,測定用力肺活量、肺活量、第1 s用力呼氣容積(FEV1)、1秒率、彌散功能等。 (2)血氣分析: 血氣分析血樣從患者橈動脈抽取2 ml,應用血氣分析儀測定患者血氣指標(pH、PaO2、PaCO2)。 2. 肋間外肌基本情況評估: 患者全麻后,行胸腔鏡術或開胸手術,取第4肋間的肋間外肌組織,分成四份。精密稱取1 g組織用于測定IL-6、IL-8和TNF-α表達水平;選取2 mm×2 mm×2 mm組織置于10%甲醛固定,行光鏡檢測肋間外肌形態;稱取1 g新鮮肋間外肌提取線粒體,測定線粒體蛋白含量、呼吸鏈Ⅰ-Ⅳ和超氧化物歧化酶SOD活性、線粒體膜通透性轉換孔(MPTP)動力學;選取1×1×1毫米組織置于3%戊二醛4 ℃保存,送四川大學電鏡室檢測肋間外肌線粒體形態。 3. IL-6、IL-8和TNF-α的測定: 將選取的肋間外肌組織剪碎、沖洗、研碎,反復凍融裂解組織細胞,5 000×g離心5 min,取上清,-20 ℃保存,應用IL-6、IL-8和TNF-α試劑盒,按實驗步驟測定。 4. 肋間外肌形態學觀察: 將選取的肋間外肌組,投入10%福爾馬林中凝固24 h,按照脫水透明、浸蠟、包埋、切片、展片與貼片、脫蠟與復水、染色、水洗、分化、漂洗、封片與觀察等步驟觀肋間外肌形態學。 5. 肋間外肌線粒體功能評估: 應用組織活性線粒體分離試劑盒提取線粒體,應用純化線粒體蛋白質濃度定量試劑盒測定蛋白濃度,應用線粒體復合酶Ⅰ-Ⅳ和超氧化物歧化酶SOD活性的測定試劑盒測定,應用線粒體通透性轉換孔(MPTP)動力學測定 6. 肋間外肌線粒體結構的觀察: 將選取作電鏡觀察的肋間外肌組織標本,按照固定、脫水、包埋、固定、切片、染色、透射電鏡觀察,拍片等步驟進行肋間外肌線粒體結構的觀察。 1. 三組患者基本情況比較: 三組患者的例數、性別、年齡和吸煙指數臨床資料相比,差異無統計學意義(P>0.05);低BMI COPD組的BMI指數值顯著低于正常BMI COPD組和非COPD對照組(P<0.05),而正常BMI COPD組與非COPD對照組無顯著性差異(P>0.05),見表1。 表1 三組患者基本情況比較 注:aP<0.05,與非COPD對照組相比;bP<0.05,與正常BMI COPD組相比 2. 肺功能評估結果: 三組患者肺功能參數測定結果,見表2。與非COPD對照組相比,COPD患者的肺功能參數值均明顯降低(P<0.05);低BMICOPD組和正常BMI COPD組患者的FVC(%)和VC(%)無顯著性差異(P>0.05),而FEV1(%)、FEV1/預測值、FEV1/FVC和DLco顯著低于正常BMI COPD組(P<0.05)。 3. 血氣分析結果: 三組COPD患者血氣分析結果,見表3。血液pH指標結果顯示:正常BMI COPD組與非COPD對照組無顯著性差異(t=3.464,P=0.074),而低BMI COPD組顯著低于正常BMI COPD組和非COPD對照組(t=8.660,P=0.013 &t=12.124,P=0.007);PaO2測定結果顯示:COPD患者組顯著低于非COPD對照組(P<0.05),低BMI COPD組顯著低于正常BMI COPD組(t=17.321,P=0.003);PaCO2測定結果顯示:正常BMI COPD組與非COPD對照組差異無統計學意義(t=2.784,P=0.108),低BMI COPD組顯著高于正常BMI COPD組和非COPD對照組(t=6.447,P=0.023 &t=4.409,P=0.048)。 表3 三組血氣分析測定值對比±s) 注:aP<0.05,與非COPD對照組比較;bP<0.05,與正常BMI COPD組比較;cP<0.05,vs. 非COPD對照組相比 1. 肋間外肌IL-6、IL-8和TNF-α濃度對比: 三組患者肋間外肌IL-6、IL-8和TNF-α濃度測定結果,見表4。COPD患者組的IL-6、IL-8和TNF-α表達水平顯著高于非COPD對照組(P<0.05),低BMI COPD組的IL-6、IL-8和TNF-α表達水平顯著高于正常BMI COPD組(t=4.869,P=0.040 &t=7.491,P=0.017 &t=11.525,P=0.007)。 2. 肋間外肌形態學觀察: 三組受試者肋間外肌光鏡圖,見圖1。非COPD對照患者肋間外肌肌細胞規則排列,肌橫紋清晰,細胞核分布于細胞邊緣,呈扁橢圓形,間質細胞較少,胞質染色均勻,見圖1a。正常BMI COPD患者肋間外肌肌細胞排列規則,肌橫紋略微模糊,細胞質染色略微不均,間質細胞較正常人多,見圖1b。低BMI COPD患者肋間外肌肌纖維間距增寬,呈不規則凹陷、分葉狀,并可見玻璃樣變性;間質細胞增多,局部肌橫紋可見模糊,胞質染色不均,偶有細顆粒狀、不規則空泡及旋渦狀,見圖1c。 表4 三組患者肋間外肌IL-6、IL-8和TNF-α濃度測定值±s) 注:aP<0.05,與正常組相比;bP<0.05,與正常BMI組相比;cP<0.05,vs. 非COPD對照組相比 1. 肋間外肌線粒體蛋白含量: 三組受試者肋間外機線粒體蛋白含量測定結果顯示, 低BMI COPD組為0.63±0.06 μg/ml, 正常BMI COPD組為1.21±0.07 μg/ml, 非COPD對照組為1.58±0.05 μg/ml。對照組肋間外肌線粒體蛋白含量顯著高于COPD患者組(P<0.05),而正常BMI COPD組線粒體蛋白含量顯著高于低BMI COPD組(t=11.162,P=0.008)。 表2 三組患者肺功能參數比較±s) 注:aP<0.05,與非COPD對照組相比;bP<0.05,與正常BMI COPD組相比;cP<0.05,vs. 非COPD對照組相比 2. 肋間外肌線粒體復合物Ⅰ-Ⅳ和超氧化物歧化酶SOD活性的測定: 三組患者肋間外肌線粒體復合酶活性測定結果,見表5。與對照組相比,正常BMI COPD組的線粒體復合酶Ⅰ、Ⅱ、Ⅲ、Ⅳ和SOD活性均顯著低于對照組(t=13.891,P=0.005 &t=16.338,P=0.004 &t=9.370,P=0.011 &t=22.200,P=0.002 &t=12.124,P=0.007);低BMI COPD組線粒體復合酶Ⅰ、Ⅱ、Ⅲ、Ⅳ和SOD均顯著低于正常BMI COPD組(t=24.305,P=0.002 &t=16.788,P=0.004 &t=8.730,P=0.013 &t=13.863,P=0.005 &t=9.418,P=0.011)。 表5 三組肋間外肌線粒體復合酶活性測定結果±s) 注:aP<0.05,與非COPD對照組相比;bP<0.05,與正常BMI COPD組相比;cP<0.05,vs. 非COPD對照組相比 3. 線粒體膜通道孔(MPTP)動力學測定: 非COPD對照組患者MPTP隨著時間的進展,其吸光度值降低較少,而COPD患者組的MPTP減少較多,其中低BMI COPD患者MPTP降低最顯著(P<0.05),見圖2。 圖2 三組患者線粒膜通道孔吸光度比值比較 4. 肋間外肌線粒體形態學觀察: 三組受試者肋間外肌線粒體電鏡觀察如圖3所示。非COPD對照患者肋間外肌線粒體形狀規則,外膜完整,嵴清晰可見,脂質空泡少見,未見膠原增生,圖3a。正常BMI COPD組患者肋間外肌線粒體偶見基質密度下降、腫脹,嵴減少,外膜局部模糊、破損,脂質空泡及膠原未見明顯增加,個別細胞現髓樣變,圖3b。低BMI COPD組患者肋間外肌線粒體數目略微增加,并呈簇狀分布,部分線粒體可見腫脹,嵴變形,部分溶解,基質空泡化,偶見髓樣變、膠原增多及脂質空泡增多現象,圖3c。 1. FEV1與炎性指標的Pearson相關性分析: 將三組患者的FEV1與炎性指標(IL-6、IL-8和TNF-α)相關性分析,得患者FEV1與IL-6、IL-8和TNF-α呈負相關,見表6。 表6 FEV1與炎性指標的相關性 2. FEV1與線粒體指標的Pearson相關性分析: 將三組患者FEV1與線粒體指標進行相關性分析,得到患者FEV1與線粒體呼吸鏈復合酶Ⅰ、Ⅱ、Ⅲ、Ⅳ和SOD呈正相關,見表7。 表7 FEV1與線粒體指標的相關性 近年來的研究發現,COPD病變的主要是以中性粒細胞、淋巴細胞和肺泡巨噬細胞浸潤為主的小氣道炎癥[17-18],在吸煙、感染和吸入污染的空氣等的刺激下,氣道上皮受損,支氣管上皮細胞一方面分泌抗氧化和抗蛋白酶因子的功能下降[19],另一方面IL-1、IL-8和TNF-α等多種細胞因子和炎性介質的釋放增加,介導刺激信號傳導至細支氣管,使肺泡中性粒細胞和巨噬細胞活化,并趨化于支氣管,而活化的中性粒細胞進一步釋放IL-8,導致炎癥信號逐級放大[7-8],引起多種炎癥因子的釋放(如IL-6、IL-8和TNF-α等),介導單核細胞趨化至肺,合成并釋放急性期反應蛋白,如CRP、TNF-α等,引起COPD的發生和發展[20]。 COPD在導致患者肺部受損、肺功能下降的同時,也可導致肺外不良反應[21],如營養不良、肌肉萎縮、心血管疾病等[22]。其中呼吸肌功能障礙是近年來的研究熱點。骨骼肌功能紊亂(skeletal muscle dysfunction, SMD)是COPD患者常見的肺外不良反應[23],導致COPD患者的運動受限[24-25]。研究表明,全身炎癥、氧化應激以及細胞缺氧等多種因素都會引起肢體肌肉異常[26-28],部分COPD患者常常出現肌肉損失,嚴重影響患者的生命健康及預后。營養不良導致患者呼吸肌結構和功能受損,呼吸肌疲勞,限制肺通氣功能,引起患者進行性肌肉組織減少、呼吸肌萎縮。研究顯示,COPD患者外周骨骼肌Ⅱ型纖維比例的增加和Ⅰ型纖維損害呈正相關[29]。近年來研究顯示,多種細胞因子,如IL-6、IL-8和TNF-α等,對機體能量和物質代謝產生影響,引起COPD患者營養不良及呼吸肌功能紊亂[30-31]。Nguyen等[30]研究發現,營養不良COPD穩定期患者血清中及外周血單核細胞中TNF-α濃度均顯著高于正常患者,TNF-α系統的激活與COPD營養不良存在密切聯系。當機體受到炎癥刺激時,IL-6濃度顯著增高,損傷內皮血管,促進免疫黏附及微血管形成,抑制內皮修復,使血管受損加劇,肺功能惡化[32-33]。本研究發現,COPD患者組的IL-6、IL-8和TNF-α表達水平顯著高于非COPD對照組,低BMI COPD組的IL-6、IL-8和TNF-α表達水平顯著高于正常BMI COPD組。 光鏡觀察三組患者肋間外肌形態,發現正常人肋間外肌肌細胞規則排列,肌橫紋清晰,細胞核分布于細胞邊緣,呈扁橢圓形,間質細胞較少,胞質染色均勻;正常BMI患者肋間外肌肌細胞排列規則,肌橫紋略微模糊,細胞質染色略微不均,間質細胞較正常人多;低BMI患者肋間外肌肌纖維間距增寬,呈不規則凹陷、分葉狀,并可見玻璃樣變性;間質細胞增多,局部肌橫紋可見模糊,胞質染色不均,偶有細顆粒狀、不規則空泡及旋渦狀。上述結果說明COPD患者由于氣道受限,導致機體缺氧,導致COPD患者的呼吸肌細胞形態發生不同程度變化,且低BMI COPD組的變化較明顯。 肌肉的運動離不開線粒體源源不斷地合成ATP。線粒體最主要的功能是氧化各種底物,使儲存在其化學鍵中的能量進入ATP,提供機體活動和代謝所需的能量。COPD患者因為氣道呼吸受阻,導致機體缺血、缺氧,可能會影響線粒體功能的發揮[34]。Sauleda等[35]研究報道了線粒體電子傳遞鏈的末端酶-細胞色素氧化酶(COX)的活性在COPD患者骨骼肌中表達上調,與動脈低氧血癥呈正比。Gosker等[36]研究發現COPD患者骨骼肌中,促進質子泄露的蛋白通道,解偶聯蛋白3(在ATP合成、能量耗散等中具有氧化磷酸化脫離功能)的表達降低。Ribera等[35]研究顯示,在一些嚴重肺氣腫患者分離得到的呼吸肌纖維中,線粒體電子傳輸增加,線粒體功能發生改變。本研究發現,低BMI COPD組和正常BMI COPD組患者肋間外肌線粒體蛋白含量、線粒體復合酶Ⅰ-Ⅳ的活性、超氧化物歧化酶SOD活性、MPTP動力學均顯著低于非COPD對照組,而低BMI COPD組患者的線粒體蛋白含量、線粒體復合酶Ⅰ-Ⅳ及超氧化物歧化酶SOD的活性、MPTP動力學顯著低于正常BMI COPD組,說明COPD患者肋間外肌線粒體功能受到一定程度的影響,營養不良患者線粒體功能出現障礙較嚴重。肋間外肌線粒體形態學觀察顯示:正常受試者肋間外肌線粒體性狀規則,外膜完整,嵴清晰可見,脂質空泡少見,未見膠原增生。正常BMI COPD組患者肋間外肌線粒體偶見基質密度下降、腫脹,嵴減少,外膜局部模糊、破損,脂質空泡及膠原未見明顯增加,個別細胞線粒出現髓樣變。低BMI COPD組患者肋間外肌線粒體數目略微增加,并呈簇狀分布,部分線粒體可見腫脹,嵴變形,部分溶解,基質空殼,偶見髓樣變、膠原增多及脂質空泡增多現象。上述研究顯示,與非COPD對照組相比,COPD患者的呼吸肌線粒體功能受到一定程度影響,且營養不良COPD患者呼吸肌線粒體功能受到的影響較嚴重。 由于呼吸肌功能與呼吸肌線粒體功能往往存在一定的關系,但本實驗在研究BMI對肋間外肌線粒體功能的影響時,沒有對呼吸肌功能進行深入研究,所以在后續研究中應對呼吸肌功能進行充分研究,探討其在不同BMI的COPD患者中的不同,才能更好地為臨床COPD的防治提供依據。二、診斷標準
三、納入排除標準
四、臨床方法
五、統計學方法
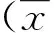
結 果
一、患者病情評估結果

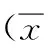
二、肋間外肌基本情況評估
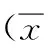

三、肋間外肌線粒體功能評估
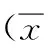
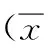


四、相關性分析


討 論

