VEGFR-2對膨體聚四氟乙烯重建肺動脈人造血管新內膜形成的影響
洪文娟 陳滿軍 鮑亞男 趙子聰 洪志鵬
中央型肺癌是發生在主支氣管至段支氣管的惡性腫瘤,對于腫瘤侵犯肺血管的T4中央型肺癌患者,肺動脈重建是根治中央型肺癌手術成功的關鍵因素,否則不得不進行全肺切除。如何最大限度的切除病灶和保留肺功能,尤其是對合并有慢性阻塞性肺疾病(chronic obstructive pulmonary, COPD)的患者,是臨床工作中制定診療方案時必須慎重考慮的重要問題[1-6]。
業已證明,血管內皮生長因子(vascular endothelial growth factor, VEGF)激活血管內皮生長因子受體-2(vascular endothelial growth factor receptor-2, VEGFR-2),可促進血管內皮細胞(ECs)的有絲分裂和遷移。VEGFR-2與VEGF結合激活了磷脂酶Cγ (phospholipase Cγ, PLCγ)及磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase, PI3K), PLCγ再激活PKC-Raf-MEK-MAPK,PI3K激活絲氨酸/蘇氨酸蛋白激酶,介導血管ECs生存[7-10]。然而,有關人造血管移植的基礎研究主要集中于體循環,在肺循環中幾乎尚屬空白。本研究通過動物實驗,利用膨體聚四氟乙烯(expanded polytetrafluoroethylene, e-PTFE) 人造血管重建肺動脈,觀察在肺循環與體循環中的人造血管新內膜形成過程中VEGFR-2蛋白表達水平的變化,旨在進一步明確人造血管移植肺動脈后VEGFR-2蛋白對重構內膜的影響,為e-PTFE人造血管重建肺動脈的臨床應用提供相關實驗資料和理論依據。
材料和方法
一、試劑和動物
健康滇南小耳豬(實驗動物許可證號:SYXK(滇)2011-0004)18只,體重在25~35 kg,雌雄不拘,由昆明醫科大學實驗動物中心提供、飼養。飼養條件:室溫(21±5)℃,空氣濕度50%~60%,光照隨晝夜自然變化,自由進水。實驗過程符合規定(中華人民共和國科技部,關于善待實驗動物的指導意見,2006-9-30)。
主要設備和材料有:TKR-200C動物呼吸機(江西特力),e-PTFE人造血管(Gore-Tex),多功能電子監護儀(深圳邁瑞生物),靜脈微量泵(深圳圣諾醫療)和標準胸外科手術包。
主要試劑有VEGFR-2抗體(Santa Cruz Biotechnology),辣根過氧化物酶標記通用型二抗 (Abmart)等,其它試劑均為進口或國產分析純。
二、實驗動物分組
18只實驗動物,采用隨機數字表,按1︰1比例隨機分為實驗組和對照組,實驗組為肺動脈置換組, e-PTFE人造血管重建肺動脈,n=9;對照組為下腔靜脈置換組,e-PTFE人造血管重建下腔靜脈組,n=9。
三、人造血管重建肺動脈和下腔靜脈動物模型建立
實驗組肺動脈人造血管移植動物模型建立的方法:選擇耳緣靜脈,用3%戊巴比妥誘導麻醉,0.5 ml/kg。10%丙泊酚靜脈維持麻醉, 4~12 mg·kg-1·h-1。備皮、碘伏常規消毒鋪巾。頸部前正中線切開皮膚和皮下組織。分離氣管前組織,第2~4氣管環處氣管切開,插入氣管插管,連接動物呼吸機,潮氣量6~10 ml/kg,容量控制模式。
左側第3肋間開胸,充分暴露并仔細游離解剖左肺動脈干。靜脈給予肝素0.5 mg/kg,阻斷后切除3.0 cm肺動脈。用長3.0 cm,直徑2.0 cm的e-PTFE人造血管重建肺動脈, 4-0血管縫線,先吻合近心端,然后進行肺動脈遠心端吻合,在最后一針前,開放近端阻斷鉗,排除管腔殘余氣體,再開放遠端肺動脈阻斷鉗,完成肺動脈重建。檢查肺動脈搏動是否良好,檢查吻合口及針孔是否漏血。若有漏血,加壓難以消除,局部縫合加固。第5肋間放置胸腔閉式引流管,關胸,術畢。在34 ℃環境下復蘇,待動物有自主呼吸拔除氣管插管,縫合氣管插管切口。
對照組下腔靜脈人造血管置換動物模型建立的方法:麻醉和手術前準備工作、氣管切開插管、麻醉方法的具體操作步驟與實驗組相同。 取右胸第4肋間后外側切口,打開胸腔,仔細游離解剖下腔靜脈,肝素化,阻斷下腔靜脈,切除3.0 cm。e-PTFE人造血管重建下腔靜脈,見圖1~3。

圖1 氣管切開插管麻醉;圖2 Gore-Tex人造血管重建肺動脈;圖3 Gore-Tex人造血管重建下腔靜脈
動物術后護理,常規飼養,手術切口每日換藥敷以碘伏紗布。左氧氟沙星0.2 g,口服,Bid,連續兩日。仔細觀察手術切口是否有紅腫、周圍皮膚溫度、手術傷口是否有滲血、滲液、流膿等,10 d拆線。
四、觀察指標及方法
建立動物模型前超聲心動圖監測心功能,檢查肺動脈、腔靜脈和胸主動脈狀態。術后2周、3、6個月時間點, 取出人造血管。將其制成石蠟切片,計算機圖象分析系統對HE切片和IHC切片觀察細胞形態與VEGFR-2表達。
病理切片的制備:經二甲苯脫蠟,浸入100%、95%、85%、70%酒精脫水,蘇木素染色,在碳酸鋰飽和水溶液中藍化,伊紅染液染色,依次70%、85%、95%、100%酒精脫水, 2次二甲苯透明,中性樹膠封片,光鏡下觀察。
免疫組織化學(immunohistochemical, IHC):沖洗多聚甲醛固定好的組織24 h,除去多余的固定液,乙醇逐級脫水, 二甲苯透明, 58~60 ℃石蠟包埋, 連續切片;5 μm厚切片常規脫蠟水化,PBS漂洗5 min×3次,加入含TritonX-100 PBS(pH7.4)溶液的5%驢血清封閉,滴加VEGFR-2抗體,4 ℃冰箱過夜,0.01 mol/L PBST漂洗5 min×4次,加熒光標記的二抗,避光室溫孵育2 h。PBST漂洗4次,滴加50 μl的抗淬滅封片劑(含DAPI)避光室溫孵育5 min,熒光顯微鏡下觀察結果。
五、統計學方法
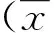
結 果
一、一般情況比較
兩組間體重、胸圍及心臟功能比較差異無統計學意義(P>0.05),具有可比性,見表1。血管超聲肺動脈、腔靜脈和主動脈均未見異常,見圖4。
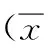
表1 兩組動物一般情況比較±s)
二、人造血管新生內膜病理學觀察
兩組置入的人造血管ECS生長正常,未見胞核異常的細胞生長或有腫瘤細胞生長,未見白細胞、巨噬細胞等炎癥細胞浸潤,見圖5、6。

圖5 光鏡下,肺動脈人造血管內膜(HE×400);圖6 光鏡下,下腔靜脈人造血管內膜(HE×400)
從HE 染色切片中發現,人工血管置換后,分層明顯,人工血管吻合口處均形成了完整的內膜。吻合口內膜表面可見一層內皮細胞覆蓋,覆蓋完全,內皮細胞形態扁平,胞核居中、突出、淡染,核仁大而明顯。內膜下可見平滑肌細胞和纖維膠原組織,亦可見有少量的炎性細胞。并見吻合口內膜較厚,中段內膜最薄。實驗組重新構建的內膜結構緊湊,而對照組較為疏松。

圖4 肺動脈、腔靜脈和主動脈血管超聲
VEGFR-2蛋白表達,IHC看到藍色的為血管ECS細胞核染色,紅色為目標蛋白VEGFR-2,染色在細胞核表面。VEGFR-2在肺動脈組人造血管內膜和下腔靜脈組人造血管內膜中均有表達,在細胞膜和胞質內均可看到紅色熒光,但以細胞膜表達為主。在2周時,肺動脈組人造血管內膜和下腔靜脈組的細胞核表面檢測到較強的熒光信號,而且肺動脈的表達較下腔靜脈強,陽性表達染色面積更大。隨時間推移在3個月和6個月時,兩組的VEGFR-2表達均有明顯的減少,見圖7、8。
討 論
在非小細胞肺癌的TNM分期中,T4指腫瘤大于7 cm,或者侵犯縱膈、膈肌、心臟、大血管、喉返神經、隆突、氣管、食管和脊柱,或者同側不同肺葉的腫瘤結節[2]。針對腫瘤侵犯肺動脈,本研究通過動物實驗,研究e-PTFE人造血管重建肺動脈后的變化。結果表明:肺動脈置入的e-PTFE人造血管與下腔靜脈均形成了新的血管內膜,覆蓋人造血管腔,人造血管新生內膜對保證重建血管的通暢至關重要。肺動脈組人造血管內膜VEGFR-2蛋白表達陽性細胞面積和信號強度大于下腔靜脈組,說明血流動力學可以影響VEGFR-2表達水平,進而影響血管ECS的生長。
Read等[11]在1993年首次報道了1例中央型肺癌患者使用e-PTFE人造血管重建肺動脈治療取得成功。Yoshida等[12]在2014年報道2例,也是迄今國外文獻對該手術治療中央型肺癌僅有的3例報道[13]。2013年Berthet等[14]報道了使用同種異體血管置換肺動脈使得手術后患者并發癥減少,然而同種異體血管的來源少以及術后發生的排異反應等問題限制了該手術的應用。聯合人造血管移植重建肺動脈根治中央型肺癌手術使部分中央型肺癌患者免于全肺切除,其最大的優點在于保留了有功能的健康肺葉,不僅使那些肺功能差的患者可以耐受手術,而且使這些患者獲得了與全肺切除相同的徹底性根治,比全肺切除有更好的生活質量,甚至遠期生存。特別是為高齡、心肺功能低下的患者提供了一個更安全、有效的手術治療機會。
VEGF是具有促血管內皮細胞有絲分裂活性的糖基化多肽分泌因子,作為特異性的血管ECS分裂素,能夠刺激體外培養的血管ECS發生有絲分裂和遷移,作用于體內血管ECS,引起內皮細胞分裂增殖,誘導血管形成,是目前已知的作用最強的促血管生成因子[15]。1983年Senger等[16]首次在腫瘤組織發現了VEGF蛋白,目前已經發現了7種VEGF,分別是VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E(Orf 病毒產生)、VEGF-F(從蛇毒中分離出來)和胎盤生長因子(placental growth factor, PIGF)[17]。VEGF有三種跨膜受體VEGFR-1(Flt-1)、VEGFR-2(在人體稱為KDR,小鼠稱為Flt-1)、VEGFR-3(Flt-1-4)。VEGFR-1主要表達在造血干細胞、單核細胞、巨噬細胞上,VEGFR-2是一種跨膜的酪氨酸激酶受體,主要表達在血管內皮細胞膜表面,腫瘤細胞也表達這兩種受體,VEGFR-3主要表達在淋巴內皮細胞[18-19]。

圖7 肺動脈組人造血管內膜VEGFR-2表達,見DAPI所染的內皮細胞核呈橢圓形、多邊形的藍色區域(黃色箭頭),594染色的紅色區域為目標蛋白VEGFR-2(白色箭頭),×400

圖8 下腔靜脈組人造血管內膜VEGFR-2表達,黃色箭頭為細胞核,紅色箭頭為目標蛋白VEGFR-2,×400
本研究光鏡下見:①肺動脈組人造血管新生內膜結構連接緊密,下腔靜脈組連接較為疏松,可能與不同流場或血管床的剪切力不同有關。剪切力(shear stress)是血流與血管摩擦產生的平行于管壁的切線應力。正常生理條件下,靜脈系統的血流剪切力范圍是0.76~7.6 dynes/cm2,動脈系統剪切力范圍是11.4~60.8 dynes/cm2[20];②肺動脈組和下腔靜脈組ECs形態正常。血管ECS是襯貼在心血管內腔面的單層鱗狀細胞,厚約0.1~1 μm,大小為(10~50 μm)×(25~40 μm),人體全身血管內皮細胞約有1×1012個,血管ECS的腔側面主要是支撐結構,有指狀、片狀或圓柱狀的胞質突起。血管ECS有錨狀纖維,使內皮細胞與其下的基底膜緊密相連。
本文采用熒光免疫檢測VEGFR-2的表達情況,觀察不同剪切力作用下血管ECs的VEGFR-2水平。結果發現在術后各個時間點,肺動脈中置入人造血管ECsVEGFR-2表達水平上調較下腔靜脈實驗組高,表明在高剪切力作用下,血管ECSVEGF高;低剪切力作下血管ECsVEGF低。本研究結果與Dela等[21]結果相一致,VEGF-A和VEGFR-2在動脈剪切力下表達水平增高,而對VEGF-C 、VEGF-D表達無影響。可見剪切力能夠影響VEGFR-2的表達, VEGFR-2水平的上調使得VEGF的作用增強,可促進ECs的增殖和人造血管新內膜的形成。
通過本實驗分析,我們認為e-PTFE人造血管植入不同的血管床在重新構建新內膜的過程中,由于所處環境生物力學和生物化學的差異,而影響了人造血管新內膜的生長和VEGFR-2的表達,或許對人造血管的遠期通暢率也會造成一定的影響,值得深入研究。

