姜多糖提取方法工藝優化及分析
廖登未 黃德春 程抒劼 曹崇江 陳貴堂
(中國藥科大學工學院,江蘇 南京 211198)
姜(ZingiberofficinaleRosc)又稱百辣云、鮮生姜、姜根等,屬姜科植物,主要分布于中國四川、貴州、福建、湖北和兩廣等地[1]。現代工藝研究發現,姜具有抗腫瘤[2-3]、抗氧化[4-5]和抗炎止痛[6]等藥理作用。此外,姜中富含多糖類物質,且姜多糖具有抗氧化[7]、消炎抑菌[8]和抗疲勞[9]等生物活性。
在多糖的提取研究中,目前多采用熱水浸提法、超聲波提取法、酶提取法和微波提取等[10]方法。研究表明,即使同種原料,采用不同提取方法所得的多糖,其結構、性質、單糖成分以及生物活性均有不同。比如,Zhang等[11]在生姜多糖的研究中,采用了酸式、中性以及堿式水提法,發現3種不同的提取方法得到的生姜多糖具有不同的抗氧化活性;韓冬屏等[12]研究顯示超聲波輔助提取法所得姜多糖得率和DPPH·的清除能力均優于微波輔助提取和傳統熱水提取法的;在生姜粗、精多糖抗氧化試驗中,王蕓等[13]采用了水提法、超聲輔助酶解法以及酶解法,得出生姜粗多糖的還原能力大小關系為:超聲輔助酶解法>酶解法>水提法,而精多糖僅對DPPH·具有顯著影響。
透射電鏡具有分辨率高、放大倍數高、信息立體化等優勢,近年來備受科研工作者的青睞。在不同方法提取姜多糖研究中,目前尚未有文獻報道利用透射電鏡觀察姜渣細胞破損情況,分析影響姜多糖得率的試驗研究。因此,本研究擬采用熱水浸提法、超聲波冰浴提取法、復合酶提取法3種方法對姜多糖進行分離提取,利用透射電鏡和紫外-可見光分光光度計對姜渣和姜多糖進行掃描分析,對比不同提取方法對姜多糖提取效果的影響,擬為進一步深入研究不同方法所得姜多糖的結構、物化特性以及生物學活性提供試驗基礎。
1 材料與方法
1.1 材料與儀器
干姜片:產自云南,亳州市常富藥業有限公司,采用50 ℃ 減壓干燥,粉碎過篩60目備用;
纖維素酶(1 800 U/mg)、果膠酶(1 000 U/mg):上海金穗生物科技有限公司;
木瓜蛋白酶:3 U/mg,阿拉丁試劑(上海)有限公司;
其它試劑均為國產分析純試劑;
搖擺式高速中藥粉碎機:DFY-500型,溫嶺市林大機械有限公司;
紫外—可見分光光度計:TU-1901型,北京普析通用儀器有限責任公司;
離心機:LXJ-IIB型,上海安亭科學儀器廠;
超聲波細胞粉碎機:JY-92IIN型,寧波新芝生物科技股份有限公司;
真空冷凍干燥機:PD-1C-50型,北京博醫康實驗儀器有限公司;
分析天平:ATX224型,日本島津儀器公司;
旋轉蒸發器:RE-5205型,上海亞榮生化儀器廠;
透射電鏡:HT7700型,日本日立公司。
1.2 試驗方法
1.2.1 提取工藝流程
姜粉→提取(熱水浸提、超聲波冰浴提取、復合酶酶解)→離心(4 000 r/min,20 min)→過濾,取濾液,50 ℃旋蒸至原濾液1/4→sevag試劑(正丁醇與氯仿體積比4∶1)除蛋白→加入4倍體積無水乙醇靜置→離心(4 000 r/min,10 min),得沉淀→丙酮、無水乙醇、乙醚各洗滌2次→減壓干燥,40 ℃→多糖成品
1.2.2 熱水浸提法
(1) 單因素試驗:探究熱水浸提時間、溫度、液料比對姜多糖提取率的影響。固定提取時間2 h,提取溫度70 ℃,設置液料比分別為10∶1,15∶1,20∶1,25∶1,30∶1,35∶1(mL/g);固定提取時間2 h,液料比20∶1 (mL/g),設置提取溫度分別為50,60,70,80,90,100 ℃;固定提取溫度90 ℃,液料比20∶1 (mL/g),設置提取時間分別為1,2,3,4,5,6 h。
(2) 正交試驗設計:在單因素試驗的基礎上,以多糖提取率為考察對象,采用正交試驗分析,優化姜多糖最優提取工藝參數。
1.2.3 超聲波冰浴提取法
(1) 單因素試驗:探究超聲時間、功率、液料比對姜多糖提取率的影響。固定液料比20∶1 (mL/g),超聲功率200 W,設定超聲時間分別為20,25,30,35,40,45 min;固定液料比20∶1 (mL/g),超聲時間35 min,設定超聲功率分別為100,200,300,400,500,600 W;固定超聲時間35 min,超聲功率500 W,設定液料比分別為10∶1,15∶1,20∶1,25∶1,30∶1,35∶1 (mL/g)。
(2) 正交試驗設計:在單因素試驗的基礎上,以多糖提取率為檢測指標,采用正交試驗分析,優化姜多糖最優提取工藝參數。
1.2.4 復合酶解法
(1) 單因素試驗:在纖維素酶用量63 000 U/g·底物,果膠酶用量20 000 U/g·底物,木瓜蛋白酶用量62.5 U/g·底物條件下,探究酶解條件對姜多糖提取效果的影響。固定酶解時間2 h,酶解溫度50 ℃,pH 5.0,設定液料比分別為15∶1,20∶1,25∶1,30∶1,35∶1,40∶1 (mL/g);在酶解時間2 h,酶解溫度50 ℃,液料比25∶1 (mL/g)條件下,設定pH分別為3.0,4.0,5.0,6.0,7.0,8.0;固定酶解時間2 h,液料比25∶1 (mL/g),pH 6.0,設定酶解溫度分別為30,40,50,60,70,80 ℃;固定液料比25∶1 (mL/g),pH 6.0,酶解溫度50 ℃,設定酶解時間分別為1.0,1.5,2.0,2.5,3.0,3.5 h。
(2) 正交試驗設計:在單因素試驗的基礎上,以多糖提取率為考察對象,采用正交試驗分析,優化姜多糖最優提取工藝參數。
1.2.5 多糖及蛋白含量測定 根據文獻[14],采用苯酚-硫酸法測定多糖含量,考馬斯亮藍法測定蛋白含量,并對計算方法進行如下修改:
(1) 多糖提取率:按式(1)計算。
(1)
式中:
R1——多糖提取率,%;
c1——提取液中多糖濃度,g/mL;
V——提取液體積,mL;
m——原料質量,g。
(2) 多糖得率:按式(2)計算。
(2)
式中:
R2——多糖得率,%;
m1——多糖成品質量,g;
m——原料質量,g。
(3) 蛋白含量:按式(3)計算。
(3)
式中:
R3——蛋白含量,%;
c2——提取液中蛋白濃度,g/mL;
V——提取液體積,mL;
m——原料質量,g。
1.2.6 多糖紫外光譜掃描 將樣品配成1.0 mg/mL的多糖溶液,在波長200~360 nm內進行光譜掃描,檢測260,280 nm 處是否有核酸和蛋白質的特征吸收峰[13]。
1.2.7 姜渣透射電鏡觀察 收集經3種不同方法提取后的姜提取殘渣,凍干,精確稱量10.0 mg凍干粉和100 mL無水乙醇均勻混合。選用300目的高質量銅網,用鑷子小心取出銅網,將膜面朝上,并輕放于濾紙上,用移液槍取20 μL待測液滴于銅網上,待其自然風干。采用透射電鏡,在100 kV加速電壓,線分辨率0.14 nm條件下觀察細胞壁破碎情況。
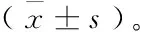
2 結果與分析
2.1 熱水浸提法
2.1.1 熱水浸提法正交試驗因素水平設計 考察液料比、提取溫度、提取時間對姜多糖提取的影響,根據單因素試驗結果,建立三因素三水平正交試驗因素水平,見表1。
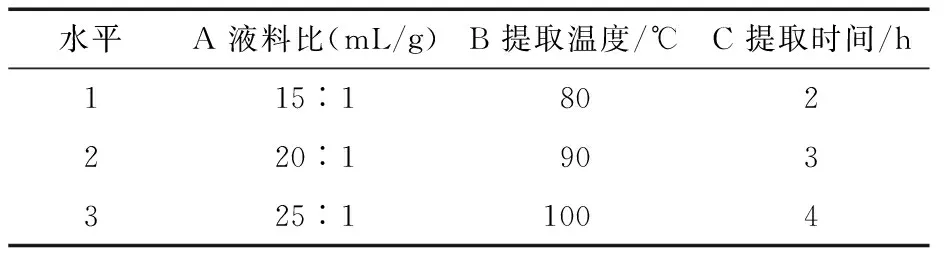
表1 熱水浸提法正交試驗因素設計水平表Table 1 Hot water extraction orthogonal test factor design levelTable
2.1.2 正交試驗結果及方差分析 熱水浸提法提取姜多糖的正交試驗結果見表2。通過分析可知,影響姜多糖提取率主次因素依次為B>A>C,最優水平組合為A2B3C3,即液料比20∶1 (mL/g),提取溫度100 ℃,提取時間4 h。由表3可知,液料比、溫度、時間均對姜多糖的提取有顯著性影響(P<0.05),且溫度具有極顯著性影響(P<0.01),3個因素影響大小順序與正交試驗結果相符。在最優試驗條件下進行3組平行實驗驗證,姜多糖的提取率為(11.74±0.23)%,高于正交試驗中9個試驗組,可見,該正交試驗結果可靠。
表2熱水浸提法提取姜多糖正交試驗結果分析
Table 2 Orthogonal experimental results analysis ofZingiberofficinaleRosc polysaccharides extraction with hot water extraction (n=3)
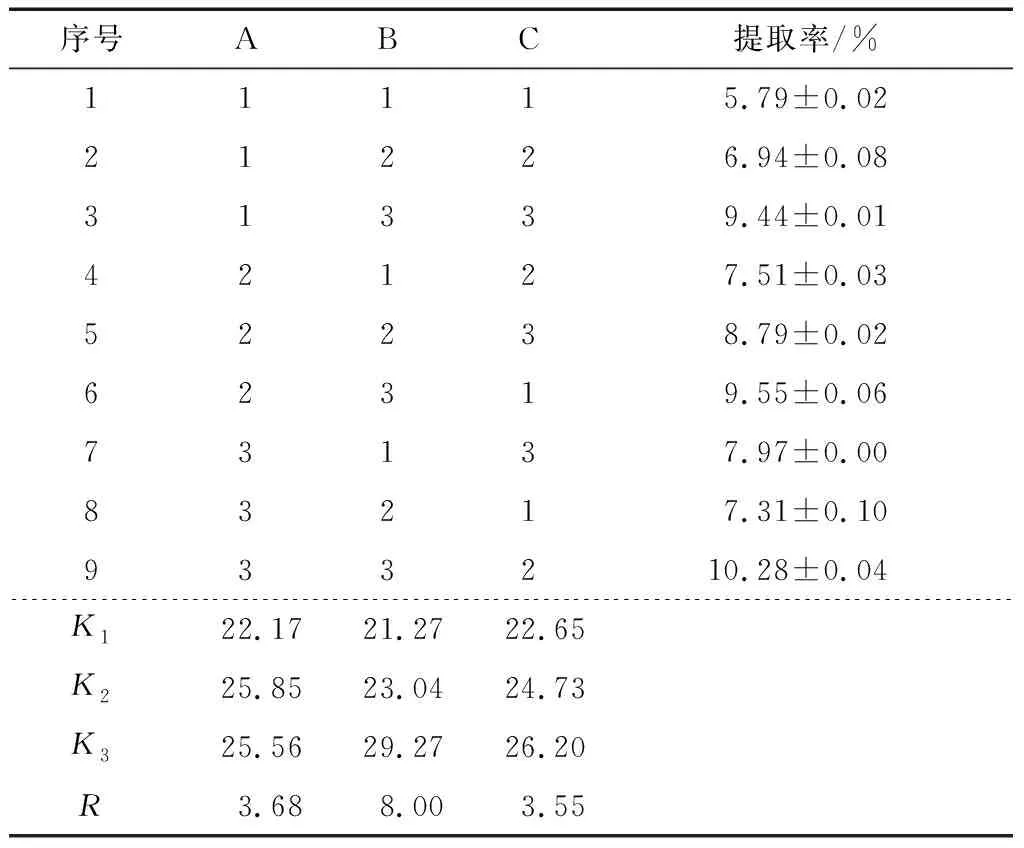
序號ABC提取率/%11115.79±0.0221226.94±0.0831339.44±0.0142127.51±0.0352238.79±0.0262319.55±0.0673137.97±0.0083217.31±0.10933210.28±0.04K122.1721.2722.65K 225.8523.0424.73K 325.5629.2726.20R3.688.003.55
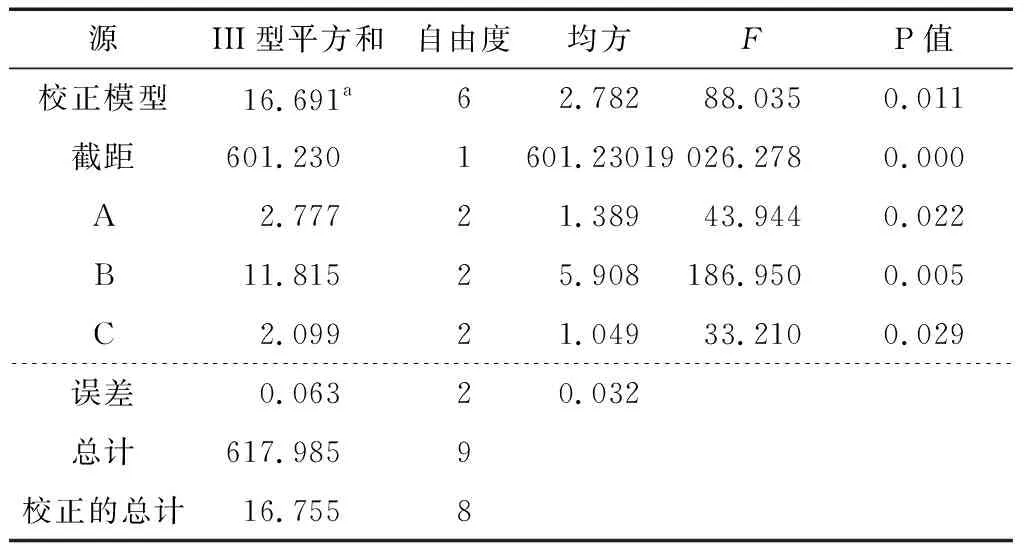
表3 熱水浸提法正交試驗方差分析表?Table 3 Analysis of variance of orthogonal test for hot water extraction
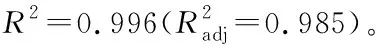
2.2 超聲波冰浴提取法
2.2.1 超聲波冰浴提取法正交試驗因素水平設計 考察超聲時間、超聲功率和液料比對姜多糖提取的影響,根據單因素試驗結果,建立三因素三水平正交試驗因素水平,見表4。
表4超聲波冰浴提取法正交試驗因素設計水平表
Table 4 Ultrasonic ice bath extraction orthogonal test factor design level
Table
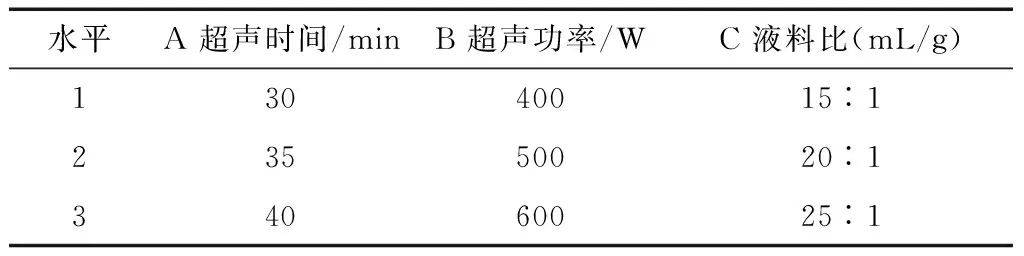
水平A 超聲時間/minB 超聲功率/WC 液料比(mL/g)13040015︰123550020︰134060025︰1
2.2.2 正交試驗結果及方差分析 超聲波冰浴提取法提取姜多糖的正交試驗結果見表5。通過分析可知,影響超聲提取姜多糖的工藝順序:C>B>A,且最佳提取工藝條件為A1B2C3,即超聲時間30 min、超聲功率500 W、液料比25∶1 (mL/g)。由表6可知,超聲時間,超聲功率以及液料比均對姜多糖的提取有顯著性影響(P<0.05),且3個因素影響大小順序與正交試驗結果相符。對最優試驗條件進行3組平行實驗驗證,此時姜多糖的提取率為(7.00±0.04)%,高于正交試驗中9個試驗組,表明正交試驗方案設計穩定。
2.3 復合酶提取法
2.3.1 復合酶酶解條件正交試驗因素水平設計 考察液料比、pH值、酶解溫度和酶解時間對姜多糖提取的影響,根據單因素試驗結果,建立四因素三水平正交試驗因素水平,見表7。
2.3.2 正交試驗結果及方差分析 由表8可知,影響復合酶提取姜多糖的工藝順序為C>B>A>D,且最優提取工藝為A1B2C2D3,即液料比25∶1 (mL/g)、酶解時間2.0 h、酶解溫度40 ℃和pH值7.0。由表9可知,溫度、時間、液料比和pH值均對多糖提取率有極顯著性影響(P<0.01)。在最優工藝條件下進行3組平行實驗進行驗證,提取液中姜多糖的提取率為(20.93±0.20)%,結果遠高于9個正交試驗組結果,可見該正交試驗結果可靠。
2.4 多糖得率、純度及蛋白質含量
3種方法提取姜多糖的多糖得率、純度及蛋白質含量見表10。由表10可知,復合酶解法得到的姜多糖得率遠高于熱水浸提法和超聲波冰浴提取法的;而在純度方面,熱水浸提法相對優于超聲波冰浴提取法和復合酶解法。
2.5 多糖紫外光譜掃描
對3種不同提取方法得到的姜多糖進行紫外光譜掃描,如圖1所示,采用Sevag法除蛋白后,姜多糖溶液在260,280 nm 處均未出現明顯的特征吸收峰,從而進一步證明sevag法能有效去除姜多糖中的蛋白。
表5超聲波冰浴提取法提取姜多糖正交試驗設計與結果分析
Table 5 Ultrasonic ice bath extraction extraction ofZingiberofficinaleRosc polysaccharides orthogonal test design and results analysis (n=3)
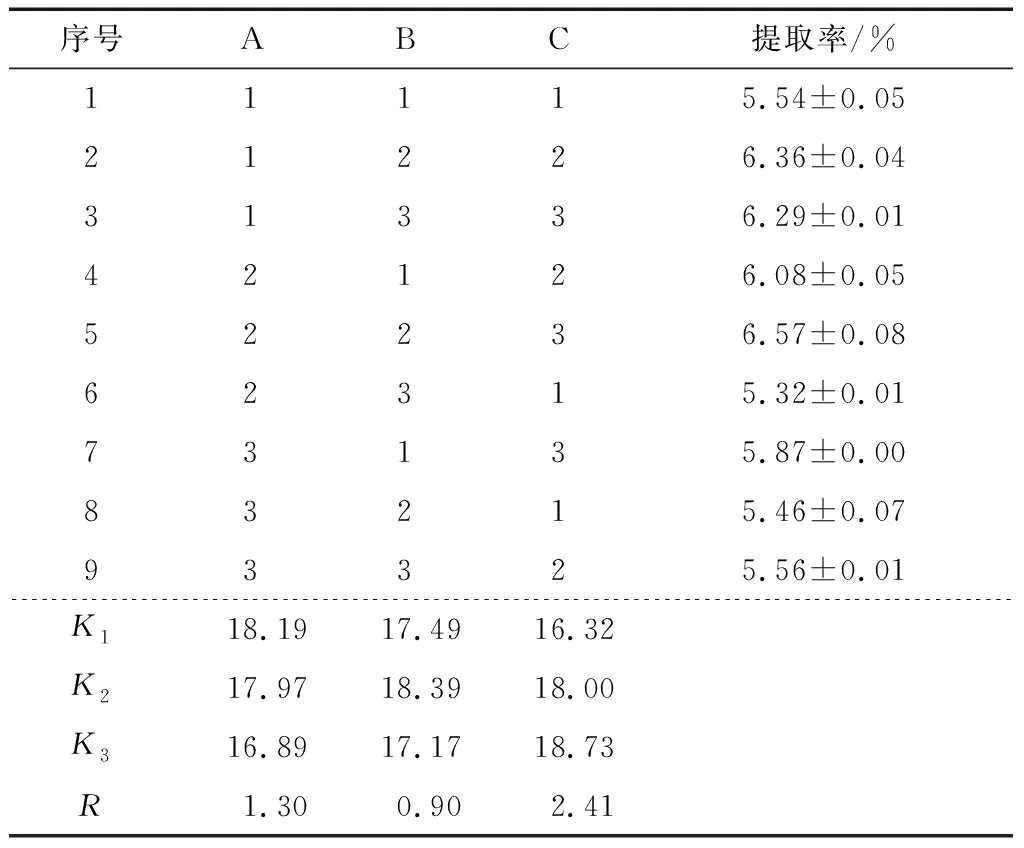
序號ABC提取率/%11115.54±0.0521226.36±0.0431336.29±0.0142126.08±0.0552236.57±0.0862315.32±0.0173135.87±0.0083215.46±0.0793325.56±0.01K 118.1917.4916.32K 217.9718.3918.00K 316.8917.1718.73R1.300.902.41
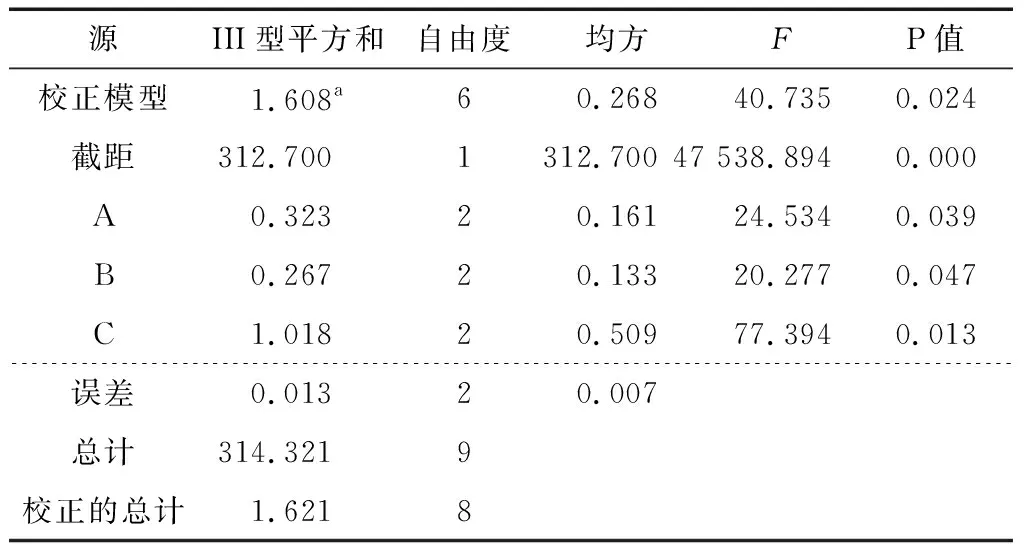
表6 超聲波冰浴提取法正交試驗方差分析表?Table 6 Ultrasonic ice bath extraction orthogonal test analysis of varianceTable
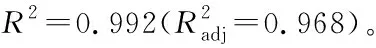
表7復合酶酶條件正交試驗因素設計水平表
Table 7 Multi-enzymatic enzyme conditions orthogonal test factor design level
Table
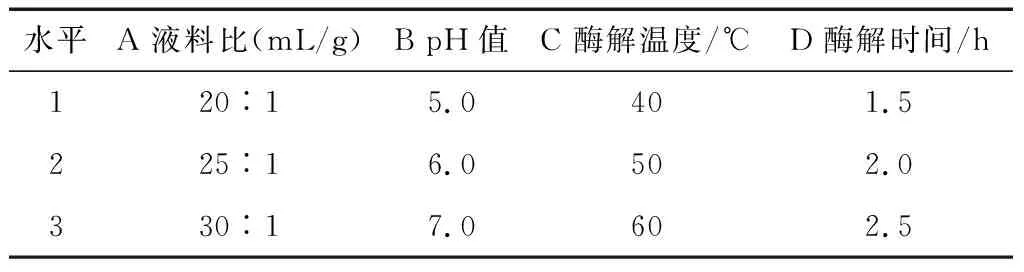
水平A 液料比(mL/g)B pH值C 酶解溫度/℃D 酶解時間/h120︰15.0401.5225︰16.0502.0330︰17.0602.5
2.6 透射電鏡掃描
對比分析不同方法提取多糖剩余姜渣的透射電鏡圖(圖2)可知,結合姜渣透射電鏡圖,發現經過熱水浸提后,姜細胞出現了較明顯的破損,有利于姜多糖溶出;復合酶解在破壞細胞壁結構后,改變了細胞通透性,使得細胞中其他水溶性物質和多糖一同溶出,從而降低了多糖純度;超聲波提取的原理是利用超聲空化,使多糖更易溶于溶劑,而試驗中利用超聲波提取的姜多糖得率和純度較另2種方法低,其原因主要是采用了冰浴提取法,降低了超聲波對細胞的破壞,且低溫不利于姜多糖溶出[15],其他水溶性物質,如姜酚等在低溫環境中溶解度高于多糖[16],而低溫能減少多糖生物活性損失。
表8復合酶酶解提取姜多糖正交試驗設計與結果分析
Table 8 Orthogonal experimental design and results analysis of extractingZingiberofficinaleRosc polysaccharides by complex enzymatic hydrolysis (n=3)
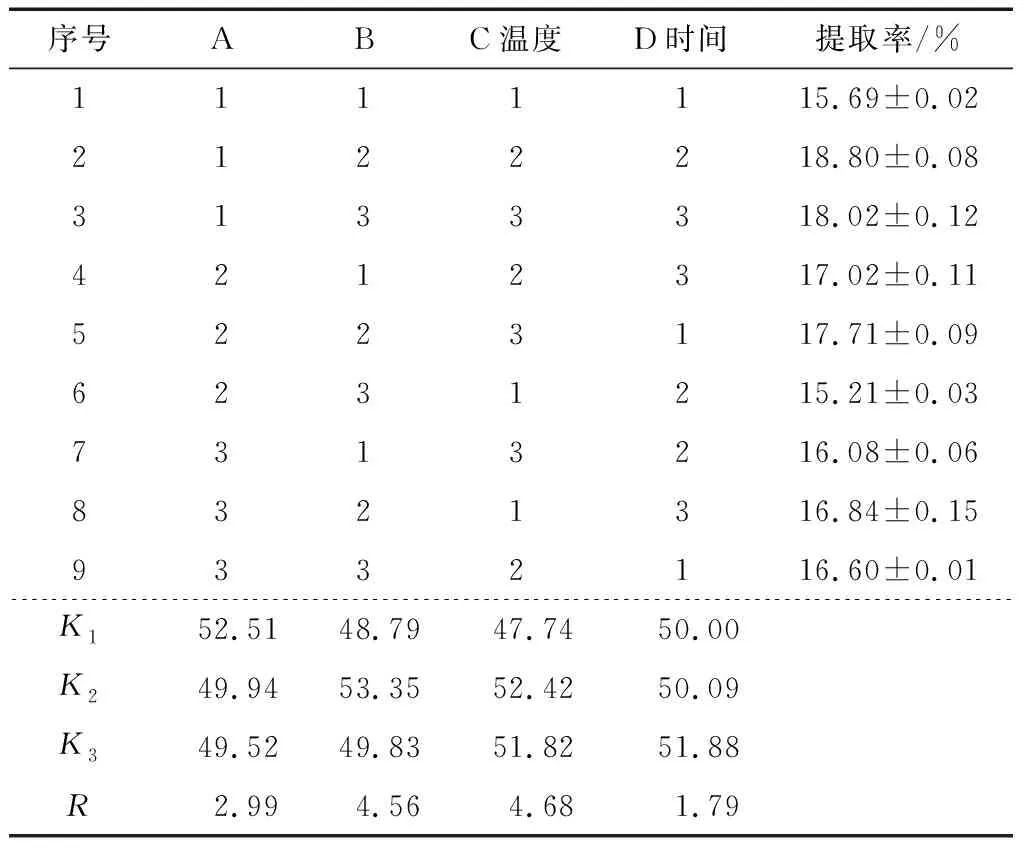
序號ABC溫度D時間提取率/%1111115.69±0.022122218.80±0.083133318.02±0.124212317.02±0.115223117.71±0.096231215.21±0.037313216.08±0.068321316.84±0.159332116.60±0.01K152.5148.7947.7450.00K249.9453.3552.4250.09K349.5249.8351.8251.88R2.994.564.681.79
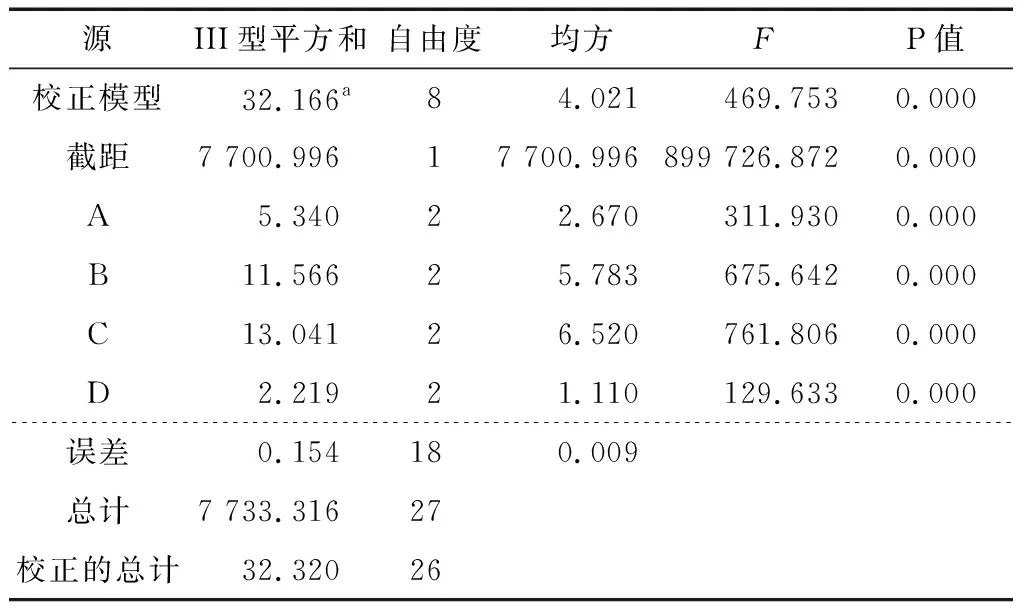
表9 復合酶酶解法正交試驗方差分析表?Table 9 Complex enzymatic method orthogonal test variance analysisTable
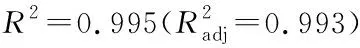
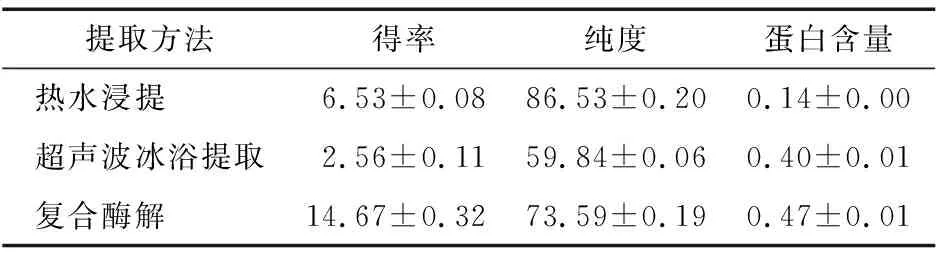
表10 多糖得率、純度及蛋白質含量Table 10 Polysaccharides yield, purity and protein content (n=3) %
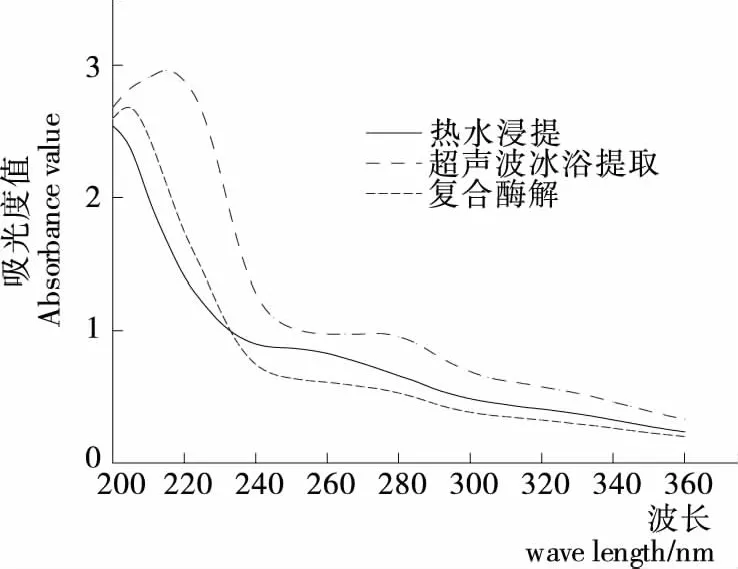
圖1 多糖紫外光譜掃描結果Figure 1 UV spectral scanning results of polysaccharides
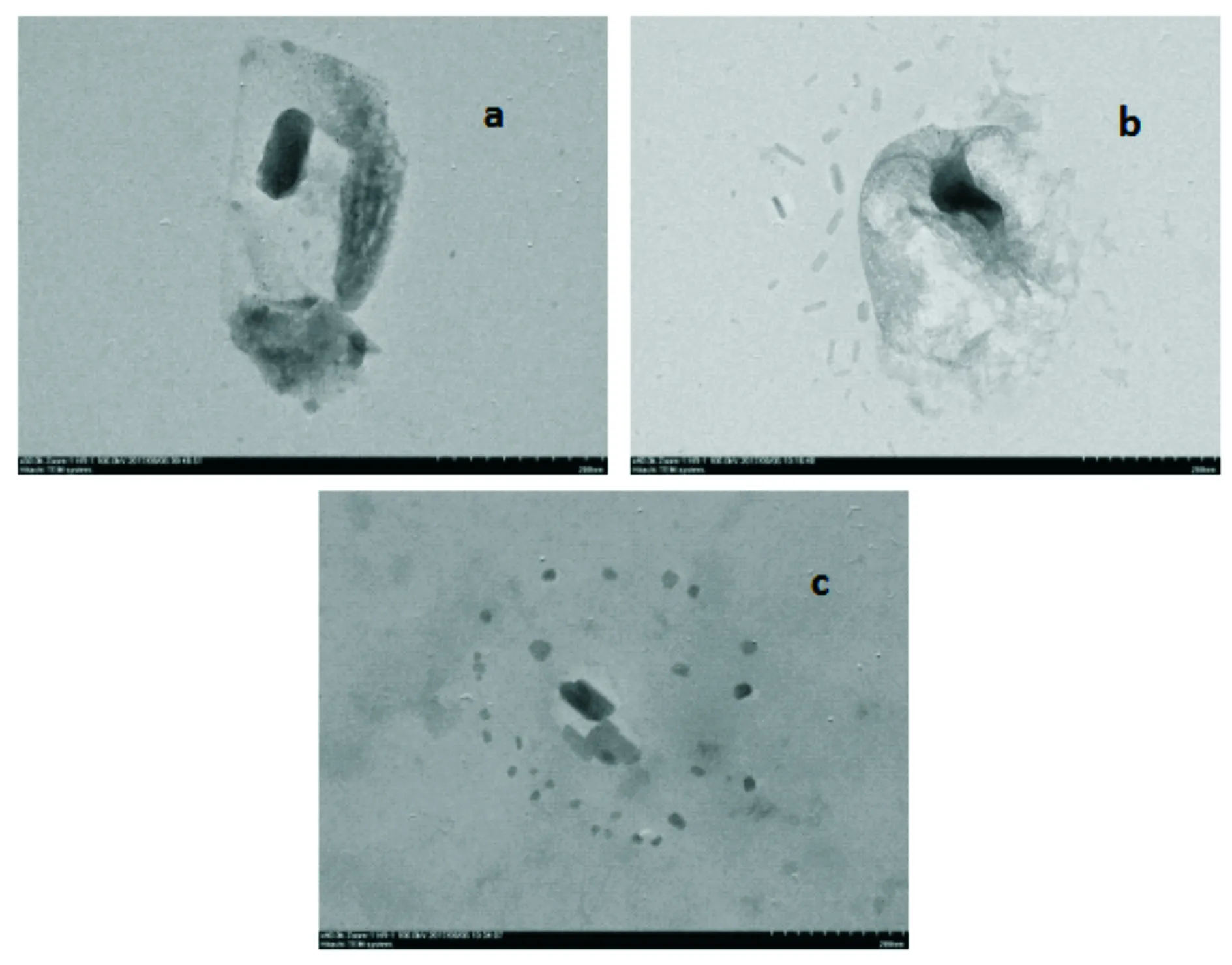
圖2 不同方法提取多糖剩余姜渣透射電鏡掃描結果圖
Figure 2 TEM scanning results of residualZingiberofficinaleRosc residue extracted by different methods
3 結論
本試驗利用透射電鏡掃描姜渣,試驗結果表明,不同提取方法對姜細胞的破壞有明顯的差異性,從而造成多糖的溶出不同。對比分析3種不同工藝提取的姜多糖,得出復合酶解法姜多糖得率最高,為(14.67±0.32)%;而在多糖純度方面,熱水浸提法相對另外2種提取方法更好,可達(86.53±0.20)%。經過sevag法除蛋白后,3種姜多糖中蛋白含量均低于0.5%,遠低于文獻[12]報道。
本試驗中采用超聲波冰浴提取法,姜多糖得率較低,且雜質較多。近年來超聲波與酶解法協同提取法[17]得到廣泛關注,后續可利用超聲波-酶解協同提取姜多糖,同時對比分析2種提取方法在得率、純度以及生物活性等方面的差異。

