神經干細胞旁分泌對神經系統保護作用的研究進展
葉松慶,李永全
(天津市泰達醫院,天津300457)
隨著社會發展和人口老齡化進程加快,各種神經系統疾病,如神經損傷性疾病、神經退行性疾病等成為困擾人類健康的重要問題。由于神經元具有不可再生性,神經系統疾病的治療難度大,患者多有嚴重后遺癥。神經干細胞是一類具有自我更新、多向分化潛能的干細胞,能夠分化為神經元、星形膠質細胞和少突膠質細胞[1]。神經干細胞作為一種種子細胞,在神經干細胞移植中能替代損失的神經細胞,支持損傷神經物理結構,減少炎癥反應,以及分泌神經營養因子等[2,3],目前已用于脊髓損傷、腦損傷、帕金森病等神經損傷或神經退行性疾病的治療。但移植細胞本身對損失神經組織細胞的替代作用非常有限。神經干細胞本身可通過旁分泌機制調控微環境,對干細胞自身特性的維持以及定向分化具有重要作用[4];在病理狀態下,神經干細胞可通過旁分泌進行細胞間應答[5]。因此認為,神經干細胞移植的治療效果可能主要歸因于神經干細胞的旁觀者效應。本文結合文獻就神經干細胞的旁分泌類型、作用機制以及在不同疾病模型中的治療效果作一綜述。
1 神經干細胞概述
1.1 神經干細胞來源 在胚胎發育時期,神經干細胞存在于大部分腦區,而成體神經干細胞僅存在于腦內固定區域。1992年首次從大鼠腦組織紋狀體中分離出神經干細胞[6],之后腦室周、齒狀回、海馬等部位神經干細胞陸續被鑒定和分離出來[7]。目前認為,成年哺乳動物神經干細胞所在區域為腦室下區和海馬齒狀回顆粒下層[8]。之后,人們又陸續從脊髓、嗅球等組織分離出神經干細胞[9,10],并形成了標準化分離、培養體系,大大加速了神經干細胞的基礎研究和臨床轉化應用。
1.2 神經干細胞的特性 神經干細胞的生物學特性具有以下幾點:①來源于中樞神經系統,具有多向分化潛能,可分化為神經組織細胞;②通過對稱分裂產生的兩個子細胞均為干細胞,而通過不對稱分裂產生的兩個子細胞,一個為干細胞,另一個為祖細胞,從而具有自我維持和自我更新能力;③具有區域異質性,如嗅球中間神經元和胼胝體的少突膠質細胞來源于室管膜下區的神經干細胞;齒狀回神經元和星形膠質細胞來源于齒狀回顆粒細胞下層的神經干細胞。
1.3 神經干細胞的旁分泌功能 細胞之間的信號傳遞是調節細胞功能的重要方式,包括內分泌、自分泌和旁分泌,其中旁分泌是調節微環境穩態和應答外界不良刺激的重要機制。就神經干細胞而言,其旁分泌方式可歸納為兩類:一類包括生長因子、細胞因子、趨化因子、生物活性脂類以及細胞外基質等旁分泌因子,一類是細胞外囊泡,其中以外泌體最具代表性。見圖1。
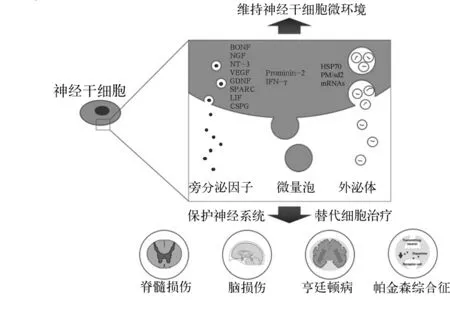
圖1 神經干細胞旁分泌示意圖
2 神經干細胞旁分泌對神經系統的保護作用
神經干細胞移植治療神經系統疾病的機制為移植細胞本身對損失神經組織細胞的替代作用和移植細胞旁分泌所產生的旁觀者效應[11]。神經干細胞移植后能夠在組織內存活,并在一定條件下分化為神經細胞,與原有組織形成生理性細胞間聯系,繼而重建神經傳導通路[12]。然而移植細胞面臨的往往是一個病理性微環境,結合移植本身帶來的二次損傷,易導致移植細胞壞死和凋亡。神經干細胞在自然分化狀態下很難滿足特定的細胞種類,不能分化為理想的細胞種類。因此,移植細胞本身對損失神經組織細胞的替代作用非常有限。目前認為,神經干細胞移植的治療效果可能主要歸因于神經干細胞的旁觀者效應。神經干細胞的旁觀者效應是指神經干細胞旁分泌產物作用于移植部位對微環境所產生的優化,包括減輕微環境中負性調控因子和增加內源性修復能力。研究證實,脊髓損傷后神經干細胞移植能促進軸索再生,增加髓鞘化,并促進血管再生以及減少膠質瘢痕形成[13]。在卒中模型中發現,移植的神經干細胞即使未分化,仍能促進神經功能恢復[14]。在肌肉萎縮性側索硬化癥模型中,移植的神經干細胞能夠分泌神經營養因子,促進運動神經元存活和再生[15]。提示這些過程同樣依賴于神經干細胞的旁觀者效應而非替代作用。
2.1 旁分泌因子對神經系統的保護作用
2.1.1 保護神經元 ①減少神經元凋亡。有研究發現,神經干細胞條件培養基在體外能夠增加M2型巨噬細胞比例,并減少M1型巨噬細胞活化和炎性細胞因子釋放,脊髓損傷小鼠給予神經干細胞條件培養基,能促進脊髓功能恢復[16]。持續給予脊髓損傷大鼠神經干細胞條件培養基還能增加皮質脊髓束和中間神經元之間的橋接,減少神經元凋亡,促進大鼠運動功能恢復[17]。另外,在亨廷頓病大鼠模型中,神經干細胞分泌的干細胞因子能夠保護多巴胺能神經元,減少神經元凋亡[18]。②分泌神經元保護因子。Lee等[19]研究發現,神經干細胞條件培養基較普通培養基能夠更好地發揮神經保護作用,其保護作用歸因于神經干細胞旁分泌的S-medium、神經生長因子(NGF)、神經膠質細胞源性營養因子(GDNF)、血管內皮生長因子(VEGF)等神經營養因子。有研究證實,神經干細胞移植后,以腦源性神經營養因子(BDNF)為代表的多種神經營養因子在損傷部位表達持續升高[20];神經干細胞C17.2能夠持續分泌神經營養因子,包括BDNF、NGF、GDNF,并且高表達NT3的神經干細胞還能顯著增加NGF、BDNF表達[21];人源性神經干細胞能夠分泌BDNF,而且移植神經干細胞分泌的BDNF能夠促進紋狀體神經元存活[18]。
2.1.2 神經重塑 研究發現,神經干細胞移植能夠增加中風患者腦組織VEGF、血小板反應蛋白1/2以及富含半胱氨酸的酸性蛋白表達,而這些因子是促進樹突生長、軸索可塑性和軸索運輸的關鍵[14]。Chen等[22]通過對比神經干細胞條件培養基和普通培養基中32種細胞因子和趨化因子發現,以白血病抑制因子(LIF)為代表的29種分泌因子均表達升高;神經干細胞分泌的LIF不僅能上調靶細胞LIF受體,還通過JAK-STAT信號通路促進靶細胞增殖和存活[22]。有學者通過質譜分析方法從神經干細胞形成的神經球條件培養基中鑒定出了磷酸酶蛋白聚糖、載脂蛋白E以及血清胱抑素C,其中磷酸酶蛋白聚糖是一種重要的硫酸軟骨素蛋白聚糖,能夠促進神經球形成,穩定神經球三維結構并促進神經干細胞本身存活,其作用主要通過EGFR、JAK/STAT3及PI3K/Akt信號通路實現[23]。
2.1.3 抗氧化應激 神經干細胞的旁分泌受細胞本身狀態和微環境影響,一些不良刺激能夠引起細胞激活并促進細胞生長。目前已知的一些刺激因素,如細胞激活、低氧或輻射、氧化應激等,均可導致細胞旁分泌增加[24]。因此,神經干細胞所處的特殊缺氧微環境可能決定其旁分泌產物具有增加細胞缺氧以及不良環境的耐受能力。研究證實,神經干細胞條件培養基具有天然抗N-甲基-D-天冬氨酸導致的神經興奮性毒性作用[25];使用3-硝基丙酸預處理神經干細胞能增加其抗氧化應激能力,這一效應是通過增加神經干細胞BDNF、CNTF以及VEGF分泌實現的,最終使神經元上調超氧化物歧化酶2實現抗凋亡和抗氧化應激作用[26]。
2.1.4 免疫調理 研究證實,神經干細胞移植能夠在脊髓損傷中發揮免疫調理作用,不僅能減少脊髓損傷后M1型巨噬細胞產生,還能增加M2型巨噬細胞產生,而M2型巨噬細胞能夠吞噬細胞崩解產物并分泌抗炎因子,起到抑制炎癥反應的作用[27]。此外,神經干細胞大量分泌的神經營養因子亦能減輕炎癥反應[28]。在多發性硬化模型中,移植的神經干細胞不僅能減少T淋巴細胞增殖,還能通過分泌FasL、Trail、Apo3L等因子促進浸潤的T淋巴細胞凋亡[29]。在中風模型中,移植的神經干細胞也能通過旁分泌作用阻止外周巨噬細胞激活和動員[30]。
2.2 旁分泌細胞外囊泡對神經系統的保護作用 近年來,旁分泌細胞外囊泡獲得了廣泛關注。根據細胞外囊泡形成機制可分為微囊泡、外泌體以及凋亡小體[31]。在疾病治療中具有潛力的主要是微囊泡和外泌體。微囊泡是由細胞質膜直接外翻形成的,粒徑較大(100~1 000 nm),甚至可以包裹轉運多核糖體[32]。外泌體是由多泡體與質膜結合釋放的腔內囊泡,粒徑較小(50~120 nm),可包裹大量蛋白質、mRNA以及miRNA,其在細胞間信號轉導中具有重要作用,已成為當前研究的熱點。
2.2.1 外泌體來源蛋白 Kang等[33]通過串聯質譜方法對人類神經干細胞來源外泌體進行蛋白測定,鑒定出了103種蛋白,包括HSP70、轉鐵蛋白受體、多肌炎/硬皮病自身抗原2等,其中HSP70被認為是多種神經系統疾病的保護劑,包括顱腦損傷、化學毒性神經損傷以及阿爾茨海默癥,其機制可能是通過抑制氧化應激而發揮保護作用的。在免疫調節方面,神經干細胞的細胞外囊泡內蛋白質和核酸分選與炎癥細胞因子誘導后干擾素γ信號通路激活有關;使用干擾素γ和腫瘤壞死因子α模擬神經炎癥微環境,可使神經干細胞的細胞外囊泡分選包裝神經保護蛋白,進而影響微環境中的T淋巴細胞、巨噬細胞、小膠質細胞以及樹突細胞等免疫細胞,從而改善微環境,實現神經保護作用[34]。
2.2.2 外泌體來源miRNA Stevanato等[35]采用第二代測序技術對神經干細胞外泌體內的miRNA進行鑒定,發現了113種miRNA;該研究還發現,在miRNA包裹過程中存在明顯的分選機制。目前已知多種miRNA對神經損傷和神經退行性疾病具有修復和治療作用,如miR-132、miR-21等,神經干細胞在炎癥等應激刺激下可通過獨特的分選機制包裹保護性的miRNA,進而將這些miRNA直接轉運至靶細胞,在靶細胞內表觀遺傳學水平調控細胞行為,發揮神經保護作用。
綜上所述,神經干細胞能夠通過旁分泌分泌多種因子及細胞外囊泡,對神經系統起到神經再生、再髓鞘化、免疫調理及神經重塑等作用。目前對神經干細胞的旁分泌機制尚不完全清楚。今后研究的重點是進一步優化神經干細胞旁分泌的神經保護作用,包括使用缺氧或輻射等理化手段刺激產生數量更多的旁分泌產物以及使用基因轉染技術產生更多具有治療潛力的因子或mRNA、miRNA等。神經干細胞的旁觀者效應是神經損傷修復的重要機制,其旁分泌產物對神經系統疾病治療潛力巨大,有可能成為替代神經干細胞移植的治療手段。

