EPO對全身炎癥反應(yīng)綜合征大鼠急性肺損傷的治療作用及機制
黃承,肖雪
(1 恩施州中心醫(yī)院,湖北恩施445000;2 遵義醫(yī)學(xué)院附屬醫(yī)院)
全身炎癥反應(yīng)綜合征(SIRS)是由感染或損傷引起的一種臨床綜合征,全身性炎癥介質(zhì)釋放、細(xì)胞通路激活等導(dǎo)致的細(xì)胞凋亡是其主要的促發(fā)因素[1]。急性肺損傷是SIRS患者最早出現(xiàn)和致死率最高的并發(fā)癥[2]。促紅細(xì)胞生成素(EPO)在多種哺乳動物中具有相同的序列和活性,是一種分子量為30.4 kDa,含165個氨基酸的糖蛋白[3]。EPO是第一個被發(fā)現(xiàn)具有造血作用的體液因子,在選擇性EPO缺乏性疾病中,可用于外源性替代治療[4]。研究發(fā)現(xiàn),EPO具有細(xì)胞保護(hù)作用,可發(fā)揮抗凋亡、抗炎和免疫調(diào)節(jié)功能[5,6]。2015年2月~2017年1月,本研究觀察了EPO對SIRS大鼠急性肺損傷的治療作用,現(xiàn)分析結(jié)果并探討其作用機制。
1 材料與方法
1.1 材料 健康成年雄性SD大鼠24只,體質(zhì)量180~200 g,購自第三軍醫(yī)大學(xué)大坪醫(yī)院,動物許可證號:SCXK(渝)2012-0005。飼養(yǎng)環(huán)境:溫度18~28 ℃、相對濕度40%~70%,光照12 h明暗交替;含蛋白質(zhì)21%的飼料飼養(yǎng),自由飲水。脂多糖(LPS),北京索萊寶科技有限公司;重組人EPO(rhEPO),哈藥集團股份有限公司。ELISA試劑盒,武漢伊萊瑞特生物科技股份有限公司。
1.2 SIRS急性肺損傷模型制作及干預(yù) 所有大鼠分籠飼養(yǎng)2周,隨機分為對照組、模型組、EPO組,每組8只。模型組及治療組采用LPS二次打擊法制作SIRS急性肺損傷模型:5%水合氯醛0.6 mL/100 g腹腔注射麻醉,麻醉完全后將大鼠仰臥位固定于鼠板上;鉗夾雙側(cè)股骨中段致閉合性骨折,6 h后舌下靜脈注射LPS 5 mg/kg。治療組注射LPS后立即尾靜脈一次性注射rhEPO 1 000 IU/kg,模型組和對照組尾靜脈注射等量生理鹽水。
1.3 相關(guān)指標(biāo)觀察 各組均于造模結(jié)束8 h麻醉,分離頸動脈,用無菌肝素化注射器抽取血液樣本;放血法處死,無菌條件下取雙側(cè)肺組織。①一般情況:觀察造模結(jié)束8 h內(nèi)精神狀態(tài)、反應(yīng)、活動等一般情況。②血氣分析:采用ABL80血氣分析儀檢測動脈血PaO2、PaCO2、HCO3-、pH。③血清高遷移率族蛋白B1(HMGB1)、Bcl-2:采用ELISA法測定血清HMGB1、Bcl-2。④肺組織濕干重比值(W/D):用吸水紙吸取左肺上葉表面的水分及血液后稱重(T0),烤干后再次稱重(T1),放入80 ℃電熱鼓風(fēng)干燥箱中烘烤48 h至恒質(zhì)量后再次稱重(T2),計算W/D。W/D=(T1-T0)/(T2-T0)。⑤肺組織病理學(xué)觀察:取右肺上葉,4%多聚甲醛固定,脫水,石蠟包埋,切片,HE染色。光鏡下(×200)觀察肺組織充血、水腫、損傷及炎癥細(xì)胞浸潤情況。
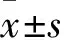
2 結(jié)果
2.1 三組一般情況比較 對照組精神狀態(tài)好、反應(yīng)靈敏、呼吸平穩(wěn)、攻擊性強,無死亡。模型組注射LPS 1~2 h出現(xiàn)呼吸急促,之后逐漸出現(xiàn)精神萎靡、嗜睡,被毛蓬松,寒戰(zhàn),呼吸急促(≥80次/min),口唇紫紺明顯,口、鼻及眼角分泌物增多,血尿,死亡2只。治療組表現(xiàn)與模型組相似,但程度均較模型組減輕,呼吸頻率≤70次/min,無死亡。
2.2 三組血氣分析結(jié)果比較 模型組和治療組PaO2、pH、HCO3-均明顯低于對照組,但治療組均高于模型組,組間比較P<0.05或<0.01。三組間PaCO2比較P>0.05。見表1。
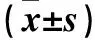
表1 三組血氣分析結(jié)果比較
注:與對照組比較,*P<0.05,△P<0.01;與模型組比較,#P<0.05,●P<0.01。
2.3 三組血清HMGB1、Bcl-2水平比較 模型組和治療組血清HMGB1水平均高于對照組,血清Bcl-2水平均低于對照組;治療組血清HMGB1水平低于模型組,血清Bcl-2水平高于模型組;組間比較P<0.05或<0.01。見表2。
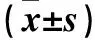
表2 三組血清HMGB1、Bcl-2水平比較
注:與對照組比較,*P<0.01;與模型組比較,#P<0.05。
2.4 三組W/D比較 對照組、模型組、治療組W/D分別為4.48±0.25、6.05±0.64、5.33±0.57,模型組、治療組均高于對照組,但治療組低于模型組,組間比較P均<0.05。
2.5 三組肺組織病理學(xué)變化 對照組:肺泡結(jié)構(gòu)完整,肺泡間隔均勻一致,無炎癥細(xì)胞浸潤,肺泡腔內(nèi)結(jié)構(gòu)清晰,沒有滲液。模型組:肺泡腔內(nèi)廣泛積氣,肺泡結(jié)構(gòu)破壞,肺泡腔內(nèi)中性粒細(xì)胞浸潤,部分可見灶狀泡沫細(xì)胞聚集和不等量的紅細(xì)胞滲出,形成彌漫性肺泡損傷;肺泡壁及肺間質(zhì)毛細(xì)血管擴張充血,中性粒細(xì)胞粘附,部分肺泡壁增厚;肺間質(zhì)及細(xì)支氣管壁見慢性炎性細(xì)胞灶狀浸潤。治療組:肺組織表現(xiàn)與模型組相似,但程度均較模型組減輕;肺泡結(jié)構(gòu)部分破壞,肺泡腔內(nèi)少量積氣,部分肺泡腔內(nèi)見泡沫細(xì)胞及纖維素滲出;肺間質(zhì)小血管及肺泡壁毛細(xì)血管輕度擴張充血,中性粒細(xì)胞粘附;部分肺間質(zhì)及細(xì)支氣管內(nèi)見慢性炎性細(xì)胞浸潤。
3 討論
目前認(rèn)為,“二次打擊”法制作急性肺損傷模型能較好地模擬臨床急性肺損傷的發(fā)病機制,即多發(fā)性骨折或失血作為首次打擊導(dǎo)致機體處于一種全身炎癥反應(yīng)狀態(tài),受到第二次打擊會瞬間放大已經(jīng)存在的炎癥反應(yīng),使機體處于失控性炎癥狀態(tài)即SIRS,引起多器官功能障礙[7]。EPO是具有抗炎、抗凋亡和免疫調(diào)節(jié)等多功能的細(xì)胞保護(hù)因子,能通過抑制體內(nèi)中心粒細(xì)胞氧化爆發(fā)、中性粒細(xì)胞活性和減少炎癥介質(zhì)釋放而發(fā)揮抗炎作用。研究發(fā)現(xiàn),酵母多糖誘導(dǎo)的休克模型大鼠給予rhEPO(1 000 IU/kg)可減少腹膜滲出,改善腎功能,在腸和肺組織中降低髓過氧化物酶水平,降低病死率[8];對創(chuàng)傷性腦損傷誘發(fā)的急性肺損傷模型給予促紅細(xì)胞生成素衍生物干預(yù),能顯著減輕肺損傷的病理學(xué)表現(xiàn),降低肺組織W/D,減少肺組織內(nèi)CD68+巨噬細(xì)胞聚集和TNF-α、IL-6、IL-1β表達(dá)[9];EPO可通過抑制激活PI3K/AKT通路激活及糖原合成酶激酶-3β(GSK-3β)表達(dá)而抑制急性肺損傷的發(fā)生、發(fā)展[10~13]。PI3K可作為效應(yīng)橋梁聯(lián)系細(xì)胞內(nèi)外信號,通過多種途徑作用于其下游信號因子,發(fā)揮調(diào)節(jié)細(xì)胞凋亡的作用。PI3K/AKT通路介導(dǎo)的細(xì)胞凋亡是依靠Caspase-9和Bcl-2發(fā)起和調(diào)節(jié)的[14]。EPO可引起磷酸化作用和激活PI3K通路[15~17]。GSK-3β是AKT的上游因子,可參與糖原合成調(diào)控,促進(jìn)細(xì)胞凋亡,減輕局部和全身炎癥反應(yīng)[18~21]。岳嗣鳳等[22]研究顯示,rhEPO可通過上調(diào)大鼠肺組織中Bcl-2蛋白表達(dá),減輕支氣管發(fā)育不良所致的肺損傷。Rocha等[23]報道,rhEPO對熱損傷誘導(dǎo)的急性肺損傷大鼠有治療作用,其作用機制可能與抑制GSK-3β/AKT通路活性有關(guān)。本研究治療組一般情況、肺組組病理學(xué)表現(xiàn)、血氣分析相關(guān)指標(biāo)等均優(yōu)于模型組,證實EPO可減輕急性肺損傷大鼠肺水腫、改善肺通氣功能及代謝性酸中毒等。
急性肺損傷的主要病變特點為多形核白細(xì)胞正常凋亡途徑發(fā)生障礙,同時肺泡巨噬細(xì)胞(AM)異常凋亡增加,肺泡上皮細(xì)胞過度凋亡等,即急性肺損傷時AM和肺泡上皮呈進(jìn)行性凋亡狀態(tài)[24]。Bcl-2是一種細(xì)胞凋亡抑制基因,通過對抗引起線粒體破裂的離子失衡,進(jìn)而阻斷細(xì)胞色素C釋放,抑制Caspase活化,拮抗促凋亡基因,發(fā)揮抗氧化及維持細(xì)胞內(nèi)鈣穩(wěn)態(tài)等作用,抑制細(xì)胞凋亡。有研究顯示,rhEPO可減輕高氧所致的大鼠肺損傷,上調(diào)Bcl-2蛋白表達(dá)、抑制肺泡上皮細(xì)胞凋亡可能是其作用機制[25]。
HMGB1是新近發(fā)現(xiàn)的一種炎癥因子,機體組織嚴(yán)重感染時會廣泛表達(dá)。HMGB1有三個氧化還原亞型,分別為二硫鍵型、硫醇型和磺酰基型。二硫鍵型通過與細(xì)胞表面受體髓樣分化蛋白2-Toll樣受體4結(jié)合,促進(jìn)TNF和IL-6釋放,加重炎癥反應(yīng);硫醇型與趨化因子受體12形成異源復(fù)合物,促進(jìn)自噬基因1依賴的細(xì)胞自噬;磺酰基型通過內(nèi)源性通路Caspase-9/3誘導(dǎo)細(xì)胞凋亡[26]。研究顯示,LPS導(dǎo)致大鼠SIRS注射LPS 2 h后激活的單核/巨噬細(xì)胞釋放HMGB1,6~12 h達(dá)到峰值,72 h開始下降,當(dāng)臨床癥狀改善后血清HMGB1水平逐漸恢復(fù)正常[27]。HMGB1的釋放途徑包括單核/巨噬細(xì)胞的主動分泌和凋亡細(xì)胞的被動釋放,HMGB1長時間高表達(dá)主要與其釋放途徑有關(guān)[28]。血液和肺泡灌洗液中HMGB1水平升高可直接導(dǎo)致中性粒細(xì)胞浸潤、肺泡出血、肺實質(zhì)細(xì)胞損傷和炎性因子釋放增加等。在注射LPS 2 h后給予抗HMGB1抗體能夠顯著降低膿毒癥患者病死率[29]。Valdes-Ferrer等[30]研究顯示,在膿毒癥存活小鼠血漿HMGB1水平持續(xù)升高,可引起炎癥性貧血,給予抗HMGB1單克隆抗體可顯著改善貧血。本研究模型組和治療組血清HMGB1水平均高于對照組,血清Bcl-2水平均低于對照組;治療組血清HMGB1水平低于模型組,血清Bcl-2水平高于模型組;說明EPO可通過降低HMGB1水平、升高Bcl-2水平而減輕SIRS所致的肺損傷。
綜上所述,EPO對SIRS誘發(fā)的急性肺損傷有治療作用,其作用機制可能與下調(diào)血清HMGB1、上調(diào)Bcl-2有關(guān)。

