丙泊酚抗N-甲基-D-天冬氨酸毒性作用及其與腦源性神經營養因子表達的關系??
房德芳,江 山,李小雷,石薷月
(江蘇聯合職業技術學院連云港中醫藥分院,江蘇連云港 222006)
丙泊酚是一種靜脈麻醉藥物,被廣泛用于臨床麻醉和鎮靜,并且對心臟、腦等臟器也有一定的保護作用[1-2],然而對于丙泊酚腦保護的確切作用機制仍不明確。腦源性神經營養因子(brain-derived neurotrophic factor,BDNF)在中樞神經系統內有著廣泛分布,在神經元生長發育中起著重要作用,并可促進神經元損傷后的再生和修復[3-4]。有研究發現,丙泊酚促進創傷性腦損傷大鼠神經功能和學習記憶認知功能的恢復可能與促進BDNF的表達相關[5]。當中樞神經損傷發生后,可導致興奮性氨基酸過度釋放,刺激N-甲基-D-天冬氨酸(NMDA)受體過度興奮從而誘發鈣離子(Ca2+)大量內流超載,最終引起神經元死亡[6-7]。丙泊酚有拮抗NMDA受體的作用,但其作用是否與調控BNDF的表達有關仍不清楚。本實驗采用離體海馬腦片損傷模型,觀察海馬CA1區誘發電位和BDNF表達的變化,以探討丙泊酚對于NMDA毒性損傷保護作用的可能機制。
1 材料與方法
1.1 材料
1.1.1實驗動物與分組 雄性昆明小鼠(徐州醫科大學實驗動物中心提供),體質量20~26 g,隨機分為對照組、損傷組和丙泊酚組(1、5、10 μmol/L)。
1.1.2儀器與試劑 MEZ-8301微電極放大器(日本光電)、SEN-3301刺激器(日本光電)、ZQP-86振動切片機(上海海天電子儀器公司)、HXD-2000處理分析軟件(北京華翔公司)。丙泊酚購自英國AstraZeneca公司,NMDA購自美國Sigma公司,兔多克隆一抗購自美國Santa Cruz公司。人工腦脊液(ACSF)成分及含量(mmol/L):NaCl 124 mmol/L,KCl 3.3 mmol/L,NaH2PO41.24 mmol/L,MgSO42.4 mmol/L,NaHCO325.7 mmol/L,CaCl22.4 mmol/L,葡萄糖10.0 mmol/L,pH 7.35~7.45。
1.2 方法
1.2.1離體海馬腦片的制備 小鼠麻醉后,斷頭取腦,然后將腦組織置于95% O2與5% CO2混合氣體飽和的ACSF中(0~4 ℃),使用振動切片機切取厚度為400 μm的海馬腦片(每組10張腦片),然后將腦片放置在(32.0±0.5)℃的95% O2與5% CO2混合氣體飽和ACSF中孵育和恢復2~3 h。實驗時將4~5張腦片移入全浸式恒溫灌流槽內(32.0±0.5)℃,灌流速度為1.5~2.0 mL/min。
1.2.2實驗程序 NMDA毒性實驗用含NMDA(0.1、0.5、1.0、2,0 mmol/L)的ACSF灌流腦片,20 min后去除NMDA,再用經95% O2與5% CO2混合氣體飽和的ACSF灌流,觀察時間至去除NMDA后2 h。實驗組給藥方法:在NMDA使用前15 min,使用中20 min,去除后15 min這段時間內將不同濃度的丙泊酚(1、5、10 μmol/L)加入灌流液中。對照組無藥物處理。
1.2.3順向群峰電位(OPS)的記錄 選取灌流槽內1張腦片,將刺激電極放置在小鼠海馬腦片CA3區的Schaffer側支路徑上,記錄電極為玻璃微電極(內充2 mmol/L NaCl溶液,電阻為2~10 MΩ),置于CA1區錐體細胞層,可記錄到誘發電位。OPS經放大后輸入計算機進行數據分析。實驗中觀察OPS波幅的變化,直至去除NMDA 2 h后OPS的恢復情況。
1.2.4腦片組織損傷測定 采用2,3,5-氯化三苯四氮唑(TTC)染色法測定。去除NMDA 2 h后,灌流槽內的部分腦片用2% TTC染色30 min,漂洗,表面水分用濾紙吸干,腦片稱重后,以1 g∶20 mL的比例加入抽提液(乙醇∶二甲亞砜=1∶1),避光密閉保存24 h,抽提液按100 μL 的量分別加入96孔板,酶標儀測定各孔在490 nm處吸光度值。腦片組織損傷率按以下公式計算:組織損傷百分率=(1-A損傷/A對照)×100%。
1.2.5免疫組織化學測試 去除NMDA 2 h后,灌流槽內部分腦片經4%多聚甲醛固定8 h后,用不同濃度的蔗糖進行梯度脫水,連續海馬冠狀冰凍30 μm切片。采用SP法,切片經3%過氧化氫(H2O2)處理消除內源性過氧化物酶的活性,沖洗后加羊血清進行封閉處理,然后滴加兔多克隆BDNF一抗(1∶200稀釋),放置在4 ℃冰箱內過夜,沖洗后滴加羊抗兔二抗,37 ℃下孵育1 h,沖洗后滴加辣根過氧化物酶標記的鏈霉卵白霉素工作液,37 ℃下孵育1 h,沖洗后二氨基聯苯胺(DAB)顯色,然后貼片、脫水、透明和封片。
1.3觀察指標 電生理實驗OPS恢復幅度:去除NMDA 2 h后OPS波幅與初始OPS波幅的百分比。免疫組織化學結果采用圖像分析處理系統進行灰度分析,每張切片在高倍鏡下計數海馬CA1區陽性細胞的染色強度,以背景灰度值減去測量處灰度值后的平均值作為最終灰度值。
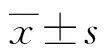
2 結 果
2.1NMDA毒性對腦片損傷的影響 在加入NMDA(0.1 mmol/L)后海馬腦片CA1區OPS振幅增大,并一直維持到去除NMDA 2 h后。在加入NMDA(0.5 mmol/L)后OPS逐漸減小,去除NMDA 2 h后OPS恢復程度降低,海馬腦片損傷率增加。在加入NMDA(1.0、2.0 mmol/L)后OPS在20 min內消失,去除NMDA 2 h后OPS恢復程度均明顯降低,海馬腦片損傷率明顯增加,見表1。
2.2丙泊酚對NMDA毒性損傷后腦片OPS的影響 在損傷組去除NMDA(1 mmol/L)2 h后海馬腦片CA1區OPS恢復程度較低。丙泊酚(5、10 μmol/L)可明顯提高OPS恢復程度,與損傷組比較,差異有統計學意義(P<0.01),見表2、圖1。
2.3丙泊酚對NMDA毒性損傷后腦片組織損傷的影響 在損傷組去除NMDA(1 mmol/L)2 h后海馬腦片損傷率較大。丙泊酚(5、10 μmol/L)可使損傷率明顯降低,與損傷組比較,差異有統計學意義(P<0.05),見表2。
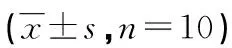
表1 不同濃度NMDA對海馬腦片損傷的影響
*:P<0.05,#:P<0.01,與NMDA(0.1 mmol/L) 比較
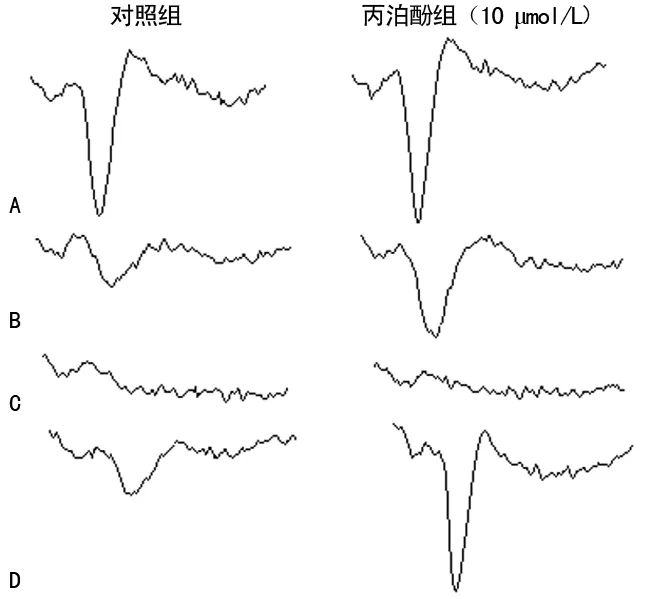
A:NMDA損傷前;B:NMDA損傷4 min;C:NMDA損傷20 min;D:NMDA損傷后2 h圖1 NMDA損傷時海馬腦片OPS的變化
2.4丙泊酚對NMDA毒性損傷后腦片BDNF表達的影響 在對照組海馬腦片上CA1區BDNF陽性細胞有表達。在損傷組加入NMDA(1 mmol/L)后海馬腦片BDNF陽性細胞表達略有增高,但與對照組相比無明顯差異(P>0.05)。丙泊酚(5、10 μmol/L)可使BDNF陽性細胞表達明顯增多,染色加深,與損傷組比較,差異有統計學意義(P<0.05或P<0.01),見表2、圖2。
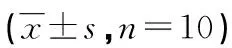
表2 丙泊酚對NMDA毒性損傷后海馬腦片損傷率、OPS振幅和BDNF表達的影響
*:P<0.05,#:P<0.01,與損傷組比較;△:P<0.01,與對照組比較

A:對照組;B:丙泊酚組(10 μmol/L);C:損傷組圖2 NMDA損傷時海馬腦片BDNF表達的變(化SP法×200)
3 討 論
在離體海馬腦片上,當電刺激CA3錐體細胞發出的Schaffer側枝纖維時,通過突觸傳遞,可在CA1錐體細胞層記錄到順向誘發的場電位,即OPS。海馬CA1區是腦損傷的敏感區域,而損傷后OPS的振幅值大小代表突觸傳遞功能的恢復程度[8-9]。實驗中在灌流液中加入濃度為0.1 mmol/L NMDA后海馬CA1區OPS振幅增加,提示激動NMDA受體,產生興奮神經元作用。隨著NMDA濃度增加,過度激動NMDA受體,轉而抑制腦片神經元的OPS,去除NMDA后,腦片組織有明顯損傷,OPS恢復程度低,提示對突觸傳遞產生明顯抑制效應而表現毒性作用。
丙泊酚作為全身麻醉藥物主要通過抑制中樞的興奮性突觸傳導和(或)加強抑制性突觸傳遞而發揮麻醉作用[10]。有研究表明,丙泊酚通過激活抑制性γ-氨基丁酸受體(GABAA受體)影響離子型NMDA受體通道電流,對NMDA受體通道也有直接抑制作用[11-12],丙泊酚可通過抑制NDMA受體,從而保護神經細胞。本實驗中丙泊酚可明顯減輕腦片組織損傷,提高海馬CA1區OPS恢復程度,提示丙泊酚可拮抗NMDA誘導的興奮性毒性作用,從而減輕細胞損傷,有利于突觸傳遞功能的恢復。
有研究表明,BDNF可增強海馬突觸后NMDA受體的磷酸化,迅速增加神經元之間的突觸傳遞[13]。在腦損傷發生時可導致BDNF的表達廣泛增加,而且腦組織抵抗損傷的能力與BDNF表達水平呈正相關[14-15]。在實驗中NMDA可使海馬腦片CA1區BDNF表達增強,說明當神經元受到外來因素損傷時BDNF水平提高是一種保護性反應。丙泊酚可使BDNF表達明顯增強,從而提高腦內BDNF的表達尤其是腦內易損區的BDNF表達,可能是其保護作用的重要途徑之一。
當細胞外液中NMDA水平持續增高,構成NMDA毒性環境,造成細胞損傷,抑制細胞間的突觸傳遞,而此時細胞的自我保護機制亦啟動,BDNF的表達開始增加。本實驗結果提示,丙泊酚可通過增強BDNF的表達,減輕神經元的損傷,使得神經突觸之間的連接保持正常,從而促進突觸傳遞效能的恢復。

