輸尿管硬鏡與軟鏡治療10~20 mm輸尿管上段結石的比較?
顧志文 鄭 彬 羅發彩 張賀慶 宋生生 陳 岳 詹河涓
(廣東省佛山市禪城區中心醫院泌尿外科,佛山 528031)
輸尿管上段結石位于輸尿管腎盂連接部和骶髂關節上緣之間,臨床上較為多見。<20 mm輸尿管上段結石最為常見,治療方法主要有體外沖擊波碎石(extracorporeal shock wave lithotripsy, ESWL)、輸尿管硬鏡(rigid ureteroscopy,R-URS)、輸尿管軟鏡(flexible ureteroscopy,F-URS)或經皮腎鏡碎石術(percutaneous nephrolithotripsy,PCNL)等。ESWL治療效果受到結石成分、大小、有無上尿路梗阻等諸多因素影響,腔內鏡治療輸尿管上段結石的療效確切,近年來逐漸被術者和患者所重視[1]。輸尿管硬鏡和輸尿管軟鏡是最為常用的2種內鏡,可用于輸尿管上段結石的治療,但何種手術方式更為合適目前尚無統一定論,對比研究文獻也甚少。本研究回顧性比較我院2014年12月~2016年12月53例輸尿管上段結石行R-URS或F-URS碎石術,探討輸尿管上段結石更好的腔內治療術式。
1 臨床資料與方法
1.1 一般資料
本研究53例,主要癥狀為腰痛42例,血尿5例,體檢發現無明顯癥狀6例。2015年12月之前主要行R-URS,2015年12月后主要行F-URS。2組患者一般資料比較無明顯統計學差異(P>0.05),具有可比性,見表1。
病例選擇標準:經病史、查體、泌尿系超聲、靜脈腎盂造影、CT等檢查證實為輸尿管上段結石,均為單側、單發結石,且結石最大直徑10~20 mm。排除患側腎及輸尿管解剖結構異常、輸尿管狹窄、腎中重度積水或既往同側輸尿管手術史者。
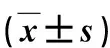
表1 2組患者一般資料比較
1.2 方法
R-URS組:腰麻聯合硬膜外麻醉21例,靜脈吸入復合麻醉4例。截石位,常規消毒鋪巾。F8.0/9.8Wolf輸尿管硬鏡在F4輸尿管導管引導下套入法進入輸尿管,緩慢上鏡至見到結石,外接科醫人鈥激光碎石機,導入500 μm光纖,鈥激光功率選擇1 J、20 Hz,直視下用鈥激光將結石擊碎成光纖大小,較大的碎石塊用取石鉗取至膀胱。泥鰍導絲留置F5雙J管,退鏡,留置雙腔氣囊導尿管。
F-URS組:腰麻聯合硬膜外麻醉23例,靜脈吸入復合麻醉5例。截石位,常規消毒鋪巾。常規用F8.0/9.8Wolf輸尿管硬鏡探查患側輸尿管,如果輸尿管無狹窄置入Bard鎳鈦諾導絲,沿導絲置入COOK F12~45輸尿管軟鏡鞘。直視下置入Olympus電子輸尿管軟鏡,發現結石后導入200 μm光纖,外接科醫人鈥激光碎石機,鈥激光功率選擇1 J、20 Hz,將結石擊碎至光纖大小,較大結石碎片可用鑷鈦套石藍取出。術后留置F5雙J管、雙腔氣囊導尿管。
2組術前后2 d靜脈使用廣譜抗生素。術后第2天拔除導尿管,如患者無發熱,拔除尿管后可出院。術后所有患者均予坦索羅辛緩釋膠囊(哈樂)0.2 mg/d。術后2~4周拔除雙J管,如有結石殘留行ESWL或二期手術。
1.3 觀察指標
手術時間(從尿道入鏡開始至出鏡結束),術后住院時間(出院標準:無發熱,拔除尿管后可出院),住院費用,術后白細胞增高值(術后第1天與術前血常規白細胞差值),血紅蛋白丟失量(術后第1天與術前血常規血紅蛋白差值),止痛藥使用率[按照疼痛數字等級評定量表(numeric rating scales,NRS)進行疼痛評分,≥4分需要使用止痛藥物治療]以及有無石街形成、發熱(>37.3 ℃)、膿毒血癥、感染性休克等并發癥發生;術后2、4周和半年判定結石清除率。根據《中國泌尿外科疾病診斷治療指南2014版》[2],無結石殘留或殘留結石直徑≤4 mm為臨床無意義殘石(clinically insignificant residual fragment,CIRF),且無任何癥狀,即判定為結石成功清除。術后半年復查B超判斷有無術側腎盂積液,如有行IVU檢查進一步明確有無合并輸尿管狹窄。
1.4 統計學分析
2 結果
2組患者均一次順利入鏡,手術時間、術后住院時間無明顯統計學差異(P>0.05)。R-URS組所有患者均能尋獲結石,但7例在碎石過程中部分結石移位至腎內,其中包括位于L3水平以上4例和L3水平以下3例;F-URS組僅1例因術中出血影響視野而未能繼續有效碎石,其余均成功碎石,一次碎石成功率96.4%(27/28),顯著高于R-URS組72.0%(18/25)(P<0.05)。術后2周11例結石殘留,其中R-URL組9例,F-URL組2例,結石清除率分別為64.0%(16/25)、92.9%(26/28),有明顯統計學差異(P<0.05),殘留結石者包括石街5例,非石街6例行ESWL(R-URS 組5例,F-URS組 1例),R-URS組1例行2次ESWL。術后4周、半年結石清除率R-URS組分別為88.0%(22/25)、92.0%(23/25),F-URS組分別為 96.4%(27/28)、96.4%(27/28),均無明顯統計學差異(P>0.05)。住院費用F-URS組顯著高于R-URS組,見表2。
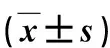
表2 2組術中、術后情況比較
2組患者均無感染性休克、死亡等重大手術并發癥發生,在術后疼痛不適、術后發熱、術后石街形成等并發癥均無明顯統計學差異(P>0.05),見表3。石街形成5例,石街長度18~50 mm,(33.7±9.3)mm,拔除雙J管后4例石街自行排出,1例輔助ESWL后排出。2組均無發生輸尿管撕脫、穿孔、斷裂等輸尿管嚴重并發癥。R-URS組術中輸尿管黏膜挫傷發生率36.0%(9/25),顯著高于F-URS組7.1%(2/28) (χ2=6.687,P=0.010),但隨訪半年無一例發生輸尿管狹窄。R-URL組血紅蛋白丟失量顯著高于F-URL組,無一例需要輸血治療。
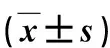
表3 2組手術并發癥比較
*偏態分布,用中位數(最小值~最大值)表示
**Fisher精確檢驗
2.3 典型病例
47歲男性,體檢發現右側輸尿管上段結石4年入院,結石大小16 mm,行R-URS,術中部分結石碎片移位至腎內,后形成石街;術后2周拔除輸尿管支架管,石街減少;輔助ESWL 1次,隨訪至術后4周,結石完全清除,見圖1。
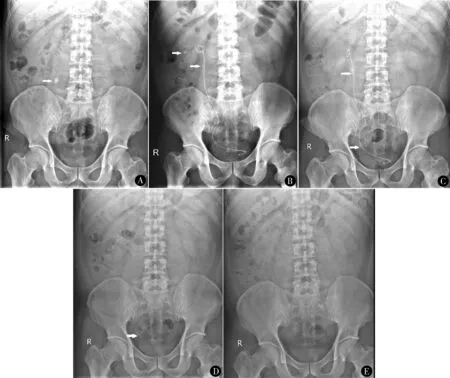
圖1 輸尿管上段結石R-URS術前后KUB A.術前KUB,箭頭示結石位于輸尿管上段;B.術后2 d KUB,箭頭示結石碎片;C.術后2周KUB,箭頭示石街形成;D.拔除輸尿管支架管后KUB箭頭示石街減少;E.輔助ESWL后,術后4周KUB示結石消失
3 討論
輸尿管上段結石靠近腎臟,位置較為特殊,臨床上治療較為困難。ESWL是治療輸尿管上段結石常用的方法,2017版EAU指南推薦,結石<10 mm時ESWL可作為首選治療方式,≥10 mm輸尿管上段結石ESWL不再作為首選;結石滯留時間超過3個月,容易被肉芽組織包裹,ESWL治療后結石不僅難易排出,有時反復碎石反而會導致局部水腫,加重梗阻,容易合并泌尿道感染甚至腎功能損害等[3]。近年來,隨著泌尿外科微創技術的快速發展,腔內治療成為了一種常規手段,其中輸尿管硬鏡和輸尿管軟鏡均為經人體自然腔道的術式,是輸尿管結石最為微創的腔內治療方式。
輸尿管軟鏡治療上尿路結石,具有創傷小、恢復快、清石率高等優點,曾被認為是輸尿管上段結石治療的首選[4]。但由于輸尿管軟鏡價格昂貴、易損壞且維修困難,目前僅適于處理<20 mm結石,對于這些結石,輸尿管軟鏡自身的損耗較小[5]。Karadag等[6]應用輸尿管軟鏡治療61例直徑為(11.01±2.24) mm的單發輸尿管上段結石,術后即刻清石率86.8%,術后3個月清石率93.4%,無輸尿管撕脫、膿毒血癥等嚴重并發癥。Hyams等[7]對71例直徑<2 cm的輸尿管上段結石行輸尿管軟鏡聯合鈥激光碎石,總體清石率為95%,其中<1 cm的清石率更是達100%。本研究F-URS組28例結石直徑(14.1±3.3) mm,經輸尿管軟鏡聯合鈥激光碎石,碎石成功率96.4%(27/28),術后2周結石清除率92.9%(26/28),殘余結石行ESWL后,最終結石清除率達96.4%(27/28),療效顯著。
輸尿管硬鏡比輸尿管軟鏡更早應用于治療輸尿管結石,被認為是輸尿管中下段結石的首選治療方式[8],但是否適用于輸尿管上段結石的治療仍有爭議較大。陸佳蓀等[9]認為輸尿管上段結石距離腎盂較近,結石容易向腎內逃逸,輸尿管鏡又不能轉彎進入各腎盞,處理輸尿管上段結石相對困難。唐榮志等[10]認為輸尿管鏡長度可達腎盂位置,通過一定的手術技巧,L5~L3水平的輸尿管上段結石仍可首選這種治療方式。本研究R-URS組一次碎石成功率72.0%(17/25),顯著低于F-URS組(χ2=4.391,P=0.036);R-URS術后2周結石清除率64.0%(16/25),顯著低于F-URS組(χ2=6.687,P=0.010),考慮為碎石移位至腎內所致。趙曉風等[11]建議輸尿管鏡處理輸尿管上段結石時,應用取石網籃可阻擋結石移位,提高結石清除率。我們認為鈥激光在碎石過程中可能會燒斷網籃,甚至造成異物殘留,故本研究未采用取石網籃或封堵器進行攔截,術后對殘余結石行ESWL治療,最終總體結石清除率可增高至92.0%(23/25),接近F-URS組(P>0.05),而且住院費用更低(P<0.05)。可見,R-URS治療輸尿管上段結石可行、有效,通過一定的手術技巧,可媲美輸尿管軟鏡的療效。R-URS處理輸尿管上段結石的關鍵在于:①采取頭高腳低體位,使患者膝關節與頭部在同一水平,利用結石自身重力減少結石上浮;②術中注意控制沖水壓力,可利用50 ml注射器連接輸液器由助手手工灌注,保持視野清晰即可;③在碎石過程中,先打通結石遠近兩端,利用500 μm直徑的鈥激光光纖壓著結石碎塊,再由輸尿管近端向遠端進進一步粉碎,盡可能將結石粉碎至光纖大小,對稍大塊的結石盡量鉗出,小結石多能自行排出,注意術后需密切隨訪,對殘留結石需ESWL輔助治療或二次手術。
輸尿管硬鏡和輸尿管軟鏡的并發癥類似,總體發生率2.7%~25%[12,13]。本研究主要為Clavien Ⅰ~Ⅱ級并發癥,包括黏膜損傷、腰痛、發熱及石街形成,2組均未發生輸尿管穿孔、輸尿管撕脫、感染性休克等嚴重并發癥。在黏膜損傷和血紅蛋白丟失方面,R-URS組發生率顯著高于F-URS組(P<0.05),可能是因為輸尿管上段結石位置較高,輸尿管鏡操作路徑較長,反復進出輸尿管造成黏膜摩擦滲血,輸尿管軟鏡常規放置輸尿管軟鏡鞘,保護輸尿管壁,黏膜損傷較輕,出血較少;部分患者術后血紅蛋白濃度升高,血紅蛋白丟失呈負數,可能是由于術后液體進入減少,血液濃縮所導致。術后石街形成是腔內碎石較為常見的手術并發癥,2組發生率分別為8.0%(2/25)、10.7%(3/28),無明顯統計學差異(P>0.05),但2組5例石街有4例在輸尿管支架管后能自行排出,可能也與文獻[14,15]報道的口服α-受體阻滯劑、適當縮短留置雙J管時間能促進石街排出有關。F-URS組1例術中合并出血影響手術進展,考慮為鈥激光處理息肉過程所致,袁武雄等[16]也有這方面的報道,尤其是鈥激光燒灼息肉基底部時,反復的創面滲血不僅影響手術視野,還容易引起輸尿管穿孔。輸尿管狹窄是輸尿管腔內手術潛在的遠期并發癥,文獻報道發生率為4%~7.8%[17,18],主要與輸尿管穿孔、輸尿管黏膜損傷、黏膜下殘余結石等因素有關。2組術后均留置雙J管,對黏膜損傷者適當延長雙J管留置時間至4周,隨訪半年未發現輸尿管狹窄。
綜上所述,對于10~20 mm輸尿管上段結石,輸尿管鏡與輸尿管軟鏡手術均安全可行,其中輸尿管軟鏡結石清除率高,并發癥較輕,術后恢復快,輔助治療率低,可作為首選治療方式,有條件的醫院值得推廣。輸尿管鏡的結石清除率不高,術后往往需要結合ESWL治療,但因可操作性強,并發癥也較少,而且費用較低,在基層醫院也可供參考選用。另外,本研究為回顧性研究,樣本量較小,有待以后進行大樣本的前瞻性研究和更長期的臨床隨訪。

