用于心室輔助裝置系統性能測試的標準化體外模擬循環系統研究
陳實,李澍,陳琛,,支夢竹,黃鵬輝,馬云善,陳紫文,徐博翎
1.蘇州大學 機電工程學院/生物制造中心 人工器官研究所,江蘇 蘇州 215000;2.中國食品藥品檢定研究院,北京 102629;3.蘇州同心醫療器械有限公司,江蘇 蘇州 215000
引言
我國有2.9億心血管病患者,患病率持續上升,占人口死亡原因第一位[1]。心力衰竭作為心臟病發展的嚴重階段,不僅患者人數眾多,而且病程發展難以通過已有藥物及傳統器械得到逆轉,演變為終末期心衰后的兩年死亡率男性為37%,女性為33%[2]。心臟移植是目前公知的重癥心衰的最佳治療手段,但是心臟的供體極為匱乏,無法成為惠及大眾的現實治療手段[3]。
心室輔助裝置(Ventricular Assist Device,VAD),俗稱人工心臟,是一種機械裝置,能夠替代或輔助衰竭的心臟提供維持正常生理條件的血液灌注量并且減低心臟的負荷。在美國等發達國家經過50多年研究,于本世紀初被美國FDA批準作為替代心臟移植的永久植入設備用于重癥心衰的治療,經過多種不同產品的數萬例臨床應用,表明采用旋轉式血泵技術的VAD可以顯著延長患者的存活壽命,兩年存活率達到70%,同時可以顯著提高患者的生活質量[4]。近10年來,隨著臨床經驗的增加和最新一代VAD技術進入臨床應用,顯示出更好的治療效果[4]。
VAD是流體機械的一種特殊應用,在所有心血管人工器官中是最復雜的動態機電系統,其與人體之間的動態響應決定了所能達到的治療效果和安全性。進入臨床試驗前,VAD必須通過嚴格的體外系統性能測試。該測試是在一個模擬臨床應用的環境下,對于VAD系統的最終設計進行的全面的性能評價。
模擬循環試驗臺(Mock Circulatory System,MCS)能夠模擬人體循環系統的脈動流環境,重現循環系統不同生理條件下的血流動力學過程。1959年,人工器官之父Kolff在美國的克利夫蘭醫學中心建造了最早的MCS實驗臺[5]。1960年間,一些結構較為簡單的MCS被使用于心肺機和IABP的體外測試[6-7]。1981年,賓夕法尼亞州立大學(Pennsylvania State University)的Rosenberg課題組設計的MCS,帶有體循環和肺循環模塊、動靜脈順應性和血管阻抗等元件,可以調整元件參數模擬不同的生理狀態,其物理設計是今日許多MCS的前身[8]。我國在血流動力學實驗臺上的起步相對較早,四川大學在80年代即開發了用來測試人工瓣膜性能的MCS,是我國體外脈動流實驗臺的先驅[9]。
1970年間,德國亞琛工業大學(RWTH-Aachen University)的Helmut Reul課題組,開始使用MCS作為恒流式心室輔助裝置和全人工心臟的測試平臺[10]。四十多年來,隨著人工心臟技術的進展,MCS除了用作為生機電系統響應和血流動力學研究的重要平臺之外,也成為標準化評價VAD系統性能的有效手段[11]。將VAD接入MCS中聯合運作,便可以在體外模擬VAD系統和模擬患者的相互作用,并模擬這兩方任何一方的變化對另一方所產生的效應。美國食品藥品監督管理局(FDA)明確建議MCS體外實驗的結果是VAD進行動物實驗前的重要指標,基于MCS的體外試驗也已經成為ISO規范的一部分[12-13]。
ISO-14708-5對用于VAD體外性能測試的MCS特性進行要求:MCS要能夠模擬人體血液循環系統及系統的各個組成部分;MCS的各個組成部分應該合理表征特定的病人群體的生理參數,包括血壓、血流及順應性,反映各個生理參數之間的基本關系;MCS能夠模擬VAD性能變化對病人的影響以及病人生理參數的變化對VAD性能的改變,如在最小血流量、最大血流量、高血壓與低血壓等極端操作條件下,VAD性能的改變對MCS各個組成部分的血壓、血流的影響。然而,標準中僅僅介紹了基本的系統組成和功能要求,研究者仍需吃透MCS在復現臨床應用環境的參數定義和設計方法,從而能夠科學有效且穩定的復現VAD系統運行時的環境條件。本論文通過研究發表的臨床大數據,框定了MCS的最大工作范圍,研制了一套用于標準化VAD系統性能測試的MCS,完成了該MCS的驗證實驗以及在標稱條件下與VAD協同工作的實驗。
1 材料與方法
1.1 MCS設計目標
為了要能夠滿足患者間體型、活動量等造成的不同血流動力學需求,VAD系統必須要能夠在一定范圍內的心衰生理條件下正常運作。生理條件是血泵的工作環境,變化范圍由心率、心搏量、平均心房壓(代表心室前負荷)、平均動脈壓(代表心室后負荷)的改變調制標定。同時,病人的生理參數—血管順應性和外周阻力—應當符合該生理條件下的正常范圍。
通過收集已經發表的臨床文獻,得到心衰患者的生理參數和血流動力學參數(表1)[14-16]。其中,心率(Heart Rate,HR)、 心 搏 量(Stroke-Volume,SV)、 左 心 房 壓(Left Atrial Pressure,LAP)、體循環血管順應性(Systemic Circulation Vascular Compliance,SAC)和體循環外周阻力(Systemic Circulation Resistance,SVR)代表了MCS的相應設定參數,而血流動力學參數:系統總流量(Systemic Flow, Qs)、主動脈平均壓(mean Aortic Pressure,AOPm)、LAP,則對應了性能測試的“評價指標”。值得說明的是,由于LAP約略等于中心靜脈壓,因此間接反映了人體循環系統的血容量,也就是心室的前負荷,因此作為血流動力學參數的同時也是系統的設定參數。表中的數值采用文獻中平均值正負兩個標準差換算得到涵蓋群體95%的參數范圍。
1.2 MCS系統組成與設計方法
本文研究的MCS是用于左心室輔助裝置的體外性能測試,因此復現左心室驅動的體循環系統為系統設計目標。該MCS的系統組成示意圖和實際照片,見圖1,系統組成包括水力學回路、傳感儀器、控制與數據采集模塊。水力學回路是對應人體循環系統的實體部分,產生血壓和血流等血流動力學參數。傳感儀器、控制與數據采集模塊則是通過數據采集系統和算法,采集、計算、顯示水力學回路產生的參數結果。

表1 心衰患者的生理參數和血流動力學參數數值范圍
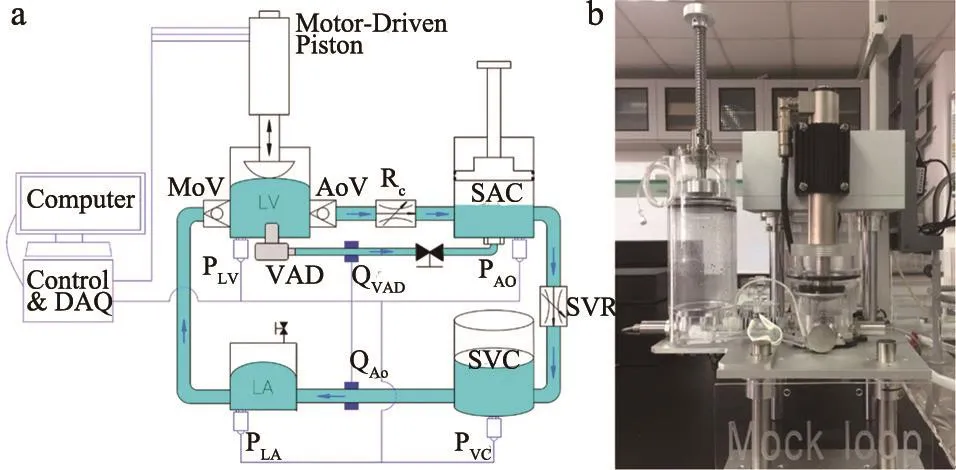
圖1 MCS的組成原理圖(a)和試驗臺水力學回路部分的實際照片(b)
1.2.1 水力學回路
水力學回路包括心室模擬器(LV及其驅動)、模擬二尖瓣和主動脈瓣、SAC、SVR、靜脈儲液腔(SVC)、左心房(LA)等。心室模擬器是整個系統的循環動力源,心室(LV)由柔性膜片與剛性腔體構成密閉容腔(圖2a),模擬左心室容積。柔性膜片在直線電機的往復運動作用下,產生運動及形變,引起左心室容積的變化。直線電機進程運動時與柔性膜片接觸,模擬左心室的主動收縮機制。直線電機回程運動時與柔性膜片分離,模擬左心室的被動充盈機制。通過改變直線電機的運動行程、運動周期及進程與回程時間比分別實現模擬SV、HR及收縮舒張比(Sys/Dia)。模擬主動脈瓣和二尖瓣為被動元件,根據心室—動脈、心室—心房間的壓力決定開關狀態,保證循環系統中液體的單向流動。血管系統特征阻抗模擬升主動脈部分的血管阻力。由于體循環靜脈系統順應性很高,因此在一般MCS設計中,SVC為一個與大氣聯通的容器,用來模擬靜脈腔儲血的功能。
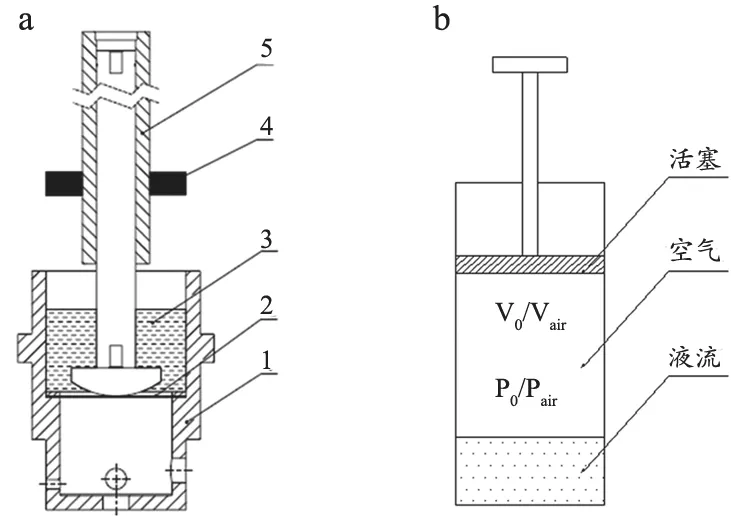
圖2 心室模擬器運動機制(a)和血管順應性室(b)的設計原理圖
血管順應性SAC表征血管中血流單位壓力的變化引起的血管容積變化,定義見式(1)。物理設計模型,見圖2b,用一活塞與順應性腔體組成密閉容腔,容腔內有一定容積的空氣。根據理想氣體的狀態方程,可以得出密閉氣體的絕熱變化的狀態方程式(2)。

式(1)中,C為順應性值,ΔV為體積變化量,ΔP為壓力變化量。式(2)中,P0為密閉空氣的初始壓力,V0為密閉空氣的初始體積,P1為密閉空氣在絕熱變化后的氣體壓力,V1為變化后的空氣壓力。由于V1=V0+ΔV,P1=P0+ΔP,將式(1)、(2)聯立可以得出順應性C簡化近似計算式(3)。

式中,Vair為密閉空氣容積,單位mL,Pair為大氣壓力,單位mmHg。
血管外周阻力SVR定義為式(4):
式中,SVR為體循環外周阻力,臨床常用單位WU(需通過單位轉換系數得到常用單位dynes·s/cm5);AoPm為平均主動脈壓,單位mmHg;LAPm為平均左心房壓,單位mmHg;CO為心排量,單位L/min。外周阻力的物理設計為一個可調節流閥對流量進行調節,一般流過節流閥兩端的壓力與流量的關系,見式(5)。
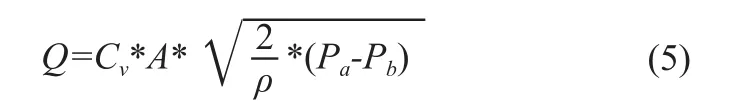
式中,Cv為流量系數,A為節流閥的過流面積,Pa、Pb分別為節流球閥兩端的進口壓力與出口壓力,ρ為液流的密度,可知Q=CO,AoPm-LAPm=Pa-Pb。將式(2)與式(3)聯立可以得到(6)。最后通過帶入流量、壓力等生理指標的要求,可以計算得到每個元件的結構尺寸。
1.2.2 傳感儀器以及控制與數據采集模塊
心室模擬器的線性電機使用linmot E1100-GP-HC控制器控制,控制器通信端與個人計算機通信端口連接。在控制與數據采集軟件中給定特定生理條件下的心室運動軌跡曲線,控制器即下載該曲線,并據此控制電機動子往復運動。心室模擬器上安裝有一個激光位移傳感器,實時量測膜片位移,數據采集系統通過該數值計算出實際心搏量。4個壓力傳感器分別安裝在LV、LA、SAC和SVC腔室底部,實時測量各部分的壓力值,分別為LVP、LAP、AoP和SVP。其中LAP和AoP(左心房壓和血管順應性室——亦即模擬主動脈的壓力)分別為心室/血泵的前、后負荷,其平均值為系統性能評價指標。2個流量計分別安裝在血泵出口(SAC)以及SAC出口(SVC)的管道上,實時測量血泵輸出流量(QVAD)和主動脈總流量(Qs),其中Qs為系統性能評價指標。
通過上述傳感儀器(表2),經過數據采集卡(NI USB-6008,采樣率1 K)將各型傳感器的測量電信號轉換為數字信號傳遞至計算機,應用Labview程序對采樣信號進行濾波處理(低通濾波,頻率為10 Hz)并進行實時分析和顯示。
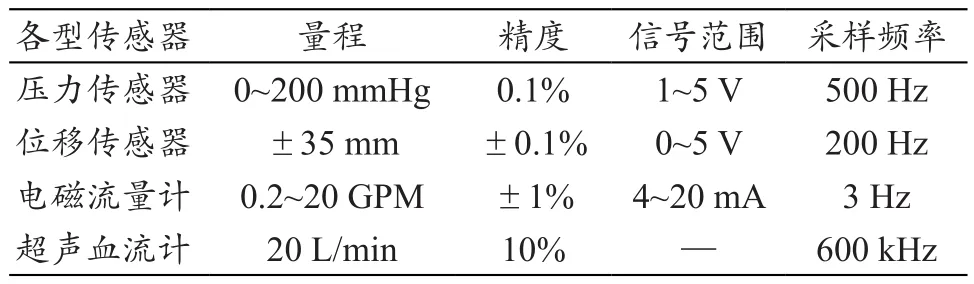
表2 MCS中各型傳感器的主要性能參數
1.3 MCS 測試條件和步驟
1.3.1 平臺性能穩定性測試實驗
本文研究的MCS的測量參數按照ISO14708-5文件的要求,結合心衰條件的生理參數為依據,設定了MCS的測試條件矩陣。根據表1各參數的極大與極小值組合,框定出MCS需要模擬生理條件的最大范圍。得到MCS測試條件矩陣 (表3)。在每一個條件下重復5次實驗并記錄數據,并進行系統誤差的統計分析。
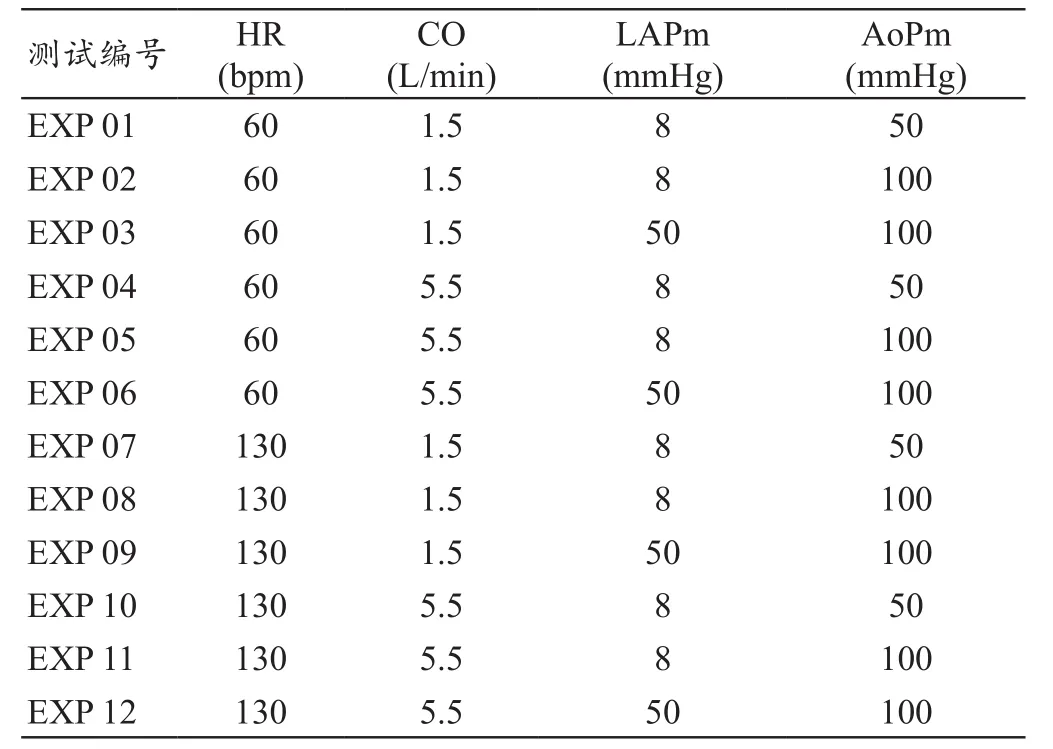
表3 MCS的測試條件矩陣
1.3.2 VAD輔助效果測試實驗
左心室輔助裝置的功能是將左心室中血流直接泵入主動脈,部分或全部代替左心室的泵血功能,為心力衰竭患者提供足夠的血流量。本研究將表1中的均值定為“標稱”心衰條件,并將VAD接入MCS進行VAD輔助心衰患者的體外性能測試,觀察VAD輔助前后MCS的血流動力學參數的變化情況,判斷VAD是否能夠為心力衰竭患者提供足夠的血流量。本研究以CH-VAD裝置為例,標稱生理條件參數(VAD輔助前)和啟動CH-VAD輔助后,MCS各生理參數和血流動力學參數的目標值,見表4。
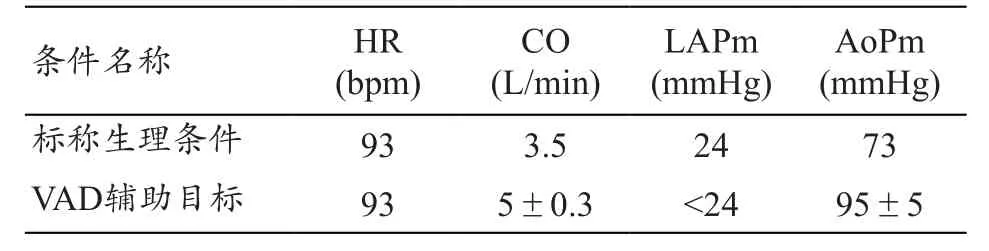
表4 標稱心衰生理條件和VAD輔助后的目標值
2 結果與討論
本研究設計的MCS的水力學回路平臺外觀尺寸大約為高750 mm,長400 mm,寬650 mm;整體尺寸小,各個元件模塊化程度高,實驗操作方便。實驗平臺覆蓋全測試條件矩陣下的實驗結果記錄,見圖3。
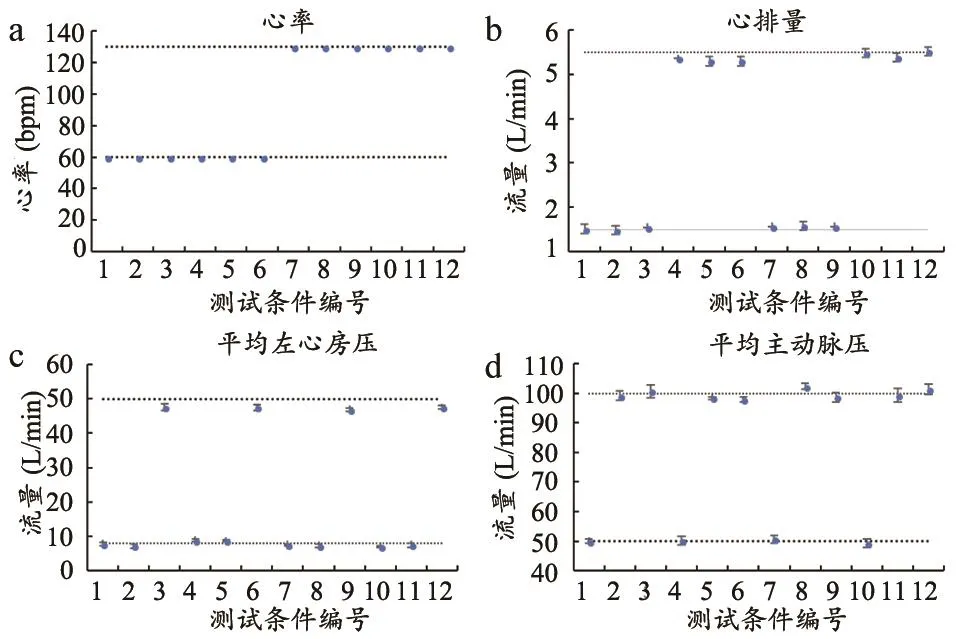
圖3 MCS的生理參數和血流動力學參數
共60次實驗,單一測試條件重復進行5次實驗,數據采用5次實驗的平均值±標準差的方式表示,虛線為目標值。在所有CO=1.5、5.5 L/min的條件下,實驗平均值與目標值的平均方差分別為5%、2%。在所有LAPm=8、50 mmHg的條件下,實驗平均值與目標值的平均方差分別為10%、1%。在所有AoPm=50、100 mmHg的條件下,實驗平均值與目標值的平均方差分別為3%、2%。值得一提的是,LAPm由于絕對值低,敏感度較高,在10%的誤差時的絕對差值小于1 mmHg。總體而言,60次實驗的參數平均值和目標值的平均方差結果顯示系統具有較好的穩定性和可重復性。
VAD輔助效果的實驗結果記錄,見表5,得到CHVAD能夠在標稱生理條件下,將系統灌注量由3.5 L/min提升到5 L/min,達到健康人的水平,因此滿足心衰患者的輔助需求。輔助前后的各部位壓力波形記錄,見圖4,可以發現CH-VAD能夠將患者的動脈壓回復至正常水平(圖4a)。另一方面,CH-VAD也降低了動脈壓力的脈動性,與連續流血泵的運行特性吻合(圖4b、d)。
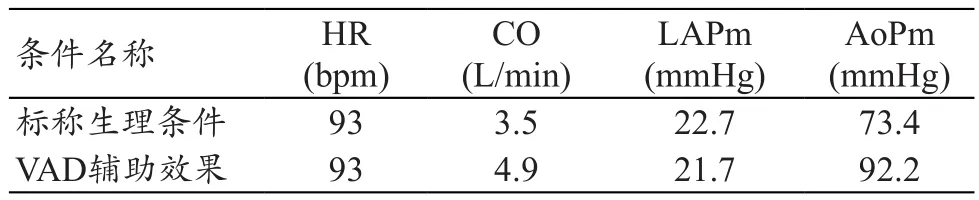
表5 VAD輔助效果實驗結果
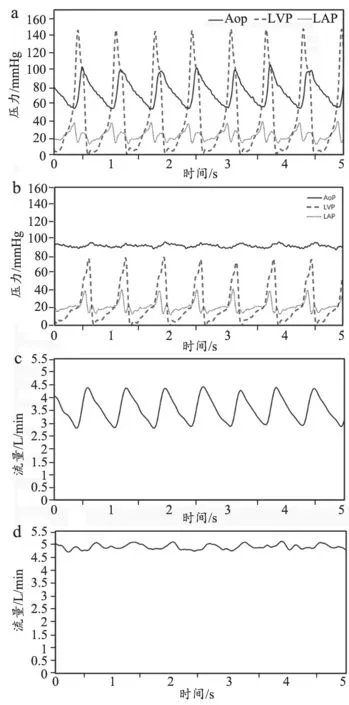
圖4 VAD輔助前后,MCS各部位的壓力波形和流量波形
3 結論
MCS作為VAD性能測試不可或缺的評價平臺,具有重要的研究價值。本研究通過對臨床文獻的研究,得到具有代表性的心衰患者生理條件作為MCS設計指標,并采用極限值組合框定MCS 的測試條件矩陣,為MCS的標準化設計提供了依據。
根據此標準,我們研制了一套標準化、結構緊湊的MCS系統,并且對所有的測試條件進行了驗證。從實驗結果可知,MCS對模擬測試條件矩陣的準確性很高,誤差很小,多次重復性效果很好。本研究選用了臨床均值作為標稱心衰條件對待測VAD進行了輔助性能試驗,驗證了待測VAD能夠有效提供心衰患者足夠的循環輔助。未來通過進一步擴充MCS的設計指標,將能夠進一步模擬超出范圍的極限生理條件,從而評價VAD系統設計之外的極端條件響應。此外,雖然本文中MCS是左心室輔助裝置的測試平臺,主要設計目標是復現體循環的血流動力學參數。但可以通過調整現有設定參數或修改部分設計從而模擬肺循環的血流動力學參數,擴展為右心室輔助裝置的測試平臺,為VAD體外系統性能驗證提供全面的、科學的平臺技術支持。
[參考文獻]
[1] 佚名.中國心血管病報告.2014[M].北京:中國大百科全書出版社,2015.
[2] 崔雅麗.左西孟旦注射液治療終末期心力衰竭的觀察與護理[J].中國實用護理雜志,2013,29(S1).
[3] 薛梅,梁濤,邱建麗,等.心臟移植受者生存質量現狀的研究[J].中華護理雜志,2014,(8):924-927.
[4] Holman WL,Naftel DC,Eckert CE,et al.376 durability of left ventricular assist devices (LVADs): INTERMACS 2006-2011[J].J Heart Lung Transpl,2012,31(4):S133-S134.
[5] Sheldon T.Willem Kolff[J].BMJ Brit Med J,2009,338(7705):1272.
[6] Casta?eda A,Bernstein EF,Gleason L,et al.Further in vitro evaluation of the army heart pump[J].ASAIO J,1964,10(1):57.
[7] Cahill JJ,Kolff WJ.Hemolysis caused by pumps in extracorporeal circulation (in vitro evaluation of pumps)[J].J Appl Physiol,1959,14(1):1039.
[8] Zheng GX,Jiang MH,Gong HL,et al.The evaluation of the optimization design and application effect of samewell-injection-production technique’s injection-production circulatory system[A].IOP Conference Series: Earth and Environmental Science.IOP Conference Series: Earth and Environmental Science[C].2018:012019.
[9] 陳君楷,樊瑜波,袁支潤.人體血液循環的一種計算機模擬及應用[J].中國生物醫學工程學報,1992,(1):27-35.
[10] 晴之 南谷,Reul H,Runge J.Development of a hydraulic analog of the human circulatory system for testing artificial hearts:1. parameter optimization of the hydraulic model elements[J].Keio Eng Rep,1978,31:27-42.
[11] 黃格喻,黨維國,陳琛,等.完全磁懸浮心室輔助裝置的體外模擬循環系統實驗研究[J].醫用生物力學,2017,32(2):174-180.
[12] Gregory S,Timms D,Pearcy MJ,et al.A naturally shaped silicone ventricle evaluated in a mock circulation loop: a preliminary study[J].J Med Eng Technol,2009,33(3):185-191.
[13] Patel S,Allaire P,Wood H,et al.Design and Construction of a Mock Human Circulatory System[A].Summer Bioengineering Conference[C].2003,(2):2-3.
[14] Matthews JC,Koelling TM,Pagani FD,et al.The right ventricular failure risk score: a pre-operative tool for assessing the risk of right ventricular failure in left ventricular assist device candidates[J].J Am Coll Cardiol,2008,51(22):2163-2172.
[15] Lee J,Miller PJ,Chen H,et al.Reliability model from the in vitro durability tests of a left ventricular assist system[J].ASAIO J,1999,45(6):595.
[16] Ochiai Y,Mccarthy PM,Smedira NG,et al.Predictors of severe right ventricular failure after implantable left ventricular assist device insertion: analysis of 245 patients[J].Circulation,2002,106(1):198-202.

