從高考對學(xué)科核心素養(yǎng)的考查談化學(xué)平衡復(fù)習(xí)
林 剛
(南安市僑光中學(xué),福建 南安 362 314)
從2017年開始,教育部考試中心努力探索構(gòu)建“一核四層四翼”的高考評價體系,著力考查學(xué)生的學(xué)科核心素養(yǎng)。在新的背景下,如何在高三復(fù)習(xí)中落實高中化學(xué)學(xué)科核心素養(yǎng)、提高復(fù)習(xí)效益是很多一線教師關(guān)注的課題,筆者以“化學(xué)平衡”的復(fù)習(xí)實踐為例,談?wù)剬W(xué)科核心素養(yǎng)的理解。
一、高中化學(xué)學(xué)科核心素養(yǎng)的內(nèi)涵和理解
(問題略)
試題圍繞與H2S相關(guān)的化學(xué)知識展開,創(chuàng)設(shè)相應(yīng)的問題,考查了物質(zhì)酸堿性強弱的判斷、熱化學(xué)反應(yīng)方程式的書寫、計算,化學(xué)反應(yīng)平衡轉(zhuǎn)化率及平衡常數(shù)的計算、化學(xué)平衡的移動與平衡的影響因素等知識點。
高中化學(xué)學(xué)科核心素養(yǎng)是學(xué)生發(fā)展核心素養(yǎng)的重要組成部分,是指學(xué)生通過高中化學(xué)課程的學(xué)習(xí),在深入理解化學(xué)學(xué)科特征的基礎(chǔ)上,所獲得的適應(yīng)終身發(fā)展和社會發(fā)展需要、具有化學(xué)學(xué)科特質(zhì)的關(guān)鍵能力和必備品格。[1]主要包括宏觀辨識與微觀探析、變化觀念與平衡思想、證據(jù)推理與模型認(rèn)知、科學(xué)探究與創(chuàng)新意識、科學(xué)態(tài)度與社會責(zé)任等五個維度。
如果說學(xué)科基礎(chǔ)知識和學(xué)科能力是學(xué)生發(fā)展化學(xué)核心素養(yǎng)的基礎(chǔ),那么高中化學(xué)學(xué)科核心素養(yǎng)的實質(zhì)可以理解為化學(xué)學(xué)科思想方法。在高中化學(xué)學(xué)習(xí)中,涉及到物質(zhì)思想、變化思想、守恒思想、辯證思想、綠色化學(xué)思想等。通過這些思想的學(xué)習(xí)可以讓學(xué)生很好地認(rèn)識到化學(xué)是一門在原子、分子水平上研究物質(zhì)的組成、結(jié)構(gòu)、性質(zhì)、變化及其應(yīng)用的基礎(chǔ)學(xué)科,有助于學(xué)生形成正確的世界觀和科學(xué)的方法論。
二、高三化學(xué)復(fù)習(xí)教學(xué)中落實學(xué)科核心素養(yǎng)的實踐——以“化學(xué)平衡”為例
1.高考試題考查化學(xué)核心素養(yǎng)例析
例1.2017年高考理科綜合全國I卷第28題
近期發(fā)現(xiàn),H2S是繼NO、CO之后的第三個生命體系氣體信號分子,它具有參與調(diào)節(jié)神經(jīng)信號傳遞、舒張血管減輕高血壓的功能。回答下列問題:
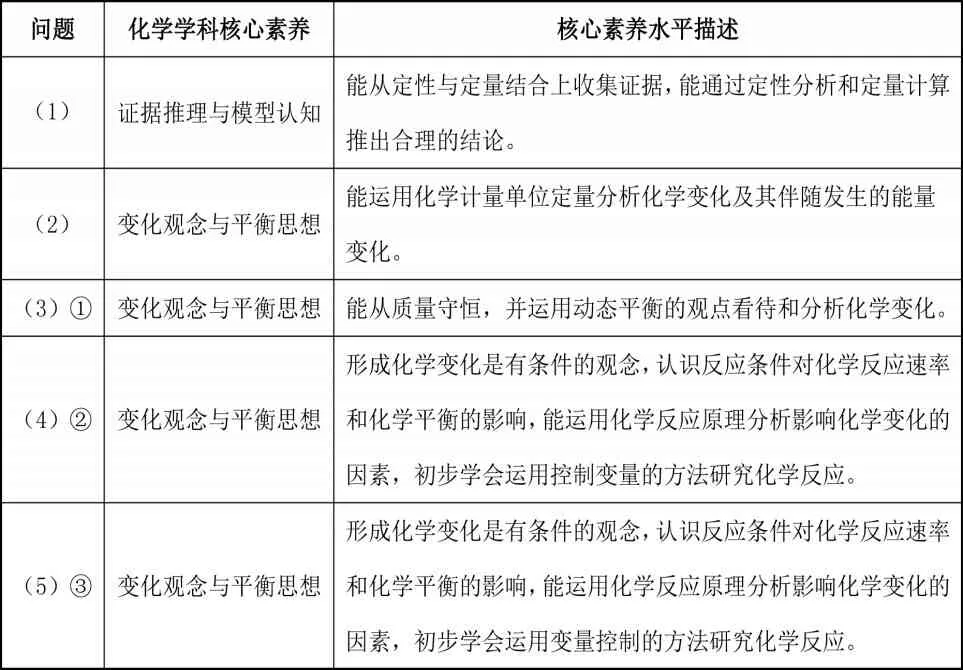
表1 例1考查的化學(xué)學(xué)科核心素養(yǎng)
2.在復(fù)習(xí)教學(xué)中落實學(xué)科核心素養(yǎng)——以“化學(xué)平衡”為例
“變化觀念與平衡思想”的內(nèi)涵很豐富,涉及到化學(xué)變化的條件、限度、能量轉(zhuǎn)化等,要求學(xué)生能從微觀視角分析化學(xué)變化的特征、本質(zhì),能從定性、定量角度對化學(xué)反應(yīng)進(jìn)行分析和研究,能用守恒觀、動態(tài)平衡觀看待和分析化學(xué)變化等。[2]因此,在落實“變化觀念與平衡思想”核心素養(yǎng)時應(yīng)該引導(dǎo)學(xué)生多角度、動態(tài)地分析可逆反應(yīng)。以復(fù)習(xí)“判斷一個可逆反應(yīng)是否達(dá)到化學(xué)平衡狀態(tài)”為例,這是一個重要知識點,其根本方法是要從可逆反應(yīng)達(dá)到化學(xué)平衡狀態(tài)后所具有的“等”和“定”兩個特征進(jìn)行判斷,復(fù)習(xí)中可設(shè)置如下例題進(jìn)行訓(xùn)練:
例2.(1)在一定溫度下的恒容容器中,發(fā)生反應(yīng)2A(g)?B(g)+3C(g),當(dāng)出現(xiàn)下列情況時,能說明反應(yīng)達(dá)到平衡狀態(tài)的有______。
A.c(A):c(B):c(C)=2:1:3
B.B在混合氣體中的百分含量不變
C.容器內(nèi)壓強不再變化
D.容器內(nèi)氣體的密度不變
E.混合氣體的平均相對分子質(zhì)量不再變化
(2)若反應(yīng)改為 2A(g)?B(s)+3C(g),能說明反應(yīng)達(dá)到平衡狀態(tài)的有______。
(3)若反應(yīng)改為 2A(s)?B(g)+3C(g),能說明反應(yīng)達(dá)到平衡狀態(tài)的有______。
(4)若恒容容器改為恒壓容器,能說明反應(yīng)達(dá)到平衡狀態(tài)的有______。
通過以上問題的訓(xùn)練,學(xué)生對于可逆反應(yīng)未達(dá)平衡之前的“動”與達(dá)到平衡后的“定”會有比較深刻的認(rèn)識。如“容器內(nèi)氣體的密度不變”一定能說明反應(yīng)達(dá)到平衡嗎?通過問題(1)和(2)的對比可知,定容條件下混合氣體的密度不變能否用于判斷可逆反應(yīng)達(dá)到平衡關(guān)鍵在于混合氣體的質(zhì)量是否隨著反應(yīng)的進(jìn)行發(fā)生變化。同樣,某種氣體的百分含量不變就是“定”嗎?通過問題(3)可知,某種氣體的百分含量不變不一定就是“組成固定”。再通過問題(4),把“恒容容器”改為“恒壓容器”讓學(xué)生訓(xùn)練,可以很好地提升對“定”的理解。通過類似的復(fù)習(xí),可以很好地突破判斷可逆反應(yīng)達(dá)到化學(xué)平衡狀態(tài)的問題。
再如,復(fù)習(xí)化學(xué)平衡常數(shù)時經(jīng)常要涉及到多個平衡體系同時存在的情況,在使用K進(jìn)行有關(guān)計算時,不同反應(yīng)中的同一物質(zhì)的濃度該如何考慮?復(fù)習(xí)時,可設(shè)置如下例題進(jìn)行訓(xùn)練:
例3.(1)在一定溫度下,在一個恒容的密閉容器中,充入一定量的 NH4I(s),NH4I分解生成 NH3(g)和HI(g),生成的HI(g)又分解為H2(g)和I2(g)。若平衡時 HI(g)為 2mol,H2為 0.5 mol,請計 算 該 溫 度下NH4I(s)?NH3(g)+HI(g)的平衡常數(shù)。
(2)氨法脫硫過程中,當(dāng)吸收液pH=6時,=_______。(已知:25°C 時,Ka1(H2SO3)=1.5×10-2;Ka2(H2SO3)=1.0×10-7)
(3)常溫下,HCl和 CuCl2的混合溶液中,c(H+)=0.30 mol·L-1,c(Cu2+)=0.10 mol·L-1,往該溶液中通往H2S至飽和(H2S的近似濃度為0.10 mol·L-1),___(填“能”或“不能”)出現(xiàn)沉淀,用必要的計算過程和文字說明理由:______________。
通過這些問題的思考、分析與總結(jié),學(xué)生能較好地運用動態(tài)平衡的觀點看待和分析化學(xué)反應(yīng)。
三、基于化學(xué)學(xué)科核心素養(yǎng)培養(yǎng)的高三復(fù)習(xí)建議
1.教學(xué)內(nèi)容應(yīng)圍繞核心概念、主干知識
在教學(xué)及復(fù)習(xí)內(nèi)容上應(yīng)側(cè)重選擇離子反應(yīng)、氧化還原反應(yīng)等核心概念和主干知識,如氧化還原反應(yīng)概念的復(fù)習(xí),可以和離子共存、電化學(xué)、試劑的保存、氧化還原滴定、沉淀的轉(zhuǎn)化等學(xué)科的主干知識相互聯(lián)系。這種基于核心概念的教學(xué),有利于學(xué)生更好地學(xué)習(xí)化學(xué)基礎(chǔ)知識,在學(xué)習(xí)核心概念的基礎(chǔ)上,學(xué)生更容易進(jìn)行有意義的學(xué)習(xí),在高三化學(xué)總復(fù)習(xí)中比較容易形成系統(tǒng)化的知識網(wǎng)絡(luò)。
2.教學(xué)方式應(yīng)突顯培養(yǎng)學(xué)生的學(xué)科思維
核心素養(yǎng)中提及的關(guān)鍵能力,在化學(xué)學(xué)科中主要體現(xiàn)為自主學(xué)習(xí)能力、獲取、處理并運用信息的能力、思維能力,其中思維能力是核心。[3]因此,在教學(xué)方式上教師應(yīng)盡可能地選擇運用能較好地培養(yǎng)學(xué)生學(xué)科思維能力的教學(xué)方式,如問題式教學(xué)、情景教學(xué)、思維導(dǎo)圖等。
3.教學(xué)手段應(yīng)突出學(xué)科特點
化學(xué)是一門實驗科學(xué),通過實驗探究可以培養(yǎng)學(xué)生的合作精神、探究能力、創(chuàng)新意識等。因此,在教學(xué)中,教師要積極創(chuàng)造條件,引導(dǎo)學(xué)生開展實驗探究。此外,基于化學(xué)學(xué)科“宏觀—微觀—符號”相結(jié)合的研究方法,應(yīng)該將三重表征作為重要的教學(xué)手段和學(xué)習(xí)方法。同時,還要引導(dǎo)學(xué)生注重通過收集有效證據(jù),并基于證據(jù)進(jìn)行合理的推理。

