指向核心素養的高三化學復習教學
——以“鐵及其重要化合物”二輪復習教學為例
李愛玲
(南安市僑光中學,福建 南安 362314)
化學學科核心素養包括“宏觀辨識與微觀探析”“變化觀念與平衡思想”“證據推理與模型認知”“科學探究與創新意識”“科學態度與社會責任”。[1]通俗地說,指向化學學科核心素養的教學就是要培養學生能適應個人發展和社會發展的需要,具有化學學科特色的正確價值觀、關鍵能力和必備品格。為實現化學學科核心素養的教學目標,課堂教學尤為重要。筆者以“鐵及其重要化合物”高三化學二輪復習教學為例,探討如何在課堂中培養學生的化學學科核心素養。
一、指向學科核心素養的高三化學復習教學脈絡構建
(一)基于化學學科核心素養的教學結構
(二)以問題推進知識體系的完整
化學學科核心素養的培養要以化學知識的認知為基礎。“鐵及其重要化合物”復習教學是對已有零散知識掌握的基礎上,創設生活情景引入,以問題的形式層層推進,學生通過對問題的分析與探究,使知識結構系統化。
二、指向學科核心素養的高三化學復習教學實踐
[情景1]多媒體投影:補鐵藥——速力菲。主要成分:每片含0.1g琥珀酸亞鐵;性狀:本品為薄膜衣片,去除薄膜后顯淺棕色或淡褐色;適應癥狀:用于缺鐵性貧血的預防及治療;儲藏:密封、避光、在干燥處保存;藥物相互作用:與維生素C同服有利于本品吸收。
[問題1]琥珀酸亞鐵為什么需要做成薄膜衣片?去除薄膜衣后藥品為什么是淺棕色或淡褐色?與維生素C同服有利于吸收的原因是什么?以上涉及何種化學反應類型?
設計意圖:通過創設生活情境,激發學生自主學習興趣。薄膜防止Fe2+被空氣氧化;Fe3+在維生素C作用下被還原成Fe2+,Fe2+是紅細胞中血紅蛋白的組成微粒。緊貼生活中貧血補鐵的實例,讓學生從宏觀上打破化學學習是純理論學習的意識,體會化學在現實生活中的廣泛應用,進而真正領略到將知識轉換為生產力的實用價值。
[問題2]提供試劑:速力菲、稀鹽酸、硫酸銅溶液、新制氯水、雙氧水、KSCN溶液、酸性KMnO4溶液。藥品“速力菲”中Fe2+會被空氣緩慢氧化,國家規定如果藥物中Fe2+有超過10%的被氧化即不可服用。為檢驗某“速力菲”中Fe2+是否被氧化,實驗室可選什么試劑檢驗?要證明“速力菲”中Fe2+未完全被氧化,需如何取樣檢驗?需加何種試劑將樣品溶解?再滴入何種試劑檢驗,有何現象?設計實驗方案。歸納Fe2+、Fe3+的相互轉化的條件是什么?
設計意圖:讓學生在探究中掌握了Fe2+、Fe3+的相互轉化條件及檢驗,培養學生的基本實驗技能,激發學生的學習興趣。通過分組討論設計“速力菲”中Fe2+未完全被氧化的實驗方案,培養學生交流、互相合作及自主學習的能力。同時也培養了學生化學語言的表達能力及分析、歸納等素養。
[情景2]實驗室采用H2SO4酸化KMnO4溶液,對“速力菲”中的Fe2+進行滴定(假設藥品中,其他成分不與KMnO4反應。請完成下列離子方程式:Mn04-+____ Fe2++____ H+= _____ +_____ Fe3++ ____ H2O
設計意圖:陌生情境下氧化還原反應的離子方程式書寫是學生的難點,也是近幾年全國高考的熱點,課堂訓練有助于學生建立氧化還原反應的離子方程式書寫的模型,并能運用模型解決化學問題。
[情景3]孔雀石的主要成分為Cu2(OH)2CO3,還含少量硅的氧化物和鐵的氧化物。實驗室以孔雀石為原料制備CuSO4·5H2O晶體的步驟為:取少量孔雀石研磨,加足量試劑A浸泡,得溶液a;往溶液a中加入試劑B得溶液b;再往溶液b中加入試劑C得固體C和CuSO4溶液。
[問題3]試劑C的使用目的是調節溶液pH,使Fe3+轉化為沉淀予以分離。試劑C宜選用 (填選項序號)。
A.稀硫酸 B.NaOH溶液
C.氨水 D.CuO
常溫下Fe(OH)3的Ksp=1×10-39,若要將溶液中的Fe3+轉化為Fe(OH)3沉淀,使溶液中c(Fe3+)降低至1×10-3mol·L-1,必需將溶液pH調節至______ 。
設計意圖:含Cu2+、Fe3+的溶液中,將Fe3+轉化為沉淀予以分離,要使溶液PH升高且不引入新的雜質離子,可加CuO與氫離子反應。除外還可加氫氧化銅和堿式碳酸銅。溶液中的Fe3+轉化為Fe(OH)3沉淀時,溶液中的Fe(OH)3達到沉淀溶解平衡。根據Fe(OH)3沉淀溶解平衡常數Ksp=1×10-39= c(Fe3+)×C3(OH-)可得c(OH-)=1×10-12mol·L-1即pH=2。能從所給的信息中提取有用信息,進行必要的分析、計算,使得學生對知識了解層次上升到理解應用層次。運用化學原理解決一些具體的化學問題,這也是必備的核心素養。
[情景4]如何證明不足FeCl3和過量KI反應存在限度。
實驗思路:Fe3+具有氧化性,I-具有還原性,發生反應為2Fe3++2I-2Fe2++I2。
學生分組討論,代表發言實驗設計方案:①取少量FeCl3和KI混合溶液于試管中,滴入KSCN溶液。若溶液變紅則存在Fe3+。②取少量FeCl3和KI混合溶液于試管中,加入四氯化碳振蕩。若下層呈紫紅色,則有I2生成。
[問題4]如何證明該可逆反應存在平衡移動?
設計意圖:學生前面已掌握Fe2+、Fe3+的檢驗方法,現在證明FeCl3和過量KI該可逆反應存在平衡移動,可在上述實驗①中滴加AgNO3溶液,Ag+與I-生成難溶的AgI,平衡逆移,c(Fe3+)增大,生成Fe(SCN)3量多,可觀察到溶液紅色加深。通過實驗使學生知識從淺層上升到深層,同時體現了化學的變化和平衡,這是我們研究化學的核心思維方式。
[情景5]請根據2Fe3++2I-2Fe2++I2設計原電池(兩個半電池)。
設計意圖:根據原電池工作原理確定兩個電極材料、兩個半電池的電解質溶液,并通過鹽橋形成閉合回路。設計原電池診斷學生對原電池的認識發展水平,進一步加強學生對原電池的構成條件的透徹理解,使學生的知識掌握呈螺旋式上升。提升了學生的科學探究能力。
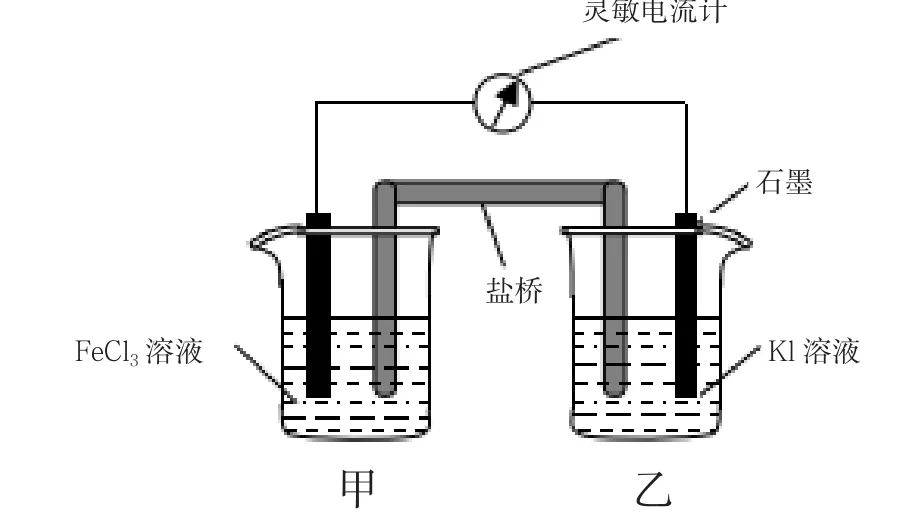
[問題5]甲中石墨電極為什么不能改為鐵電極?電流計讀數為零時,反應是否達到化學平衡狀態?電流計讀數為零后,在甲中溶入FeCl2固體,乙中石墨電極充當原電池的什么極?
設計意圖:運用氧化還原反應及化學平衡移動知識解答化學能與電能的轉化,培養學生對知識的綜合利用能力,讓學生對知識加工、消化、吸收,并在該基礎上升華到通過知識獲得教育。
三、指向學科核心素養的高三化學復習教學反思
(一)從宏觀辨識與微觀探析角度反思
經過一輪復習學生已經掌握了鐵及其化合物的主要性質(以鐵元素的化合價變化的宏觀表現),初步形成了學習元素化合物性質的思路,但是知識相對零散,不成體系,思維留于表面,深度思考少;且一輪復習耗時長、講練多,師生互動、實驗探究少,復習課堂沉悶。二輪復習,需通過改變教學策略,利用化學實驗來增強感性認識,把知識從課內延伸到課外,激活學生的思維和課堂的積極性。微觀角度理解2Fe3++2I-2Fe2++I2,指導學生學會用理論解釋元素化合物中的反應現象,形成“宏觀辨識與微觀探析”素養。最終達到幫助學生融會貫通所學知識,建構化學思維模型。
(二)從科學探究與創新意識角度反思
化學是一門實驗為基礎的學科,我們要想認識化學物質,進行科學的實驗探究尤為重要。通過創設生活情境,引導學生自主探究,充分表達了化學來源于生活,又服務于生活的特點,幫助學生樹立科學的學科觀念。高三課堂有效復習教學的重心就是幫助學生從簡單的記憶轉移到深層概念的理解與應用,將化學思維方式融入學生的核心素養培養中。本節課充分開發教學資源,挖掘學生的潛能,促進學生學會自主學習;教會學生分析新情景問題的方法,提升化學思維能力。
(三)從變化觀念與平衡思想角度分析
學生的知識認知水平是一個變化的過程。從生活情景入手學生易于接受,不足之處在于隨著知識的層層遞進及綜合度的提高,有部分基礎較差的學生有點吃力。因此,該部分學生課后還應加強學習方法的指導。

