基于環介導等溫擴增技術對人乳頭瘤病毒的分型檢測
孫萌,柴蕊,張亞蘭
北京城市學院 生物醫藥學部,北京 100083
宮頸癌是威脅婦女健康的主要疾病之一,被認為是全球性公共衛生問題,是發展中國家最常見的癌癥,世界上每2 min就會有1個婦女死于宮頸癌[1]。而人乳頭瘤病毒(human papillomavirus,HPV)持續感染是宮頸癌和一些生殖器瘤樣病變的主要原因。HPV有多種基因型,目前已知100多種,其中30余種可從受感染的生殖道組織中分離出來[2-4]。根據病毒致癌性的大小,可將HPV分為低危型(非癌相關型,包括HPV6、11、42、43和一些新型HPV)和高危型(癌相關型,包括 HPV16、18、31、33、35、39、45、51、52、56、58、59、66、68)[5-6]。近10年來我國宮頸癌的發病率穩步上升且趨于年輕化,故對宮頸癌及癌前病變的早期發現、早期診斷、早期干預顯得非常必要。
發達國家宮頸癌的篩查流程多為HPV檢測和細胞學檢查同時進行,異常者轉陰道鏡檢查,可疑病變定點活檢,隨訪以HPV檢測和細胞學檢查為主[7-12]。環介導等溫擴增技術(loop-mediated isothermal amplification method,LAMP)是一種新型體外等溫擴增特異性核酸片段的技術,該技術主要利用2對特殊引物和具有鏈置換活性的DNA聚合酶在一定條件下進行反應,只需把基因模板、引物,鏈置換DNA合成酶等共同置于一定溫度(60~65℃)下,可在15 min至1.5 h內出現109~1010倍的擴增。LAMP技術針對HPV的DNA檢測,具有較高的特異性,操作簡單、快速高效。通過LAMP完成HPV分型是一種快速檢測HPV亞型的方法,對宮頸癌及癌前病變篩查具有重大意義,可為臨床宮頸病變的診治提供依據。HPV高危型有多種,除HPV59、HPV66、HPV68這3種亞型,其他高危型已經可以通過LAMP檢測出來。因此,我們選取高危型HPV59、HPV66、HPV68作為實驗樣本開展研究。
1 材料和方法
1.1 材料
臨床HPV樣本購自浙江殷欣生物技術有限公司;微流控芯片、微流控芯片核酸分析儀由博奧生物集團有限公司提供;ABI7500實時熒光定量PCR儀購自上海智巖科學技術有限公司;LAMP DNA擴增試劑盒購自上海信裕生物技術有限公司;引物由上海生物工程有限公司合成。
1.2 特異性靶序列篩選
登陸NCBI官網,檢索HPV59、HPV66、HPV68亞型全基因組序列,并將其所對應的所有毒株序列分類下載。HPV亞型是根據其基因的L1和L2區的不同核酸序列進行命名。用核酸分析軟件DNAMAN對HPV59序列進行多序列比對,選取變異少的L1、L2區序列并對該序列進行Blast比對,選定高特異性的HPV59靶序列片段。HPV66、HPV68片段選擇同HPV59。如圖1。
1.3 特異性引物設計
根據選定的特異性靶序列設計相應的引物組合(表1),并根據引物組合設計該組的頸環引物(LF、LB)。
1.4 引物溶解與混合
引物合成后按照說明書填寫引物補水單,計算初次補水量。引物補水前12 000 r/min離心10 min,在超凈工作臺里按照補水單一一對應補加適量的滅菌水,充分振蕩混勻,瞬時離心,于4℃放置2.5 h,使之完全溶解。用分光光度計測定每條引物的核酸濃度,清潔光纖表面,加2 μL滅菌水到光纖表面,放下檢測壁,用濾紙將水吸干,如此可保證BLANK準確。吸取1.5 μL滅菌水加到下光纖表面,放下檢測壁,點擊BLANK做空白對照。加樣測量,將1.5 μL核酸加到下光纖表面,放下檢測壁,輸入樣本編號,點擊Measure測量。將測量結果輸入補水單,計算二次補水量。引物補二次水,在超凈工作臺里按照補水單一一對應補加適量的滅菌水,充分振蕩混勻,瞬時離心,放置-20℃待用。引物溶解后,在EP管上標記好要配制的混合引物的名稱,加入35 μL水,然后依次加入24 μL FIP、BIP,10 μL LB、LF,3 μL F3、B3,振蕩混勻,瞬時離心,-20℃保存。

圖1 選定的特異性靶序列
1.5 引物初篩
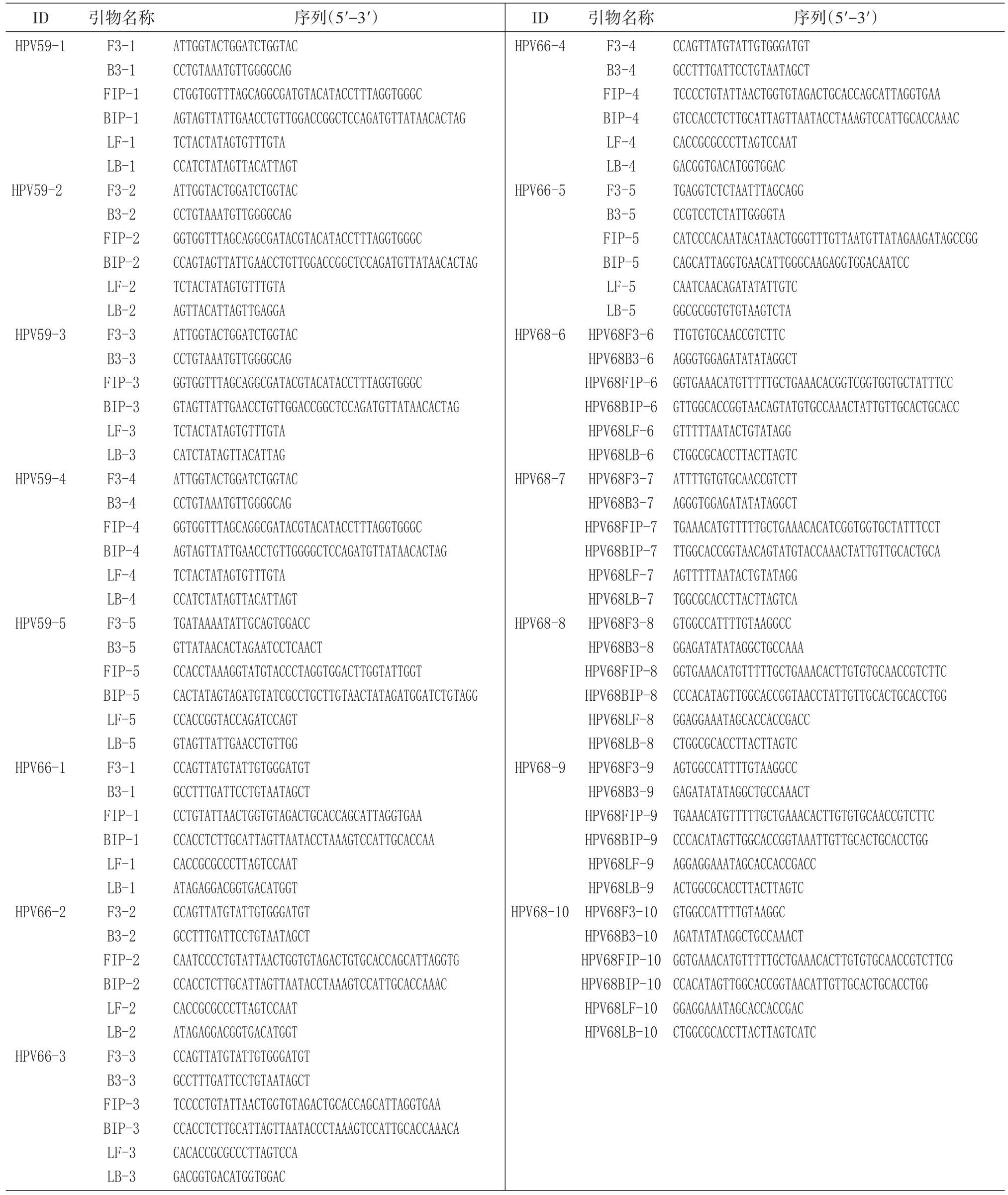
表1 引物組合及序列
將 HPV59、HPV66、HPV68質粒濃度由 1×109拷貝/μL梯度稀釋到1×105拷貝/μL,吸取5.24 μL稀釋后的質粒水溶液與3.67 μL LAMP擴增試劑混合,然后加入1.09 μL混合引物,振蕩,瞬時離心。陰性對照只須將質粒換成滅菌水。將8聯排管放入ABI7500實時熒光PCR儀,打開軟件編輯程序,啟動擴增程序。
1.6 環介導等溫擴增技術引物靈敏度的檢測
分析引物初步篩選結果,選擇在1×105拷貝/μL條件下擴增出峰時間較早的引物進行靈敏度篩選。將HPV59、HPV66、HPV68質粒濃度由1×109拷貝/μL梯度稀釋至1×103、1×102拷貝/μL。吸取5.24 μL稀釋后的質粒水溶液與 3.67 μL LAMP擴增試劑混合,然后加入1.09 μL混合引物,振蕩,瞬時離心。陰性對照只須將質粒換成滅菌水。將8聯排管放入ABI7500實時熒光定量PCR儀,打開軟件編輯程序,啟動擴增程序。
2 結果
2.1 引物初篩
對HPV59、HPV66、HPV68通過選取對應核酸片段的LAMP結果見圖2。使用設計的5組HPV59引物,在1×105拷貝/μL初篩質粒濃度下,擴增曲線出峰時間應在20 min,只有HPV59-2、HPV59-5較好,其他幾條幾乎沒有擴增。HPV66引物設計了5組,初次篩選只有HPV66-2、HPV66-5擴增效果較好,其他出峰時間較晚,均不符合。HPV68引物設計了10組,其中HPV68-4、HPV68-10擴增結果較好。以上初篩選出的6組引物可作為下一步靈敏度檢測的參考。
2.2 引物靈敏度檢測
根據引物初篩結果,HPV59-5的出峰時間早于HPV59-2,所以選擇HPV59-5進行靈敏度檢測,結果見圖 3。1×103拷貝/μL HPV59-5 擴增曲線出峰時間為37 min,1×102拷貝/μL HPV59-5擴增曲線出峰時間為33 min,且只有一條可出峰,陰性對照曲線沒有擴增,由此可以得出HPV59-5的檢測下限為1×102拷貝/μL。
根據引物初篩結果,HPV66-2、HPV66-5的靈敏度檢測結果見圖 4。1×103拷貝/μL HPV66-2擴增曲線出峰時間在30 min左右,1×103拷貝/μL HPV66-5擴增曲線出峰時間在40 min左右,且這2種引物在1×102拷貝/μL均沒有擴增出,所以引物HPV66-2的靈敏度較好,HPV66-2的檢測下限為1×103拷貝/μL。
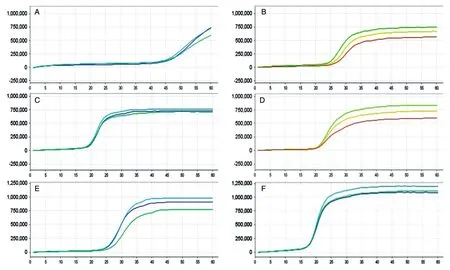
圖2 引物初篩結果
根據引物初篩結果,HPV68-4、HPV68-10的靈敏度檢測結果見圖 5。1×103和1×102拷貝/μL HPV68-4擴增曲線出峰時間都在46 min,1×103拷貝/μL HPV68-10擴增曲線出峰時間在25 min,1×102拷貝/μL HPV68-10擴增曲線出峰時間在40 min,早于引物HPV68-4,所以HPV68-10的靈敏度較好,檢測下限為1×102拷貝/μL。
2.3 微流控芯片對HPV樣本檢測
將篩選好的HPV59、HPV66、HPV68亞型擴增引物加入微流控芯片,并在芯片中加入LAMP反應所需試劑,即制成可檢測這3種亞型病毒的微流控芯片,配合微流控芯片核酸分析儀,即可實現對臨床樣本的快速分型檢測。取3個已知感染類型的臨床樣本,分別標記為HPV59、HPV66、HPV68亞型,用微流控芯片進行測試,擴增曲線斜率超過30,則說明擴增反應已發生,軟件自動判斷結果為陽性;否則,為陰性。出峰時間和峰值與擴增反應效率呈正相關。結果如圖6,A和B中橙色曲線代表實驗的陽性對照,綠色曲線代表檢測的目的指標HPV59和HPV66,藍色曲線代表人基因;C中紅色曲線代表實驗的陽性對照,綠色曲線代表檢測的目的指標HPV68,灰色曲線代表人基因(檢測HPV59、HPV66、HPV68樣本所使用的儀器不是同一臺,因此曲線顏色代表的內容不同)。可以看出,擴增曲線有明顯峰值出現,儀器顯示為陽性,微流控芯片對這3份樣本的檢測結果與樣本中HPV亞型的實際情況完全符合。
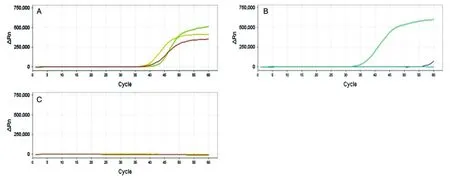
圖3 HPV59-5引物靈敏度檢測結果

圖4 HPV66-2、HPV66-5引物靈敏度檢測結果
3 討論
針對 HPV59、HPV66、HPV68亞型的基因序列,分別設計篩選出一套適合反應的LAMP引物,將引物加入微流控芯片,對3份實際HPV樣本進行檢測,可以準確檢測出樣本的HPV亞型。研究表明,可利用LAMP技術對HPV的亞型進行準確分型,但需要解決一系列技術問題,才能確保結果的準確性。首先,要有良好的引物設計。在引物設計篩選過程中,HPV59引物共設計了3次,樣本檢測結果表明最后一次設計的引物較好,要使LAMP的反應效率提高,關鍵在于讓4條引物在反應開始階段與靶基因發生雜合反應,因此篩選引物時除了避免假陽性反應外,還要選擇引物片段的大小,從而使Tm值處在一定范圍內,引物的Tm 值應滿足 F1c、B1c>F2、B2>F3、B3,且 F2和 B2的Tm值應該在BstDNA聚合酶的催化溫度范圍內,即60~65℃。F1c和B1c的Tm值要高于F2和B2的Tm值,這樣從模板DNA上釋放的DNA單鏈能夠更快速地形成環狀結構;而F2和B2的Tm值要高于F3和B3,從而保障內引物與靶基因的結合先于外引物。其次,在樣本檢測過程中要設法排除干擾因素,并控制好反應條件。例如,開始時是直接將HPV樣本加入微流控芯片進行檢測,但檢出率很低,外對照出峰時間很晚,甚至擴增不出來。經分析認為可能是由于樣本中干擾成分過多,對LAMP擴增的抑制作用過大。后將HPV樣本進行適當的前處理,再加入濃縮全集成芯片進行檢測,檢出率明顯提高。另外,考慮到溫度會影響引物的反應,將微流控核酸分析儀的反應溫度降低了2℃,將之前沒有檢出的樣本在此條件下再次進行檢測,有的樣本可被檢測為陽性。總之,在良好引物設計的基礎上,通過優化檢測條件,利用微流控芯片可以準確檢測出臨床樣本中HPV的亞型。將LAMP技術與微流控芯片整合并用于HPV的分型檢測,不僅可獲得較高的靈敏度和特異性,還具備指標通量高、檢測時間短等優勢,預期在臨床上有較好的應用前景。
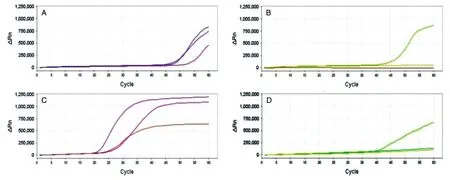
圖5 HPV68-4、HPV68-10引物靈敏度檢測結果
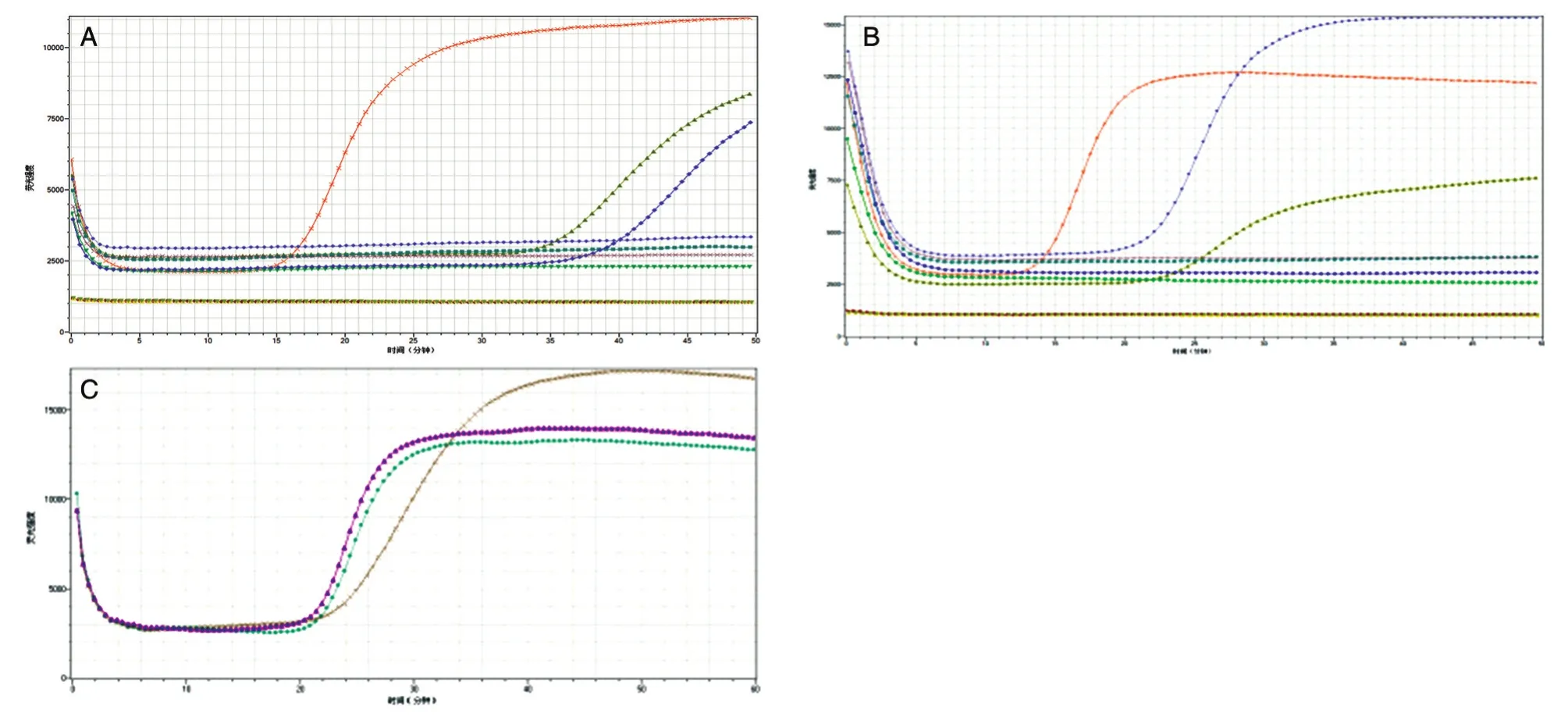
圖6 HPV樣本檢測結果

