芽孢桿菌BU108的分離鑒定及對馬鈴薯瘡痂病的防治
宋 燁,向君亮,申永瑞,王佳琦,劉 權,殷奎德
(黑龍江八一農墾大學 生命科學技術學院,黑龍江 大慶163319)
馬鈴薯Solanum tuberosum是中國主要的糧食作物,黑龍江省的馬鈴薯種植面積一直居于前列,但近年來由瘡痂鏈霉菌Streptomyces scrabies引起的馬鈴薯瘡痂病日益嚴重,直接影響馬鈴薯的品質,造成了較大的經濟損失[1]。馬鈴薯瘡痂病首先會在馬鈴薯表面產生褐色的點狀斑塊,隨著馬鈴薯的生長,點狀斑塊會隨之擴大形成褐色圓形或不規則形的大斑塊,感染后期斑塊處細胞木栓化,致馬鈴薯表面形成凹陷或凸起的瘡痂狀粗糙硬斑塊,嚴重影響馬鈴薯的外觀品質和經濟價值[2]。長期以來,馬鈴薯瘡痂病的防治大多采用化學農藥的方法,雖然短期內防治效果顯著,但長期使用不僅污染環境和危害人類健康,還會造成土壤中的菌群失調,使得病原菌缺乏有效抑制而導致病害發生更加嚴重[3]。生物防治是馬鈴薯瘡痂病防治的一個熱點和趨勢,該方法利用微生物及其分泌物來抑制病害的發生,不會對環境造成污染,是一種友好型的病害防治方法。目前,已報道了多種能夠對馬鈴薯瘡痂病具有防治效果的拮抗菌株,其中以芽孢桿菌Bacillus占多數,抑制效果也更加顯著[4-5]。但是在前人利用芽孢桿菌作為生防菌防治植物病害的研究中,卻發現有些生防菌株會出現異地防治效果不理想的狀況,究其原因可能與菌株在土壤中的定殖能力以及受土壤中土著微生物的抑制有關[6-11]。生防菌株施用到土壤中,會面臨生存環境的改變,抑菌物的分泌量可能會受到影響,進而影響生防菌株的抑菌效果。此外,不同地區土壤的菌群結構也存在差異,導致一個地區的生防菌株在另一個地區施用可能會由于不適應新的微生物菌群結構及生態環境,同樣發揮不了理想的生物防治效果[12]。鑒于此,本研究從黑龍江省當地馬鈴薯瘡痂病發病土壤中篩選鑒定適宜本地生態環境及土壤菌群結構的拮抗菌,對菌株的培養條件進行優化,通過盆栽實驗檢驗菌株的實際防治效果,旨在為該菌應用到馬鈴薯瘡痂病的生物防治提供理論依據。
1 材料與方法
1.1 材料
1.1.1 指示菌 病原菌瘡痂鏈霉菌由本實驗室保存提供。
1.1.2 樣品 土樣采自黑龍江省克山縣馬鈴薯發病地塊;馬鈴薯品種為 ‘大西洋’Solanum tuberosum‘Atlantic’。
1.1.3 培養基 YME 固體培養基: 麥芽糖 10.0 g·L-1, 酵母提取物 4.0 g·L-1, 葡萄糖 4.0 g·L-1, 瓊脂20.0 g·L-1, pH 7.2; LB 固體培養基: 氯化鈉(NaCl)10.0 g·L-1, 蛋白胨 10.0 g·L-1, 酵母浸粉 5.0 g·L-1,瓊脂 20.0 g·L-1, pH 7.5; 發酵條件優化基礎培養基[13]: 葡萄糖 10.0 g·L-1, 蛋白胨 10.0 g·L-1, 氯化鈉 10.0 g·L-1,磷酸二氫鉀(KH2PO4)1.5 g·L-1,硫酸鎂(MgSO4·7H2O)1.5 g·L-1。
1.2 生防菌株的分離鑒定
1.2.1 菌株的篩選 采集有傷病的馬鈴薯周圍的土壤帶回實驗室,土壤加水勻漿并倍比稀釋至10-6,把10-4,10-5,10-6倍的土壤稀釋液涂布。在平板上挑取單個菌落純化培養,保存分離到的單個菌株,在涂有鏈霉菌的平板上做抑菌實驗。
1.2.2 菌株的鑒定 形態觀察:顯微鏡觀察單菌的顏色、形狀、狀態。分子生物學鑒定:基于16S rDNA序列分析的生防菌株種屬鑒定。50.0 μL聚合酶鏈式反應(PCR)反應體系:2.0 μL細菌基因組DNA,4.0 μL 10 mmol·L-116S 引 物 27f: 5′-AGAGTTTGATCCTGGCTCAG-3′和 1492R:5′-TACCTTGTTACGACTT-3′, 1.2 μL 10 μmol·L-1三磷酸堿基脫氧核苷酸(dNTPs), 4.0 μL 50 mmol·L-1氯化鎂(MgCl2),5.0 μL 10×PCR緩沖液,0.3 μL DNA聚合酶。PCR擴增條件:95℃預變性3 min;95℃變性30 s,55℃退火30 s,72℃延伸90 s,40個循環,4℃無限循環。反應結果經8 g·L-1瓊脂糖凝膠電泳進行條帶檢測,純化后樣品送交上海生工完成測序。所獲得的堿基序列在美國生物技術信息中心(NCBI)數據庫中進行Blast同源性對比,利用MEGA 5軟件進行多序列比對并構建系統發育樹。
1.3 發酵條件的優化
1.3.1 發酵方法及抑菌粗提液的制備 根據種子培養基的營養條件,分別更換不同質量濃度和種類的碳源、氮源及不同比例的無機鹽離子和碳氮比(C/N)加入裝有50 mL發酵液培養基的100 mL的三角瓶中,改變培養菌株的發酵條件(培養溫度、pH值、培養時間等),將活化好的菌株接種到發酵液培養基中,37 ℃, 160 r·min-1恒溫振蕩培養 24 h 后。 菌液離心 4 min, 12 000 r·min-1, 菌液上清使用 0.22 μm 濾膜過濾后采用管碟法進行抑菌實驗。
1.3.2 抑菌活性的測定 抑菌活性的測定采用管碟法,把培養好的病原菌用涂布棒涂勻在已制作好的平板,在平板上放牛津杯加入抑菌物粗提液。抑菌活性通過測量抑菌圈的半徑,計算平均值比較大小進行確定。
1.3.3 適宜碳源的確定 根據培養基的營養條件,采用單因素多水平試驗設計方法,分別加入10.0 g·L-1的葡萄糖、乳糖、麥芽糖、蔗糖作為不同的碳源,其他因素同種子液培養基,重復5次·水平-1,采用管碟法測定抑菌活性確定適宜碳源的種類。
1.3.4 適宜氮源的確定 在適宜碳源試驗結果基礎上,根據培養基的營養條件,設計氮源單因素多水平試驗,分別加入10.0 g·L-1的蛋白胨、胰蛋白胨、大豆蛋白胨、酵母浸粉、牛肉粉作為不同的氮源,其他因素不變,重復5次·水平-1,采用管碟法測定抑菌活性確定適宜的氮源種類。
1.3.5 適宜C/N的確定 在適宜碳、氮源試驗結果基礎上,根據培養基的營養條件,設計C/N單因素多水平試驗, 選取 C/N 分別為 1∶1, 1∶2, 1∶3, 1∶4, 1∶5 進行發酵試驗, 其他因素不變, 重復 5 次·水平-1,采用管碟法測定的抑菌活性確定適宜的C/N。
1.3.6 無機離子正交試驗 在適宜碳、氮源及C/N試驗結果基礎上,根據培養基的營養條件,選擇培養基中的 KH2PO4, MgSO4·7H2O, NaCl為正交試驗因素,設計3水平3因素試驗(表1),設置空白項為對照(ck1)。 分別將不同水平的 KH2PO4, MgSO4·7H2O,NaCl加入發酵培養基中,培養基pH值調至
pH 7.0,其他因素不變,重復5次·水平-1,采用管碟法測定抑菌物活性確定適宜的無機離子。
1.3.7 最適pH值 在適宜碳,氮源,C/N,無機離子正交試驗結果基礎上,根據培養基的營養條件,設計初始最適pH值單因素多水平試驗,分別調節初始pH值為pH 5,pH 6,pH 7,pH 8,pH 9,重復5次·水平-1,采用管碟法測定抑菌活性確定適宜的pH值。
1.3.8 最適溫度 在適宜碳,氮源,C/N及pH值,無機離子正交試驗結果基礎上,根據培養基的營養條件,設計培養溫度單因素多水平試驗,分別調節初始溫度為22,28,32,37,44℃,重復5次·水平-1,采用管碟法測定抑菌活性確定最適溫度。
1.3.9 培養時間 在上述最佳培養條件確定基礎上,根據培養基的營養條件,設計培養時間單因素多水平試驗,分別設置8,10,12,14,16,18,20,22,24,26,28和30 h的培養時間,重復3次·水平-1,采用管碟法測定的抑菌活性確定適宜的培養時間。
表1 無機離子實驗因素質量濃度表Table 1 Level of orthogonal experimental factors of inorganic ions
1.4 菌株BU108對馬鈴薯瘡痂病的防效盆栽實驗
實驗在黑龍江八一農墾大學大慶市重點實驗室中進行,采用盆栽實驗,實驗用盆缽為28 cm×20 cm的聚乙烯塑料盆,缽裝風干土為3 kg·盆-1,裝入馬鈴薯瘡痂病發病土壤。選取健康的有芽馬鈴薯,用清水沖洗干凈,切成三角塊,在盆缽土壤中植入2塊有芽馬鈴薯,芽尖向上。同時制備發酵培養基,接種BU108生防菌。設置3組處理,重復6次·處理-1,分別為對照(ck2),低濃度BU108(1×108cfu·m-2)和高濃度BU108(1×1010cfu·m-2)。各個處理中菌液最終施用量為100 mL,在栽種時加入菌液,之后不再添加,栽種前澆水1 000 mL。根據馬鈴薯生長情況定量加水,待馬鈴薯成熟后,進行病斑數的統計與分析。
2 結果與分析
2.1 土壤中菌株的分離篩選和鑒定
從有病害馬鈴薯根際土壤中分離得到200余株菌株,命名按BU1,BU2,BU3等依次排列,對所有得到的菌株進行抑菌實驗。結果顯示:BU108與其他菌株相比抑菌圈半徑最大,抑菌效果最為明顯(圖1)。BU108菌落形態白色不透明,邊緣不整齊、干燥、中間有星狀皺起;在液體培養基中色暗、皺褶、完整的膜、輕度混濁,可知BU108對瘡痂鏈霉菌有抑菌效果。在16S rDNA序列分析的基礎上進行NCBI序列比對,找到與目的菌株相似度最為接近的堿基序列。應用MEGA5軟件對這些堿基序列進行分析,構建系統進化樹。從圖2可以看出:BU108屬于芽孢桿菌屬,但與目前鑒定到的芽孢桿菌種之間存在不同,與Bacillus sp.(KT583425.1)親緣關系最近。
2.2 培養條件的優化
2.2.1 適宜碳源的選擇 分別用葡萄糖、麥芽糖、乳糖、蔗糖代替培養基中的葡萄糖。結果顯示:抑菌實驗的半徑平均值分別為11,7.6,7.8和8.2 mm。由圖3可知:當葡萄糖作為碳源時,抑菌效果最為明顯。由方差分析可知:組內間的差異較小,而且葡萄糖與其他的碳源有極顯著差異(P<0.01),因此確定葡萄糖為最佳碳源。
2.2.2 適宜氮源的選擇 在最佳碳源確定的基礎上,分別用胰蛋白胨、蛋白胨、大豆蛋白、牛肉粉、酵母浸粉代替培養基中的蛋白胨。結果(圖4)顯示:抑菌實驗的半徑平均值分別為6.8,6.6,6.4,7.2和8.6 mm。當酵母浸粉作為氮源時,抑菌效果最為明顯。由方差分析可知:酵母浸粉與其他的氮源有極顯著差異(P<0.01),因此確定酵母浸粉為最佳氮源。
2.2.3 適宜C/N的選擇 碳源和氮源之間的比例對微生物的生長和代謝同樣重要。 在最佳碳、 氮源確定的基礎上, 設置 C/N 為 1∶1, 1∶2, 1∶3, 1∶4, 1∶5。 結果顯示(圖 5): 抑菌圈的半徑平均值分別9.0,12.5,7.3,7.8和7.0 mm。當C/N為1∶2時抑菌效果最為明顯,與方差分析組內間的差異較小,與其他組間有極顯著差異(P<0.01),因此確定最佳C/N為1∶2。
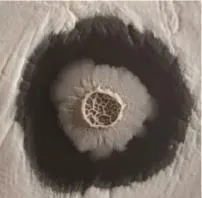
圖1 BU108抑制瘡痂鏈霉菌Figure 1 Inhibiton of BU108 against Streptomyces scabies
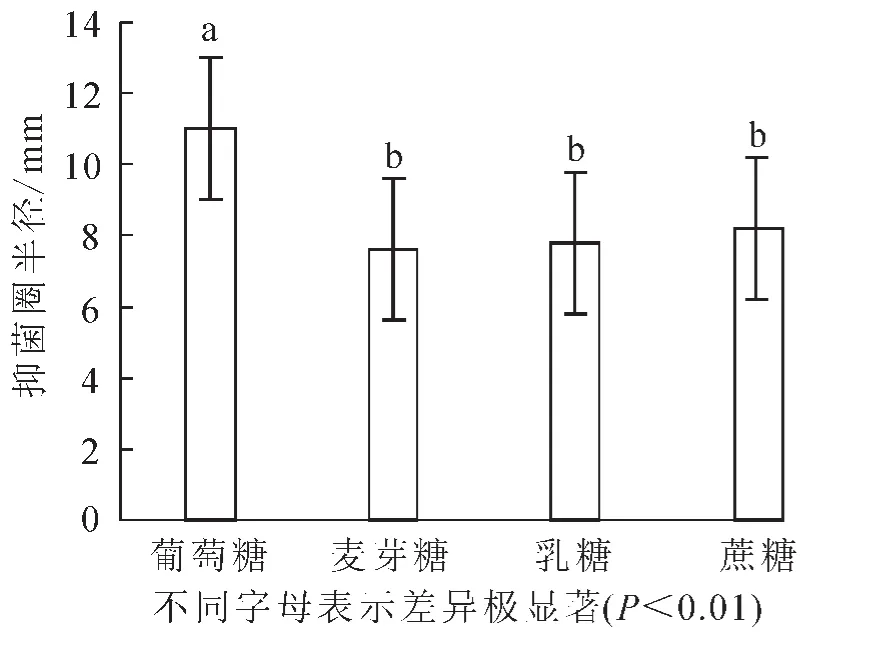
圖3 碳源對芽孢桿菌BU108抑菌活性的影響Figure 3 Effect of carbon source on the activity of Bacillus BU108
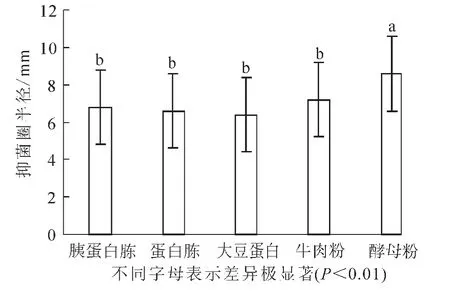
圖4 氮源對芽孢桿菌BU108抑菌活性的影響Figure 4 Effect of nitrogen source on the activity of Bacillus BU108
2.2.4 適宜的無機離子 在最佳碳源、氮源和C/N確定的基礎上改變無機離子的濃度,并檢測無機離子對抑菌活性影響。由表2可知:NaCl對抑菌效果影響最大,極差R大小依次為NaCl>MgSO4·7H2O>KH2PO4>ck。由表3可知:NaCl對抑菌物的產生影響最大,影響最小的為KH2PO4。可見,NaCl質量濃度為5.0 g·L-1時對菌株的抑菌效果最佳。
2.2.5 最適pH值 在最佳碳源、氮源和C/N及無機離子比例確定的基礎上,改變培養基pH為5,6,7,8,9。結果(圖6)顯示:抑菌圈的半徑平均值分別為9.0,9.6,9.8,12.4和8.4 mm。當pH為8時,抑菌效果最為明顯,由方差分析可知各個組內間的差異較小而且pH為8時與其他組有極顯著差異(P<0.01),因此確定pH 8是最佳pH值。
2.2.6 培養溫度 在最佳碳源、氮源、C/N和無機離子比例及pH確定的基礎上,設置培養溫度為22,28,32,37,44℃。結果(圖7)顯示:抑菌圈的半徑平均值分別為9.0,12.6,9.0,8.2和7.0 mm。芽孢桿菌BU108在22,32,37℃下生長良好,在44℃下生長一般,28℃下生長情況最佳。由方差分析可知:培養溫度為28℃時組內間的差異較小,與其他組相比具有極顯著差異(P<0.01),因此28℃為最佳培養溫度。
2.2.7 培養時間 培養時間過長營養物質消耗殆盡不利于菌株的生長,時間過短微生物代謝物質的分泌量不足影響菌株的抑菌效果。在最佳碳源、氮源、C/N、無機離子比例和pH值及培養溫度確定的基礎上,設置培養時間為8,10,12,14,16,18,20,22,24,26,28和30 h。結果顯示(圖8):抑菌實驗的半徑平均值分別5.2,5.2,6.7,7.2,7.7,8.3,8.7,11.7,9.0,7.7,7.0和6.3 mm。22 h時抑菌半徑最大,抑菌效果最好。由方差分析可知:組內間的差異較小,與其他組相比具有極顯著差異(P<0.01),因此最適培養時間為22 h。

圖5 C/N對芽孢桿菌BU108抑菌活性的影響Figure 5 Effect of C/N on the antagonistic activity of Bacillus BU108
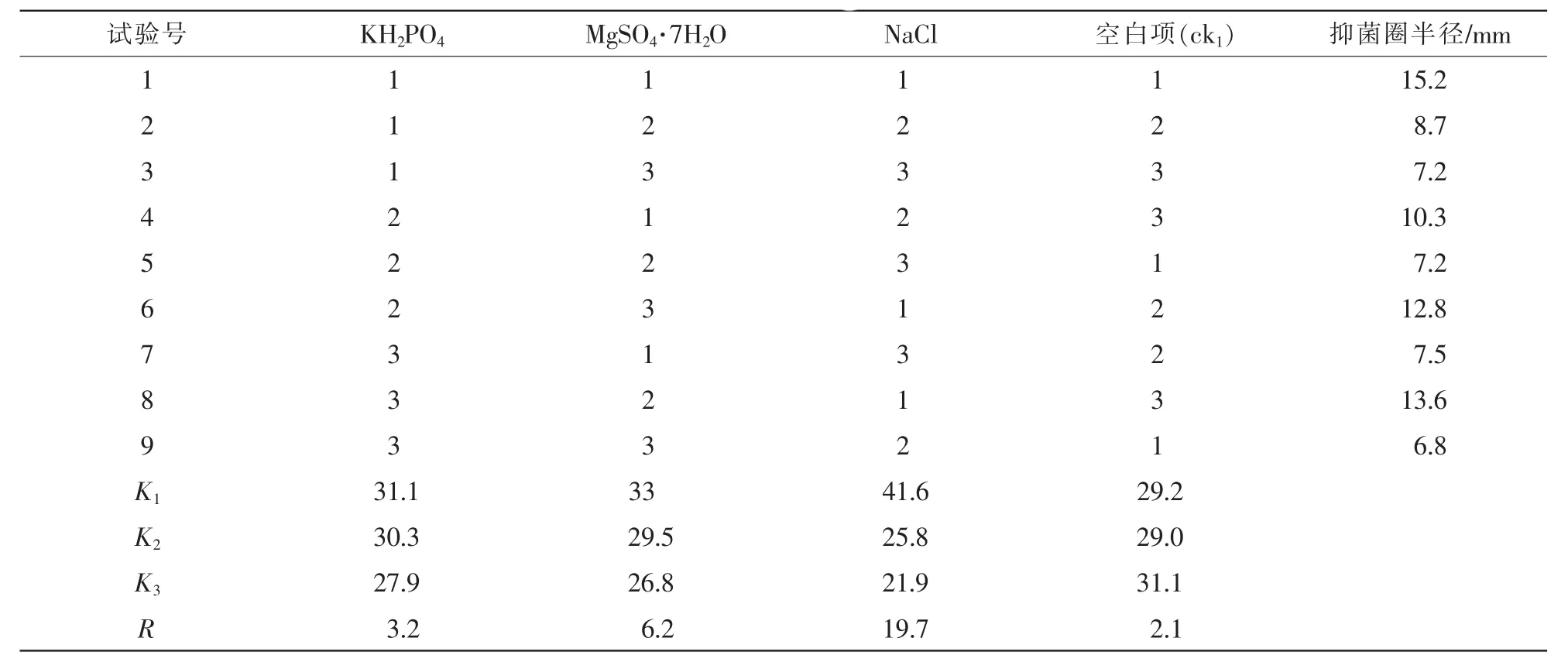
表2 無機離子對抑菌活性影響的正交試驗結果Table 2 Results of orthogonal tests on the effect of inorganic ions on the yield of antimicrobial agents
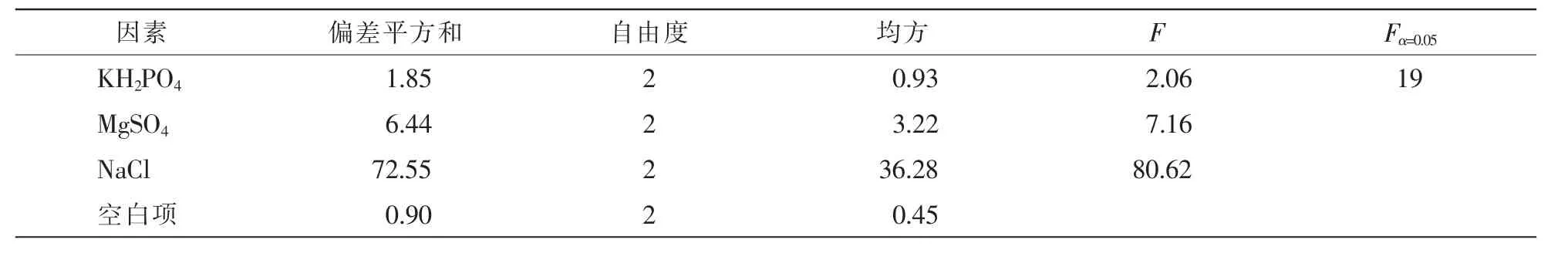
表3 無機離子對抑菌活性影響的方差分析Table 3 Variance analysis of the effect of inorganic ions on antibacterial activity
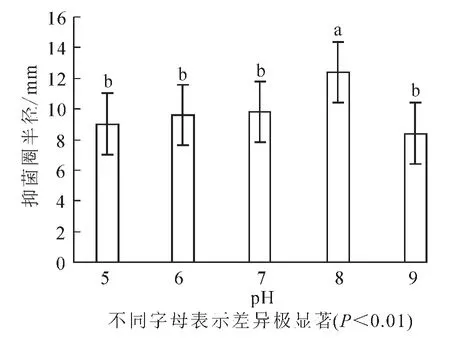
圖6 pH對芽孢桿菌BU108抑菌活性的影響Figure 6 pH effect on the antibacterial activity of Bacillus BU108
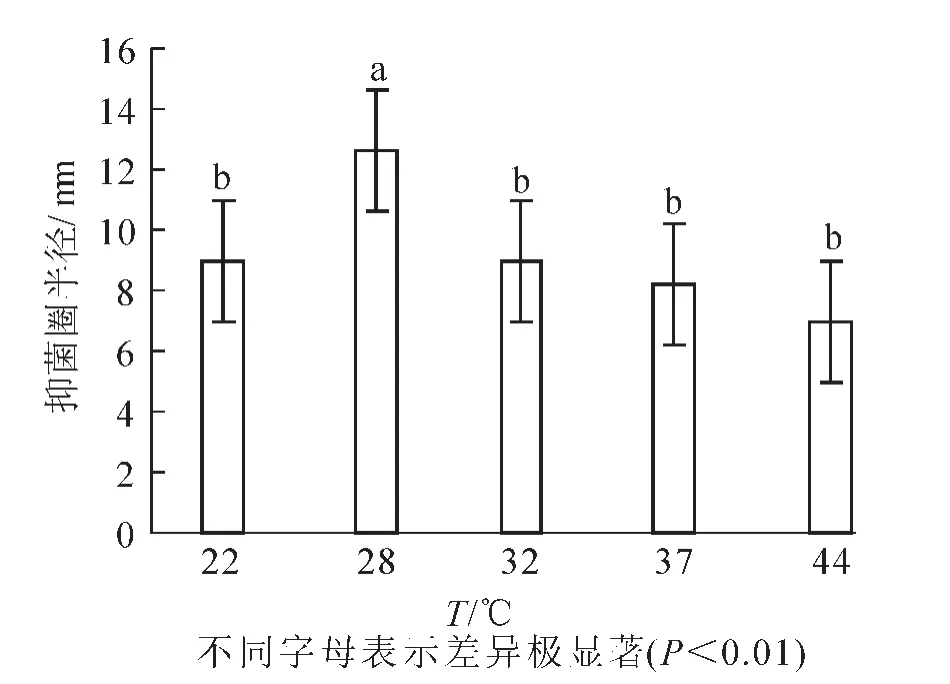
圖7培養溫度對芽孢桿菌BU108抑菌活性的影響Figure 7 Effect of culture temperature on the antibacterial activity of Bacillus BU108
2.3 菌株BU108對瘡痂病的防治效果
對3組處理的盆栽實驗的病斑數進行統計(圖9):對照組的病斑數平均值為12.0,高濃度BU108組的病斑數平均值為1.0,低濃度BU108組的病斑數平均值為8.3。由方差分析可知:高濃度BU108組與其他組別間有極顯著差異,抑制率為91.6%。低濃度BU108組與對照之間有極顯著差異(P<0.01),抑制率為30.8%。表明芽孢桿菌BU108能夠抑制馬鈴薯瘡痂病的發生,且濃度越高,抑制效果越好。
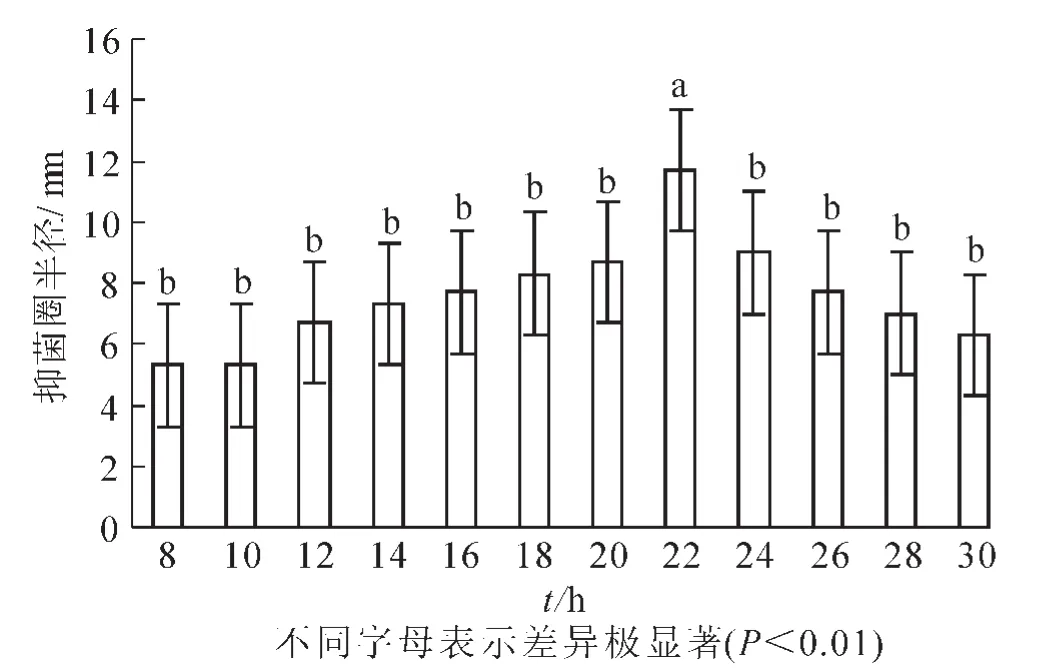
圖8 培養時間對芽孢桿菌BU108抑菌活性的影響Figure 8 Effect of culture time on the antibacterial activity of Bacillus BU108
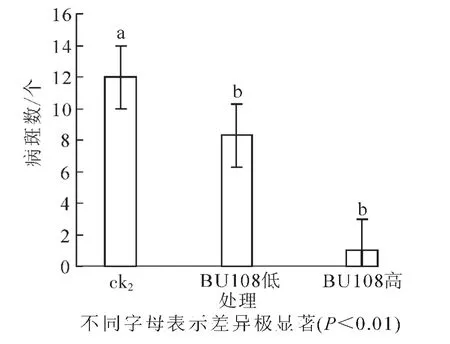
圖9 芽孢桿菌BU108對馬鈴薯瘡痂病的影響Figure 9 Effect of Bacillus BU108 on potato scab
3 結論與討論
本研究通過平板涂布法、平板劃線法分離單菌,利用本實驗室提供的病原菌篩選拮抗菌,對200余株菌株做抑菌實驗,測量抑菌圈的半徑,發現菌株BU108抑菌圈半徑最大,抑菌效果最為明顯。通過形態學觀察和菌株的進化樹分析,初步確定BU108屬于芽孢桿菌。因BU108與目前已知的芽孢桿菌序列之間存在較大不同,無法歸類到具體的種。
通過搖瓶發酵對芽孢桿菌BU108抑菌活性物質的培養條件進行了研究,BU108的最佳培養條件:碳源為葡萄糖, 氮源為酵母浸粉,C/N為1∶2,無機離子KH2PO4為 0.5 g·L-1,MgSO4·7H2O為0.5 g·L-1,NaCl為5.0 g·L-1,pH 8,培養時間為22 h,培養溫度為28℃。有些生防菌的最佳碳源為葡萄糖、氮源為大豆餅粉[14-15],最佳的pH偏酸性[16],而BU108的最佳碳源為葡萄糖、氮源為酵母浸粉,在偏堿性條件下生長良好并且抑菌效果最佳。證明其培養條件的不同對芽孢桿菌BU108菌株抑菌物的產生有很大影響。無機離子質量濃度對BU108菌株抑菌物的產生也有很大影響,在本研究中無機離子質量濃度最小時,抑菌效果最好。由此可見,生防菌株不同其培養條件相差很大,每個菌株都有其相應的營養要求和培養方式。
本研究采用盆栽實驗檢驗了菌株BU108對馬鈴薯瘡痂病的抑制效果。實驗設置了不同濃度的生防菌發酵液處理土壤,發現抑菌效果與發酵菌液的濃度之間存在正相關,發酵液濃度高的處理組其抑菌效果也高。原因可能是低濃度的發酵液菌數少則抑菌物分泌量也相對較少,抑制率也低。本研究確定了BU108在土壤中具有抑制瘡痂病發病的效果,可以作為生物防治的候選。本次盆栽試驗為了保證馬鈴薯發病,盆栽土壤采用馬鈴薯瘡痂病發病土壤,馬鈴薯發病和生防菌抑菌效果表現良好,但是在實際應用中面對復雜的土壤微生物,能否取得理想效果還有待檢驗。
在前人利用芽孢桿菌防治植物病害的研究中,芽孢桿菌多與其他微生物或藥劑共同使用[17-20]。在今后的實際應用中也可以嘗試與其他生防菌組合使用,增強對馬鈴薯瘡痂病的抑制效果。
4 參考文獻
[1] 郝智勇.馬鈴薯種薯瘡痂病成因及防治措施[J].黑龍江農業科學,2017(1):158-159.HAO Zhiyong.Formation factors and prevention measures of potato scab [J].Heilongjiang Agric Sci,2017(1):158-159.
[2] 李洪浩,丁凡,余韓開宗,等.馬鈴薯瘡痂病的發生及防治措施[J].四川農業科技,2017(2):25-26.LI Honghao,DING Fan,YU-HAN Kaizong,et al.Occurrence and control measures of potato scab [J].Sichuan Agric Sci Technol,2017(2):25-26.
[3] CAAMA?O-ANTELO S,FERNáNDEZ-NO I C,B?HME K,et al.Genetic discrimination of food borne pathogenic and spoilageBacillusspp.based on three housekeeping genes [J].Food Microbiol,2015,46:288-298.
[4] 朱玥妍,劉姣,杜春梅.芽孢桿菌生物防治植物病害研究進展[J].安徽農業科學,2012,40(34):16635-16638.ZHU Yueyan,LIU Jiao,DU Chunmei.Research progress of biological control in plant diseases byBacillusspp.[J].J Anhui Agric Sci,2012,40(34):16635-16638.
[5] 齊愛勇,趙緒生,劉大群.芽孢桿菌生物防治植物病害研究現狀[J].中國農學通報,2011,27(12):277-280.QI Aiyong,ZHAO Xusheng,LIU Daqun.Research of biological control in plant disease byBacillusspp. [J].Chin Agric Sci Bull,2011,27(12):277-280.
[6] 郭鳳柳,張海穎,李勇,等.馬鈴薯瘡痂病拮抗菌株B1的鑒定及防效測定[J].江蘇農業科學,2013,41(5):90-93.GUO Fengliu,ZHANG Haiying,LI Yong,et al.The identification and determination of antibacterial effect against potato scab of antagonistic strain B1 [J].Jiangsu Agric Sci, 2013,41(5):90-93.
[7] 李勇.馬鈴薯瘡痂病菌拮抗菌的鑒定及抑菌藥劑室內篩選[D].保定:河北農業大學,2012.LI Yong.Identification of Antagonistic Bacterium and Screening of Bactericides Against Potato Common Scab Pathogens[D].Baoding:Agricultural University of Hebei,2012.
[8] 李美麗.枯草芽孢桿菌B2發酵工藝初探及其田間定殖和促生防病效果研究[D].蘭州:甘肅農業大學,2008.LI Meili.Preliminary Study on Fermentation Technology of Bacillus subtilis B2and Its Effects on Colonization and Growth Promoting in the Field[D].Lanzhou:Gansu Agricultural University,2008.
[9] 張建平,哈斯,林團榮,等.不同殺菌劑對馬鈴薯瘡痂病的防效試驗[J].中國馬鈴薯,2013,27(2):83-86.ZHANG Jianping,HA Si,LIN Tuanrong,et al.Control efficacy of various fungicides on potato common scab [J].Chin Potato J,2013,27(2):83-86.
[10] 朱茂山,趙奎華,劉長遠,等.枯草芽孢桿菌B18菌株對黃瓜枯萎病菌抑菌作用研究[J].遼寧農業科學,2003(3): 39.ZHU Maoshan,ZHAO Kuihua,LIU Changyuan,et al.Study on the bacteriostasis ofBacillus subtilisB18 to cucumber fusarium wilt[J].Liaoning Agric Sci,2003(3):39.
[11] 葉晶晶,曹寧寧,吳建梅,等.生防芽孢桿菌的應用研究進展[J].西北農林科技大學學報(自然科學版),2014, 42(8): 185 - 190.YE Jingjing,CAO Ningning,WU Jianmei,et al.Research progress on application of biocontrolBacillus[J].J Northwest A&F Univ Nat Sci Ed,2014,42(8):185 - 190.
[12] 陳志誼,劉永峰,劉郵洲,等.植物病害生防芽孢桿菌研究進展[J].江蘇農業學報,2012,28(5):999-1006.CHEN Zhiyi,LIU Yongfeng,LIU Youzhou,et al.Research progress in biocontrol ofBacillusspp.against plant diseases [J].Jiangsu J Agric Sci,2012,28(5):999 - 1006.
[13] 馬曉丹,張紅星,鐘思瓊,等.枯草芽孢桿菌C3產抗菌物質發酵培養基的優化[J].中國釀造,2012,31(5): 10 - 14.MA Xiaodan,ZHANG Hongxing,ZHONG Siqiong,et al.Optimization of fermentation medium for antimicrobial substances fromBacillus subtilisC3 [J].Chin Brew,2012,31(5):10 - 14.
[14] 宋卡魏,王星云,張榮意.培養條件對枯草芽孢桿菌B68芽孢產量的影響[J].中國生物防治,2007,23(3):255-259.SONG Kawei,WANG Xingyun,ZHANG Rongyi.Culture conditions affecting spore production ofBacillus subtilisB68 [J].Chin J Biol Control,2007,23(3):255 - 259.
[15] 郝林華,孫丕喜,姜振波,等.枯草芽孢桿菌(Bacillus subtilis)液體發酵條件[J].上海交通大學學報(農業科學版), 2006, 24(4): 380 - 385.HAO Linhua,SUN Peixi,JIANG Zhenbo,et al.Liquid fermentation conditions ofBacillus subtilis[J].J Shanghai Jiaotong Univ Agric Sci,2006,24(4):380 - 385.
[16] YOUNIS M A M,HEZAYEN F F,NOUR-ELDEIN M A,et al.Optimization of cultivation medium and growth conditions forBacillus subtilisKO strain isolated from sugar cane molasses [J].Ame-Eur J Agric Environ Sci,2010,7(1):31 - 37.
[17] 時新瑞,范書華,邵廣忠,等.利用新型土壤顆粒劑防控馬鈴薯瘡痂病[J].中國馬鈴薯,2015,29(6):362-364.SHI Xinrui,FAN Shuhua,SHAO Guangzhong,et al.Prevention of potato scab using new soil granules [J].Chin Potato J,2015,29(6):362 - 364.
[18] 孫靜,金光輝,劉喜才.不同藥劑及施用方式對馬鈴薯瘡痂病的防效[J].中國馬鈴薯,2015,29(2):107-111.SUN Jing,JIN Guanghui,LIU Xicai.Control effect of different fungicides and application methods on potato common scab disease [J].Chin Potato J,2015,29(2):107 - 111.
[19] 張露,艾玉廷,馬健,等.不同比例氟啶胺對馬鈴薯塊莖瘡痂病防治效果[J].中國馬鈴薯,2013,27(3):175-178.ZHANG Lu,AI Yuting,MA Jian,et al.Control efficacy of various leaves of fluazinam on potato tuber common scab[J].Chin Potato J,2013,27(3):175 - 178.
[20] 陳志誼.芽孢桿菌類生物殺菌劑的研發與應用[J].中國生物防治學報,2015,31(5):723-732.CHEN Zhiyi.Research and application of bio-fungicide withBacillusspp. [J].Chin J Biol Control,2015,31(5):723-732.

