重癥急性胰腺炎合并組織壞死感染患者行經皮穿刺置管引流術的臨床價值及預后分析
李 泉
重癥急性胰腺炎(severe acute pancreatitis,SAP)是高發急腹癥之一[1],發病急、容易產生多種并發癥、病死率高。有文獻指出SAP患者死亡率可達33%[2],主要死亡原因為病程后期可能繼發的胰腺組織壞死,大量積液產生并積累在腹腔,造成感染周圍組織,造成膿毒癥引發多器官功能障礙綜合征等[3],快速徹底清除胰腺壞死組織,引流積液,在改善SAP預后中意義重大。但目前臨床常采用開腹手術進行清除壞死組織與灌腹清洗,其良好的療效建立在對機體組織的嚴重損傷基礎上[4],除了基礎病情還可能誘發多種并發癥,給患者造成生命危險。近年來在微創技術支持下,經皮穿刺置管引流(percutaneous catheter drainage,PCD)逐步在SAP合并感染壞死中得到應用[5],但療效存在爭議。作者以56例SAP并周圍組織感染患者的病例資料回顧性分析為依據,探討PCD的臨床效果及安全性。
1 資料與方法
1.1 研究對象 回顧性分析2012年3月—2017年5月在廣西中醫藥大學附屬瑞康醫院普外科收治的SAP并胰腺周圍組織壞死感染的患者,共56例,根據治療方式將患者分為2組,其中引流組23例、開腹組33例。所有患者均發生了全身炎癥反應綜合征,性別、年齡、病因構成、急性生理與慢性健康評分等具有可比性。納入標準:①以中華醫學會外科學會《重癥急性胰腺炎診治指南》為診斷參考標準;②術前影像學顯示胰腺及其周組織發生氣體樣改變;③引流液或清除出的樣本培養結果中檢出細菌;④術前影像學檢查胰腺壞死范圍預估<30%;⑤患者病歷資料完整。排除標準:①慢性胰腺炎急性發作;②既往具有開腹手術史者;③外傷造成的腹腔內感染與胰腺壞死;④壞死感染范圍大于等于30%。
1.2 治療方法 患者入院后均采用CT與彩超確定胰腺壞死組織相關情況,包括位置和積液量。檢查位置為腹膜后側、左側及右側。
1.2.1 開腹組 開腹組患者進行手術前常規消毒,全麻。取仰臥位,將左或右側腰背側墊高約15°,切開腹腔,直視條件下清除胰腺壞死組織,待清除徹底后閉合腹腔并放置引流管。
1.2.2 引流組 患者采取全麻,以Seldinger方式進行穿刺,于彩超或CT引導下避開胃腸道、與肝脾等主要臟器與大血管,將穿刺針刺入皮下,進入胰腺壞死組織,通過穿刺針置入導絲后,使用擴張器沿導絲逐步將竇道擴張后,將14F引流管置入竇道。盡可能保證分隔或分散壞死組織,將之置入引流管,避免阻塞。通過引流管抽盡壞死組織,保持引流管,次日再使用無菌生理鹽水進行清洗,每次沖洗胰腺組織4 h以上,直至將未吸出的固態壞死組織沖洗出來。
3 d后,進行全腹CT檢查評估引流效果。①若引流管位置良好且引流通暢,患者全身情況沒有得到良好改善,則需要立刻轉為開腹手術進行壞死組織清除。②若全身情況逐步改善,則繼續通過引流管沖洗,為達到更好效果,可行多次PCD。③若引流管阻塞,可進一步擴張竇道,用黎氏“雙套引流管”進行引流,繼續負壓沖洗,以保持通暢,達到充分引流的效果。病情平穩后進行全腹部CT檢查,證實感染壞死胰腺組織已經PCD完全引流干凈,再更換回普通引流管,并持續每次沖洗3 h,間斷1 h再沖洗1次,持續3~5 d后若患者全身情況得到改善,則安排患者出院,門診定期復查。
1.3 觀察指標 比較2組患者入院時的急性生理與慢性健康評分Ⅱ、CT掃描判斷下的嚴重程度指數、入院時器官衰竭比例、治療前、治療7 d后的外周血白細胞、血淀粉酶、尿淀粉酶、血糖、血鈣、胰瘺率、腸瘺率、腹腔出血率、術后殘余膿腫率與治愈率。
1.4 隨訪 電話聯系方式隨訪6個月,內容為患者病情是否發生變化、再入院等情況,隨訪率100%。
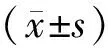
2 結果
2.1 2組患者的實驗室指標 治療前和治療后2組患者白細胞、血淀粉酶、血鈣、血糖、尿淀粉酶值差異無統計學意義(P>0.05)。治療7 d后2組患者的白細胞、血淀粉酶、血糖、尿淀粉酶值均較本組治療前顯著降低(P<0.05),但2組之間無顯著差異(P>0.05),見表1。

表1 2組術前與術后實驗室指標的比較
注:開腹組與治療前比較,*P<0.05;治療與引流組前比較,#P<0.05
2.2 2組患者的手術結果及并發癥 引流組的治愈率與開腹組比較差異無統計學意義(P>0.05),但術后引流組患者腹腔出血率顯著低于開腹組患者(P<0.05),見表2。

表2 2組患者的手術結果及發生的并發癥
注:與開腹組比較,*P<0.05
2.3 影響患者預后的因素分析 將死亡患者與治愈患者的病歷資料進行單因素分析,結果顯示,2組之間有差異的為外周血白細胞、血淀粉酶、血鈣、血糖、尿淀粉酶、胰瘺、腹腔出血、器官衰竭。 將上述因素進行多因素分析后,結果顯示器官衰竭、胰瘺、腹腔出血、血鈣水平為造成患者死亡的獨立危險因素,見表3。

表3 死亡因素的多因素logistics回歸分析
3 討論
當今,微創技術飛速發展,有研究提出通過PCD方式救治SAP合并胰腺壞死組織感染患者,對已經收到疾病重創的患者創傷更小[6]。有文獻中提出PCD不但能夠最大限度保留胰腺與胰腺周圍多種軟組織結構完整,還能夠盡可能保留組織功能,便于術后護理,并發癥率與病死率都較開腹手術更低,患者預后改善更加顯著[7]。
本研究中,治療前和治療后2組患者外周血白細胞、血淀粉酶、血鈣、血糖、尿淀粉酶值差異無統計學意義(P>0.05)。治療7 d后2組患者的白細胞、血淀粉酶、血糖、尿淀粉酶值較本組治療前顯著降低(P<0.05),但2組之間無顯著差異(P>0.05)。引流組的治愈率與開腹組比較差異無統計學意義(P>0.05),但術后引流組患者腹腔出血率顯著低于開腹組患者(P<0.05)。多因素分析顯示器官衰竭、胰瘺、腹腔出血、血鈣水平為造成患者死亡的獨立危險因素。表明PCD可有效抑制血液及手術造成的并發癥,患者多個系統的功能得到穩定,治療效果不低于開腹手術。
彩超或CT能夠給術者準確引導,充分利用醫學影像指導PCD手術,確定病情位置及程度,因此無需開腹即可獲得治療所需要的數據[8]。 而微創手術切口小、對重癥患者機體損傷程度低,保留了患者免疫力,能夠顯著降低術后感染率,此外,引流管定期沖洗及保持通暢,有助于降低腹腔二次感染的概率[9]。
本研究所納入的患者均排除胰腺壞死感染范圍高于30%者,在此嚴重范圍內PCD可完全替代開腹手術進行治療。但如果胰腺病灶固體狀壞死組織相對較多,容易造成引流管堵塞,且對組織中多個小膿腔的引流效果有限,不利于引流,故如果影像學顯示單純PCD未能徹底地清除壞死組織,可視情況在術后轉為開腹手術,但本研究無患者由引流組轉為開腹手術,是因為對患者置入了多個引流管,并且采用了黎氏雙套引流管,引流效果較好,未發生管道堵塞。此外良好的引流能夠有效去除壞死組織,能夠達到與開腹手術無顯著差異的清理腹腔效果。
多因素分析顯示PCD與開腹手術均非患者死亡的危險因素,進一步說明PCD在將來能夠一定程度上取代開腹治療SAP。其應用前景有待于對胰腺壞死感染范圍≥30%患者救治效果進一步研究探討,更需要大樣本量研究的支持。

