D407A/D430A雙位點突變對嗜熱酸性生淀粉α淀粉酶GTamy酶學性質的影響
曾 靜,郭建軍,袁 林
(江西省科學院微生物研究所,江西南昌 330096)
天然生淀粉是一種結構復雜而致密的顆粒,在應用前往往需要經過強酸、強堿、高溫或者酶法處理來破壞生淀粉顆粒的結構[1]。酶法降解生淀粉能夠簡化現代發酵工業中的生淀粉前處理過程,更加環保并節約能耗,因此生淀粉降解酶的研究一直受到高度關注[2-3]。生淀粉酶是指能對不經過蒸煮糊化的生淀粉顆粒表現出強水解活性的酶類[4]。多種微生物包括細菌、酵母、絲狀真菌和放線菌都能夠產生生淀粉酶。在α-淀粉酶、β-淀粉酶、葡萄糖淀粉酶、異淀粉酶中均有部分酶具有水解生淀粉的能力[4]。
生淀粉α-淀粉酶可以在低于糊化溫度條件下直接作用于未經蒸煮糊化的生淀粉顆粒,在淀粉液化過程中能夠省去生淀粉糊化步驟,有利于節約能源和簡化工藝,因此生淀粉α-淀粉酶在食品、造紙、紡織等領域具有巨大的應用潛力[5-6]。在淀粉雙酶法水解工藝中為了防止雜菌污染需要適當加溫,至少要達到60 ℃。此外,生淀粉加水形成的乳濁液的pH一般為5.8~6.5,由于淀粉工業中循環工藝的應用,淀粉水解過程中的pH通常在5.0左右[7-10]。因此,獲得耐高溫、低pH和不依賴于Ca2+的生淀粉α-淀粉酶,有利于對現行淀粉加工工業的工藝體系進行技術升級和改造。
來源于嗜熱菌Geobacillusthermoleovorans的α-淀粉酶GTamy屬于嗜熱酸性生淀粉α-淀粉酶,具有優良的高溫活性和熱穩定性,其最適反應溫度為80 ℃,最適反應pH為5.0,于80 ℃的可溶性淀粉酶活達1723 U/mg,于80 ℃的半衰期為184 min,其活性和熱穩定性均不依賴于Ca2+[11]。GTamy是目前報道的玉米淀粉降解率最高的生淀粉α-淀粉酶,使用0.1 U/(mg淀粉)的酶液,于80 ℃水解30%玉米淀粉3 h(pH5.0),玉米淀粉降解率達54%[11]。并且GTamy的酶學性質(如熱穩定、低pH、不依賴于Ca2+)使得其在淀粉液化工藝中具有巨大的應用潛力。此外有關GTamy分子結構特征與酶學性質之間關系的研究具有重要理論價值,不僅有利于探討蛋白質類生物大分子適應高溫環境的分子機制,也可以為其他α-淀粉酶的性質優化提供理論依據和設計思路。GTamy的模擬分子結構顯示其包含有三個保守的Ca2+結合位點,其中兩個Ca2+結合位點位于結構域A與結構域B之間,第三個Ca2+結合位點位于結構域A與結構域C之間[11]。來源于Bacillusstearothermophilus的α-淀粉酶BStA與GTamy具有98%序列相似性,Suvd等[12]發現位于α-淀粉酶BStA的結構域A與結構域C之間的Ca2+結合位點對于BStA的熱穩定性非常重要。本研究擬對GTamy中位于結構域A和結構域C(也稱生淀粉結合域,raw starch binding domain,RSBD)之間的Ca2+結合位點進行定點突變,并通過比較GTamy與突變體的酶學性質來揭示該Ca2+結合位點對GTamy酶學性質的影響,初步闡述GTamy的分子結構特征與其酶學性質之間的關系。
1 材料與方法
1.1 材料與儀器
大腸桿菌EscherichiacoliJM109、枯草芽孢桿菌BacillussubtilisWB600、枯草芽孢桿菌表達載體pSTOP1622 均由本實驗室保存;基因gtamyh(編碼具有His tail的α-淀粉酶GTamyH) 由上海博益生物科技有限公司合成;KOD-Plus-neo DNA聚合酶 日本Toyobo公司;DNA限制性內切酶、T4 DNA連接酶、DNA Marker、蛋白質Marker 美國Fermentase公司;DNA膠回收試劑盒、質粒抽提試劑盒E.Z.N.A. 美國Omega Bio-tek公司;Chelating SepharoseTMFast Flow 美國GE Healthcare公司;Bradford法蛋白濃度測定試劑盒、木糖、咪唑 上海生工生物工程股份有限公司;實驗所用試劑 均為國產分析純;LB培養基(1 L):胰蛋白胨 10 g,酵母提取物 5 g,NaCl 10 g,固體培養基添加瓊脂粉15 g/L,用于大腸桿菌EscherichiacoliJM109和枯草芽孢桿菌BacillussubtilisWB600的培養,根據質粒的選擇性標記需要,添加終濃度為30 μg/mL的卡那霉素。
PCR儀(Mastercycler gradient) 美國Eppendorf公司;TY04S-3C型凝膠成像系統 北京君意東方電泳設備有限公司;SCIENTZ-ⅡD型超聲波細胞破碎儀 寧波新芝生物科技股份有限公司;SP-752PC型紫外可見分光光度計 上海光譜儀器有限公司;Agilent 7500ce 美國Agilent公司。
1.2 實驗方法
1.2.1 重組質粒pSTOP1622-AbnA-gtamyds的構建及鑒定 以P1和P2為引物(表1),以基因gtamyh為模板,進行PCR擴增,獲得不含信號肽的結構基因gtamyhds。PCR擴增條件為:98 ℃ 5 min;98 ℃ 20 sec,60 ℃ 20 sec,74 ℃ 2 min,30個循環;74 ℃,10 min。擴增產物經BglII和SphI雙酶切,連接至載體pSTOP1622,構建重組質粒pSTOP1622-gtamyhds。
采用NEB公司的Gibson Assembly Master Mix構建包含枯草芽孢桿菌信號肽AbnA和重組載體pSTOP1622-gtamyhds的重組載體pSTOP1622-AbnA-gtamyhds。所需引物(表1中P3和P4)按照該產品說明書的要求進行設計,PCR等相關操作按照該產品說明書進行。具體操作如下:以pSTOP1622-gtamyhds為模板,采用引物P3、P4(表1),進行PCR擴增得到載體片段;PCR擴增條件為:94 ℃ 5 min;94 ℃ 30 sec,55 ℃ 20 sec,68 ℃ 4 min,35個循環;68 ℃,10 min。在NCBI網站(https://www.ncbi. nlm.nih.gov/)查詢信號肽AbnA的核苷酸序列,合成包含同源臂和AbnA核苷酸序列的DNA片段(5′-CAAACTAGTTCGAAGATCT-信號肽核苷酸序列-ACGGCGTGGCAAATTGCCGTG-3′)。PCR擴增的載體片段與上述DNA片段混合,采用Gibson Assembly Master Mix進行無縫克隆,獲得重組質粒pSTOP1622-AbnA-gtamyhds。以pSTOP1622-AbnA-gtamyhds為模板,采用引物P5、P2(表1)進行PCR擴增,獲得包含信號肽AbnA基因序列和GTamyHds基因序列的約1600 bp的DNA片段。DNA片段測序(上海生工生物工程股份有限公司),比對分析。
1.2.2 重組質粒pSTOP1622-AbnA-gtamyhdsD407A/D430A的構建及鑒定 根據QuikChange?點突變試劑盒的原理,結合α-淀粉酶GTamy基因gtamy和擬突變的氨基酸位點設計引物D407A-F、D407A-R、D430A-F、D430A-R(表1)。以pSTOP1622-AbnA-gtamyhds為模板,采用引物D407A-F和D407A-R,進行PCR擴增得到包含載體序列和基因序列的線性片段。PCR擴增條件為:94 ℃ 5 min;94 ℃ 30 sec,55 ℃ 20 sec,68 ℃ 4 min,35個循環;68 ℃,10 min。擴增產物經DpnⅠ酶處理后,轉化大腸桿菌JM109,卡那霉素抗性平板篩選轉化子,經測序鑒定是否為突變基因gtamyhD407A。在此基礎上,以pSTOP1622-AbnA-gtamyhdsD407A為模板,采用引物D430A-F和D430A-R,進行PCR擴增,重復以上實驗步驟,獲得重組質粒pSTOP1622-AbnA-gtamyhdsD407A/D430A。
以pSTOP1622-AbnA-gtamyhdsD407A/D430A為模板,采用引物P5、P2(表1)進行PCR擴增,獲得包含信號肽AbnA基因序列和GTamyHdsD407A/D430A基因序列的約1600 bp的DNA片段。將DNA片段送至上海生工生物工程股份有限公司進行測序,并與對應基因序列進行比對確認。
1.2.3 枯草芽孢桿菌B.subtilisWB600感受態細胞的制備和轉化 枯草芽孢桿菌B.subtilisWB600感受態細胞的制備和轉化采用改進的Spizizen法[13]進行。
1.2.4 重組α-淀粉酶的誘導表達和純化 接種重組枯草芽孢桿菌單克隆到LB液體培養基中,250 mL三角瓶中培養,裝液量20 mL,37 ℃和200 r/min下培養培養10 h。然后轉接該培養物于新鮮LB液體培養基中,用250 mL三角瓶進行培養,其中培養基的裝液量為25 mL,接種量為3%,培養溫度為37 ℃,轉速為200 r/min。當培養至菌體OD600 nm達到1時,添加終濃度為0.5%的木糖,誘導細胞表達重組蛋白質,誘導時間為30 h。
采用Ni2+親和層析柱對發酵上清液中目的蛋白質進行純化,用250 mmol/L咪唑洗脫緩沖液洗脫,即得到純化后的重組α-淀粉酶。利用聚丙烯酰胺凝膠電泳[14](Sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)檢測重組α-淀粉酶的純度,并采用Bradford法測定重組α-淀粉酶的濃度[15]。
1.2.5α-淀粉酶的酶活力測定 將10 μL酶液與490 μL 含1%(m/V)可溶性淀粉的50 mmol/L MES,pH5.0緩沖液混合,于80 ℃反應30 min后,迅速放入冰水浴中終止反應,然后采用3,5-二硝基水楊酸(3,5-Dinitrosalicylic acid,DNS)法[16]測定反應體系中還原糖量。酶活力單位(U)定義:在一定反應條件下,每分鐘催化產生1 μmol還原糖的酶量為一個酶活力單位(U)。
1.2.6α-淀粉酶的最適反應溫度和熱穩定性測定 按照上述反應體系混合酶液和底物,分別于30~100 ℃反應30 min,測定不同溫度條件下酶比活力,并以酶比活力對溫度作圖,確定其最適反應溫度。將酶液于80 ℃保溫,分時間梯度取出部分樣品,按照1.2.5節方法測定酶活。將未處理的酶液的酶活定義為100%,并以相對酶活的百分比對時間作圖,評價酶的熱穩定性。
1.2.7α-淀粉酶的動力學常數測定 用50 mmol/L MES(pH5.0)緩沖液配制不同質量分數可溶性淀粉溶液(0.1%、0.2%、0.5%、1.0%、1.5%、2.0%、3.0%、4.0%、5.0%),分別向可溶性淀粉溶液中加入等量的酶液,按照1.2.5的方法測定酶活。根據雙倒數作圖法以底物濃度的倒數為橫坐標,以酶比活力的倒數為縱坐標作圖,直線的斜率為Km/Vmax,截距為1/Vmax,計算以可溶性淀粉為底物時的米氏常數Km、反應常數kcat。
1.2.8α-淀粉酶的最適反應pH測定 將酶液與不同pH的1%(W/V)可溶性淀粉溶液混合,于80 ℃下進行酶活測定。采用不同緩沖液配制不同pH的1%(W/V)可溶性淀粉溶液:50 mmol/L MES(pH3.0~7.0)、50 mmol/L MOPS(pH7.0~11.0)。
1.2.9α-淀粉酶對玉米淀粉的降解率及吸附率的測定 取30%(W/V)玉米淀粉的50 mmol/L MES(pH5.0)緩沖液與0.1 U/(mg淀粉)的酶液混合,于80 ℃反應3 h后,用DNS法測定上清液中還原糖量。α-淀粉酶的玉米淀粉降解率按照如下公式計算:
玉米淀粉降解率(%)=還原糖(mg/mL)/起始生淀粉量(mg/mL)×0.9×100
取30%(W/V)生玉米淀粉的50 mmol/L MES(pH5.0)緩沖液與0.1 U/(mg淀粉)的酶液混合,混合體系在20 ℃的恒溫振蕩培養箱孵育3 h,振蕩速率為180 r/min。反應結束后,測定上清液中的殘余可溶性淀粉酶活。吸附率AR計算公式如下:
AR(%)=(O-R)/O×100
R:上清液殘余酶活力;O:初始酶活力。
1.3 數據處理
2 結果與分析
2.1 定點突變位點的選擇
采用Swiss-Model(http://swissmodel. expasy.org),以來源于Bacillusstearothermophilus的α-淀粉酶BStA(PDB ID:1hvxA)的蛋白質分子結構為模板,模擬GTamy的蛋白質分子結構。α-淀粉酶GTamy與BStA的蛋白質分子結構比對結果(圖1)顯示:GTamy屬于糖苷水解酶類的第13家族,具有第13家族酶分子結構和催化機制上的共同特征[11,17-19]。例如,GTamy的一級結構含有四個保守區域,這四個保守區域包含酶分子的催化活性位點和底物結合位點;GTamy具有第13家族酶分子的保守的催化活性中心,由Asp268、Glu298及Asp365構成;GTamy的三級結構由三個結構域組成,即結構域A、結構域B和結構域C。
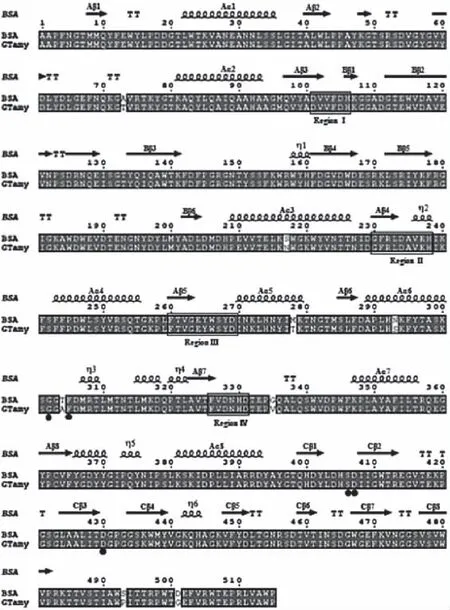
圖1 GTamy與α-淀粉酶BSA的蛋白質分子結構比對結果Fig.1 Molecular structure comparison of α-amylase GTamy and BSA注:圖中方框標示的是保守序列I~保守序列IV,實心圓形標示的氨基酸殘基為α-淀粉酶BSA中位于結構域A與結構域C之間的Ca2+結合位點相關的氨基酸殘基,實心三角形標示的氨基酸殘基為GTamy中待突變的氨基酸殘基。BStA:來源于Bacillus stearothermophilus的α-淀粉酶(PDB ID:1hvxA);GTamy:來源于Geobacillus thermoleovorans的α-淀粉酶。
其中GTamy的結構域C由8個β-sheet結構構成,GTamy的結構域C和來源于Bacillussp. TS-23的α-淀粉酶的生淀粉結合域RSBD序列比對結果表明,GTamy的結構域C屬于生淀粉結合域RSBD[11]。生淀粉α-淀粉酶能夠直接水解未經糊化處理的生淀粉顆粒的關鍵在于其具有結合到淀粉顆粒表面的生淀粉結合域RSBD[4,6]。RSBD作為淀粉酶的天然部分主要有以下作用:使淀粉酶分子可以在溶液中與不溶性底物(淀粉顆粒)結合,將底物運送到催化結構域的活性位點以及使淀粉顆粒表面破裂[20]。除此之外,RSBD還具有一些特殊功能。例如,Gt-amyⅡ的RSBD還與其熱穩定性相關[21];AmyP的RSBD與其可溶性淀粉酶活相關[22-23]。
已有研究表明,α-淀粉酶中金屬離子結合位點對于其維持酶學性質起到非常重要的作用。例如,Linden等[24]通過對比極端嗜熱α-淀粉酶PFA與其他低溫、中溫微生物來源的α-淀粉酶的蛋白質分子結構發現,PFA中Ca2+-Zn2+雙金屬離子結合位點對于其維持熱穩定性非常重要;Machius等[25]和Qin等[26]發現,位于α-淀粉酶BLA的結構域A與結構域B之間的Ca2+-Zn2+-Ca2+三金屬離子結合位點以及位于其結構域A與結構域C之間的第三個Ca2+結合位點有利于BLA維持熱穩定性;曾靜等[27]的研究結果表明,位于極端嗜熱α-淀粉酶ApkA的結構域A與結構域B之間Ca2+結合位點的有利于其維持高溫活性和熱穩定性;Suvd等[12]通過解析α-淀粉酶BStA的蛋白質分子結構發現,位于其結構域A與結構域C之間的Ca2+結合位點對于BSA的熱穩定性非常重要。
BStA中位于結構域A與結構域C之間的Ca2+結合位點的配基由多肽鏈骨架的三個羰基氧原子(Gly300、Phe302和Ser406)和兩個天冬氨酸殘基Asp(Asp407和Asp430)的羧基氧原子共同構成[12]。根據GTamy和BStA的蛋白質分子結構比對結果,GTamy中存在與BStA中該Ca2+結合位點相對應的氨基酸殘基,即Gly303、Phe305、Ser406、Asp407和Asp430。由此推斷,GTamy的結構域A與結構域C之間也可能存在Ca2+結合位點。本研究對該Ca2+結合位點中的天冬氨酸殘基Asp407和Asp430進行定點突變,研究該Ca2+結合位點對GTamy酶學性質的影響。
2.2 重組質粒的PCR鑒定
分別以重組質粒pSTOP1622、pSTOP1622-AbnA-gtamyhds、pSTOP1622-AbnA-gtamyhdsD407A/D430A為模板,采用引物P5、P2對目標片段進行PCR擴增。PCR擴增所得產物的電泳鑒定圖如圖2所示,以重組質粒pSTOP1622-AbnA-gtamyhds和pSTOP1622-AbnA-gtamyhdsD407A/D430A為模板進行PCR擴增得到的PCR產物大小均約為1.6 kb,與理論值相符。同時將以上得到的PCR擴增產物送至上海生工生物工程股份有限公司進行測序,并將測序結果(結果未顯示)與對應的基因序列進行了比對確認,證實重組質粒構建成功。
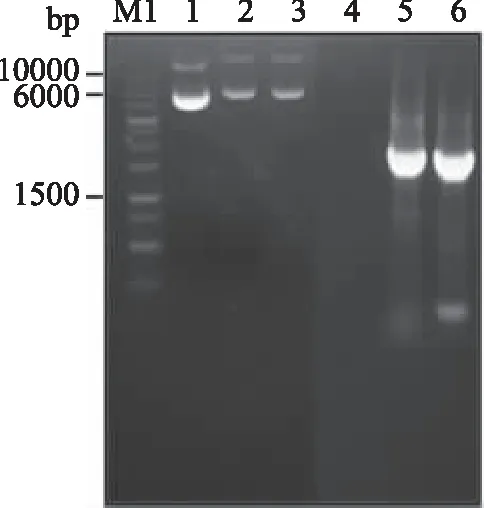
圖2 重組質粒的PCR鑒定Fig.2 PCR analysis of recombinant plasmids注:M1.1 kb ladder;1.質粒pSTOP1622;2.質粒pSTOP1622-AbnA-gtamyhds;3.質粒pSTOP1622-AbnA-gtamyhdsD407A/D430A;4. 以質粒pSTOP1622為模板,采用引物P5、P2進行PCR擴增的產物;5. 以質粒pSTOP1622-AbnA-gtamyhds為模板,采用引物P5、P2進行PCR擴增的產物;6. 以質粒pSTOP1622-AbnA-gtamyhdsD407A/D430A為模板,采用引物P5、P2進行PCR擴增的產物。
2.3 重組α-淀粉酶的誘導表達與純化
將陰性對照pSTOP1622和重組質粒pSTOP1622-AbnA-gtamyhds、pSTOP1622-AbnA-gtamyhdsD407A/D430A分別轉化枯草芽孢桿菌B.subtilisWB600,獲得重組枯草芽孢桿菌并進行誘導表達。待表達完成后,收集發酵上清液和發酵菌體,采用SDS-PAGE分析發酵上清液和發酵菌體中重組α-淀粉酶的表達情況。如圖3所示,目的蛋白質GTamy和GTamyD407A/D430A均得到成功表達,且主要位于發酵上清液中。GTamy和GTamyD407A/D430A的表觀分子質量均約為60 kD,兩者的大小均與理論值相符。采用Ni2+親和層析柱對發酵上清液中的目的蛋白質進行純化,得到純化后的重組α-淀粉酶GTamy和GTamyD407A/D430A。
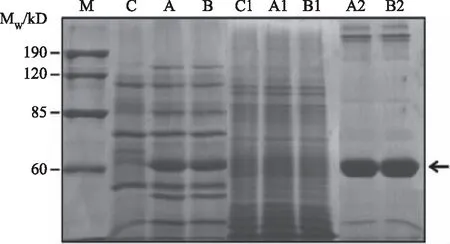
圖3 重組α-淀粉酶的SDS-PAGE檢測圖Fig.3 SDS-PAGE analysis of recombinant α-amylases注:重組α-淀粉酶的SDS-PAGE檢測圖,其中C為含有質粒pSTOP1622的重組枯草芽孢桿菌的發酵上清液樣品,A為含有重組質粒pSTOP1622-AbnA-gtamyhds的重組枯草芽孢桿菌的發酵上清液樣品,B為含有重組質粒pSTOP1622-AbnA-gtamyhdsD407A/D430A的重組枯草芽孢桿菌的發酵上清液樣品,C1為含有質粒pSTOP1622的重組枯草芽孢桿菌的發酵菌體樣品,A1為含有質粒pSTOP1622-AbnA-gtamyhds的重組枯草芽孢桿菌的發酵菌體樣品,B1為含有重組質粒pSTOP1622-AbnA-gtamyhdsD407A/D430A的重組枯草芽孢桿菌的發酵菌體樣品,A2采用Ni2+親和層析獲得的GTamy純化樣品,B2為采用Ni2+親和層析獲得的GTamyD407A/D430A純化樣品,箭頭所指為目的蛋白質GTamy和GTamyD407A/D430A的位置。
2.4 GTamy和GTamyD407A/D430A的酶學性質比較
2.4.1 pH對重組α-淀粉酶相對酶活的影響 將酶液與不同pH(1.0~8.0)的1%(W/V)可溶性淀粉溶液混合,于80 ℃下測定重組α-淀粉酶的相對酶活,結果如圖4所示。重組α-淀粉酶GTamy和GTamyD407A/D430A的最適反應pH均約為5.0,在pH3.0~11.0范圍內兩者具有相似的相對酶活。以上結果表明,D407A/D430A雙位點突變不影響GTamy的反應pH。
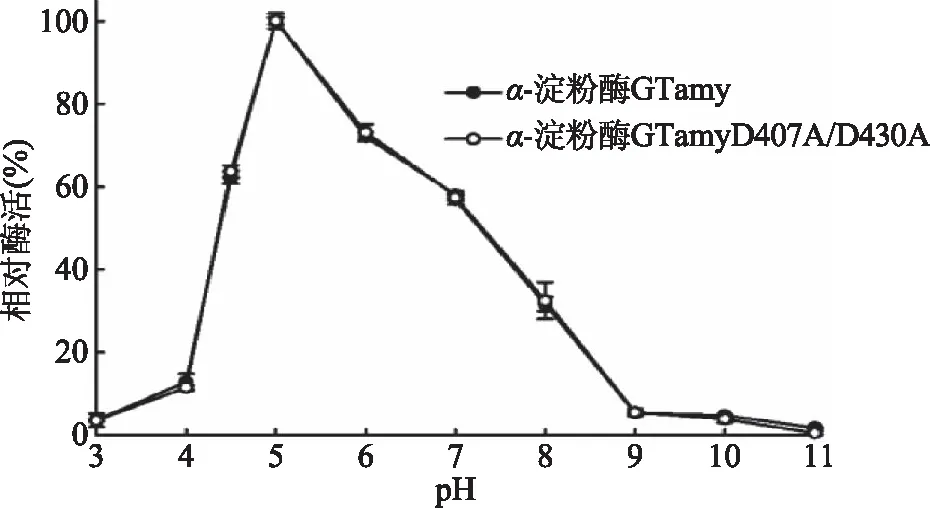
圖4 pH對酶活的影響Fig.4 pH dependence of α-amylase activity
2.4.2 溫度對重組α-淀粉酶比活力的影響 以1%可溶性淀粉為底物,于不同溫度條件下(30~100 ℃)測定重組α-淀粉酶的酶比活力,結果如圖5所示。重組α-淀粉酶GTamy和GTamyD407A/D430A的最適反應溫度均為80 ℃,但是在40~100 ℃間GTamy的酶比活力均明顯高于突變體GTamyD407A/D430A的酶比活力。其中,在80 ℃條件下,GTamy的酶比活力為1 756.75 U/mg,突變體GTamyD407A/D430A的酶比活力為1 484.48 U/mg。這表明該Ca2+結合位點對于GTamy維持其高溫活性非常重要。該Ca2+結合位點的缺失導致突變體于高溫條件下的酶比活力降低。
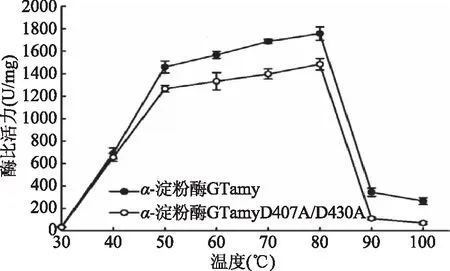
圖5 溫度對酶活的影響Fig.5 Temperature dependence of α-amylase activity
2.4.3 重組α-淀粉酶的動力學參數 重組α-淀粉酶以可溶性淀粉為底物時的米氏常數Km和反應常數kcat如表2所示,與GTamy相比,80 ℃時突變體GTamyD407A/D430A的Km未明顯改變,kcat值明顯降低。即突變體GTamyD407A/D430A的可溶性淀粉結合能力未明顯改變,以可溶性淀粉為底物時的反應速率明顯下降。突變體GTamyD407A/D430A于80 ℃條件下以可溶性淀粉為底物的反應速率為GTamy的79%。以上結果表明,該Ca2+結合位點是通過影響GTamy的反應速率來影響其高溫活性的。

表2 80 ℃重組α-淀粉酶的動力學參數Table 2 Kinetic parameters of recombinant α-amylases at 80 ℃
2.4.4 重組α-淀粉酶的熱穩定性 重組α-淀粉酶于80 ℃下的熱穩定性測定結果如圖6所示。在80 ℃的條件下,GTamy的熱穩定性高于突變體GTamyD407A/D430A的熱穩定性。其中GTamy于80 ℃的半衰期約為3 h,GTamyD407A/D430A于80 ℃的半衰期約為2.5 h。這表明,該Ca2+結合位點與GTamy的熱穩定性相關,這與α-淀粉酶BStA中相對應的Ca2+結合位點的功能相同。
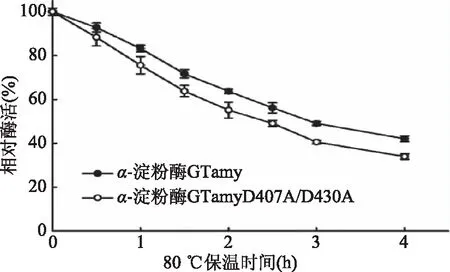
圖6 80 ℃重組α-淀粉酶的熱穩定性Fig.6 Thermal stability of α-amylases at 80 ℃
2.4.5 重組α-淀粉酶對玉米淀粉的吸附率及降解率 通過測定重組α-淀粉酶對玉米淀粉的吸附率和降解率來比較重組α-淀粉酶對不溶性底物的結合能力和降解能力,結果如表3所示。與GTamy相比,突變體GTamyD407A/D430A對玉米淀粉的吸附率和降解率均明顯降低。在同等條件下,GTamyD407A/D430A對玉米淀粉的吸附率僅為GTamy的67.9%;GTamyD407A/D430A對玉米淀粉的降解率僅為GTamy的59.3%。

表3 重組α-淀粉酶對玉米淀粉的吸附率及降解率Table 3 Substrate binding rate and hydrolysis rate of α-amylases towards corn starch
3 結論
本研究率先通過構建GTamy的定點突變體GTamyD407A/D430A來研究位于結構域A與結構域C(即生淀粉結合域RSBD)之間的Ca2+結合位點對其酶學性質(如熱穩定性、對可溶性淀粉的結合能力和降解能力、對生淀粉的結合能力和降解能力等)的影響。與GTamy相比,突變體GTamyD407A/D430A的高溫活性和熱穩定性明顯降低。GTamyD407A/D430A于80 ℃的酶比活力由1756.75 U/mg降低至1484.48 U/mg;于80 ℃的半衰期由3 h降低至2.5 h。此外,突變體GTamyD407A/D430A對可溶性淀粉的結合能力未明顯改變,對可溶性淀粉的降解能力以及對玉米淀粉的結合能力和降解能力明顯降低。以1%可溶性淀粉為底物時,GTamyD407A/D430A的底物結合能力不變,反應速率僅為GTamy的79%;以30%玉米淀粉為底物時,突變體的底物吸附率為GTamy的67.9%,底物降解率為GTamy的59.3%。本研究結果表明,位于GTamy的結構域A與RSBD之間的Ca2+結合位點有利于其維持熱穩定性和高溫活性。該Ca2+結合位點的突變可能通過改變GTamy的分子結構,特別是生淀粉結構域RSBD和酶分子催化中心的分子結構,影響GTamy的酶學性質。本研究初步闡述了GTamy的分子結構特征與其酶學性質之間的關系,為其他α-淀粉酶的分子改造提供了理論依據和設計思路。

