RNAi沉默FAK基因表達對人舌鱗癌細胞CAL-27凋亡和侵襲的影響*
陳 凱,廖曉穎,吳妹娟,康成容,潘 宣
(廣東藥科大學附屬第一醫院口腔科 510080)
舌鱗狀細胞癌是口腔頜面部最常見的惡性腫瘤之一,同時也是最常見的口腔癌。由于其惡性程度高,浸潤性強,易發生轉移,所以關于舌鱗癌的基礎研究和臨床治療一直以來都是口腔頜面外科及頭頸外科的研究重點。黏著斑激酶(focal adhesion kinase,FAK)是一種非受體型蛋白酪氨酸激酶,已有的研究表明FAK在多種腫瘤組織中均存在著表達的上調,而且在一定程度上,其表達水平與腫瘤的惡化程度密切相關[1]。目前,有關FAK與舌鱗癌之間相關性的研究仍然較少,有必要進行更深入的研究。本實驗采用RNA干擾(RNAi)技術研究FAK 基因表達水平對人舌鱗癌細胞凋亡和侵襲等細胞生物學行為的影響。
1 材料與方法
1.1材料 舌鱗癌細胞株CAL-27來自中山大學附屬孫逸仙紀念醫院口腔科李勁松教授的惠贈。 RNA提取試劑盒購于美國Tiangen公司;Opti-MEM 購于美國Gibco公司;LipofectamineTM2000 Transfection Reagent試劑盒購于美國Life Technologies 公司;胎牛血清購于杭州四季青公司;GoScript 反轉錄系統購于美國Promega公司;實時定量聚合酶鏈反應(qPCR)試劑盒購于美國Promega公司;兔抗人FAK單克隆抗體購于英國Abcam公司;matrigel基底膠購于美國BD公司;Annexin V-FITC/PI細胞凋亡試劑盒購于南京凱基生物有限公司。
1.2方法
1.2.1FAK SsiRNA的設計及合成 根據GenBank數據庫提供的人FAK基因序列,遵從在線siRNA設計的相關原則,設計了1對siRNA-NC作為陰性對照序列和3對實驗siRNA序列:siRNA-1、siRNA-2、siRNA-3(表1)。所有序列經BLAST分析確定特異性后,由廣州賽哲生物科技股份有限公司合成,純化。
1.2.2引物的設計及合成 設計FAK的引物及內參GAPDH 引物各1對(表2),由廣州賽哲生物科技股份有限公司合成。
1.2.3細胞培養、轉染及分組 復蘇保存于液氮中的舌鱗癌細胞株,接種于10%胎牛血清的DMEM細胞培養基后。待實驗細胞貼壁后,胰蛋白酶消化,接種到六孔板,繼續放于培養箱培養,待細胞密度生長到65%左右時,即可開始進入轉染階段。所有細胞的轉染步驟均嚴格遵從LipofectamineTM2000 Transfection Reagent試劑盒的說明書執行。轉染時用不含P/S的完全培養基換液,轉染4~8 h后換成正常培養基繼續培養。實驗分組設轉染組、陰性對照組和空白對照組。使用FAK siRNA對轉染組細胞進行轉染;使用無意義序列(siRNA-NC)siRNA對陰性對照組細胞進行轉染;空白對照組細胞不轉染任何RNA。
1.2.4qPCR檢測FAK mRNA的表達及siRNA篩選 (1)取對數生長期的細胞,PBS洗滌,加入TRIzol試劑,細胞充分裂解后,加入氯仿,充分混勻,室溫放置5 min。離心后待溶液分層,吸取含RNA的上清液加入等體積的異丙醇混勻,室溫放置10 min。 離心后棄上清,加入75%乙醇洗滌沉淀,離心后用吸出剩余液體,干燥2~3 min后,溶解沉淀,確定所獲取的RNA的純度及濃度。(2)通過使用GoScript 反轉錄系統試劑盒,進行反轉錄反應,從而獲取cDNA;根據qPCR 試劑盒說明書,建立qPCR 反應體系。(3)選擇沉默效率最佳的siRNA用于后續實驗。
1.2.5Western blot法檢測FAK 蛋白的表達 在細胞中加入RIPA裂解液,冰浴裂解后6 000 r/min離心5 min,收集上清液。稱取100 mg的BSA制備標準蛋白溶液,Bradford法測定蛋白濃度。嚴格按照Wes 12~230×103Rabbit Master kit及Wes 12~230×103Master kit with split Buffer試劑盒說明書的步驟進行加樣操作。一抗、二抗均孵育30 min,使用Proteinsimple Wes儀器對樣品進行檢測,得出實驗結果。
1.2.6流式細胞儀檢測細胞凋亡情況 細胞接種于6孔板,第2天進行siRNA轉染;轉染后6 h換新鮮培養基,37 ℃、5% CO2培養箱中繼續培養;轉染后48 h收集各孔內上清液,貼壁細胞胰酶消化后用相應的上清液重懸收集;離心,PBS洗滌細胞,Binding Buffer 重懸細胞,加入Annexin V-FITC 及碘化丙啶(PI)試劑,混勻,室溫避光染色5~15 min,1 h內流式細胞儀檢測結果。
1.2.7Transwell小室法檢測細胞侵襲力 細胞經胰蛋白酶消化、離心后,重懸細胞,配制細胞懸液;預先在Transwell小室的上室上表面涂布已稀釋的matrigel基底膠,冰上風干。將配置好的100 μL細胞懸液加入上室,將含有10% FBS的DMEM培養液500 μL加入下室;在培養箱中放置20 h后,結晶紫染色固定;清水沖洗,拭去上室上表面的細胞;倒置顯微鏡下觀察、拍照和計數。
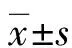
2 結 果
2.1沉默FAK基因對CAL-27細胞FAK mRNA表達的影響 qPCR檢測空白對照組、陰性對照組及siRNA-1組、siRNA-2組、siRNA-3 3個轉染組,FAK mRNA相對表達水平分別為1.000 0±0.037 6、1.097 4±0.022 0、0.513 6±0.034 3、0.328 6±0.016 2、0.233 2±0.001 6。3個轉染組中FAK mRNA的表達水平明顯下降,低于空白對照組和陰性對照組,差異有統計學意義(FsiRNA-1=286.42,PsiRNA-1<0.01;FsiRNA-2=729.99,PsiRNA-2<0.01;FsiRNA-3=1 060.91,PsiRNA-3<0.01),見圖1。其中,轉染siRNA-3組的沉默效率最高。

圖1 各組細胞FAK mRNA表達變化
2.2沉默FAK基因對CAL-27細胞FAK 蛋白表達的影響 Western blot檢測空白對照組、陰性對照組和轉染組中FAK蛋白的相對表達量分別為0.010 59±0.003 18、0.008 58±0.001 67和0.004 47±0.001 25。轉染組中FAK 蛋白的表達量明顯低于空白對照組和陰性對照組,差異有統計學意義(F=6.04,P<0.05)(圖2、3)。沉默FAK基因,舌鱗癌細胞FAK 蛋白的表達量明顯降低。

圖2 各組細胞FAK 蛋白表達變化

圖3 各組細胞FAK 蛋白表達情況
2.3沉默FAK基因對CAL-27細胞凋亡的影響 流式細胞儀檢測結果顯示空白對照組、陰性對照組和轉染組的凋亡率分別為(3.98±0.54)%、(3.21±0.94)%和(6.34±0.91)%,轉染組細胞凋亡率明顯高于陰性對照組和空白對照組,差異有統計學意義(F=11.89,P<0.01),見圖4、5。FAK基因表達沉默后,舌鱗癌細胞的凋亡率顯著提升。

圖4 沉默FAK基因對CAL-27細胞凋亡的影響

A:空白對照組;B:陰性對照組;C:轉染組
圖5各組細胞凋亡情況
2.4沉默FAK基因對CAL-27細胞侵襲能力的影響 Transwell法細胞體外侵襲實驗顯示,空白對照組、陰性對照組、轉染組中細胞穿過上室Matrigel 和聚碳酸酯膜的細胞數分別為(41.27±4.11)個、(42.60±4.06)個和(32.70±3.19)個,轉染組穿膜細胞的個數明顯少于陰性對照組和空白對照組,差異有統計學意義(F=5.93,P<0.05),見圖6。

A:空白對照組;B:陰性對照組;C:轉染組
圖6沉默FAK基因對CAL-27細胞侵襲能力的影響(Transwell×200)
3 討 論
人體內多種轉錄因子(如核因子κB、p53蛋白及T細胞特異性轉錄因子-1等)的結合位點均包含于FAK的核心啟動子中, FAK受這些轉錄分子的調控,成為多種信號通路的“交通樞紐中心”[2]。FAK通過這些信號通路廣泛參與了腫瘤發生、發展過程中的多個環節;作用涉及了腫瘤細胞的遷移、黏附、侵襲、增殖及凋亡等多種生物學行為;其既可作為單一因素對腫瘤產生影響,也可以與其他因素聯合發揮作用[3-4]。在正常的舌體上皮細胞中,FAK的表達呈陰性或弱陽性[5], 這對維持舌上皮細胞正常的生理活動是必不可少的;但在舌鱗癌相關的細胞中,FAK的表達明顯升高,這從側面提示FAK可能是影響腫瘤發生、發展進程的關鍵因素之一。
RNA干擾技術是近年發展起來的一種可以利用雙鏈RNA,高效、特異性地降解細胞內同源信使RNA,從而使靶基因表達沉默的新技術,現已被廣泛運用于基因功能研究和腫瘤的基因治療領域[6]。本實驗采用特異性的FAK siRNA重組質粒對舌鱗癌細胞進行轉染。所設計的3種FAK siRNA均能使FAK mRNA的表達水平明顯降低,沉默效應在轉染后48 h時達到了最高值。但本實驗中的3個干擾質粒對靶基因的抑制效應不同,其中以FAK siRNA-3沉默效果最好。考慮這種現象可能與位置效應有關,3種干擾質粒分別作用于同一基因的不同靶點,從而產生了不同干擾效果。因此,有必要對干擾序列進行篩選優化,以求達到更為理想的應用效果。Western blot檢測顯示FAK siRNA轉染舌鱗癌細胞后抑制了FAK蛋白的表達,而對照組細胞則沒有上述的抑制現象,這也同時證明了FAK siRNA的特異性。
腫瘤的發生、發展與細胞的存活和凋亡失調有著密切關系。在本實驗中,通過流式細胞儀技術檢測發現,沉默FAK基因能誘導舌鱗癌細胞的凋亡。已有的研究表明,FAK 主要通過以下3條途徑介導細胞的生存和凋亡:(1)通過PI3K-PKB信號通路,FAK可以最終滅活一系列細胞凋亡相關蛋白(如Bad、GSK3等),提供細胞生存所需的信號[7]。(2)通過Src-Ras-JNK信號通路,不需要外界提供生長因子,細胞外基質與FAK介導的細胞生存信號可以直接得到激活[8]。(3)通過FAK-p53通路,FAK能與p53結合,引起p53多聚泛素化,p53被細胞內蛋白酶降解,凋亡蛋白的信號被阻斷,促使細胞周期停滯,阻止了細胞的凋亡[9]。目前有關FAK基因沉默誘導舌鱗癌細胞凋亡的確切的分子機制尚不十分清楚,仍有待進一步研究。
侵襲性是舌鱗癌惡性程度的主要指標之一,與舌鱗癌患者預后密切相關。在本實驗中,通過Transwell法檢測發現沉默FAK基因能有效抑制舌鱗癌細胞的侵襲能力。癌細胞侵襲能力的變化很大程度上取決于腫瘤細胞黏附性、運動能力及基質水解酶活性的改變[10]。FAK可以促使腫瘤細胞形成片狀或刺狀偽足,讓細胞在形態學上發生改變,具備侵襲性的表型,進而調節細胞的運動[11-12]。已有的體內實驗也表明,FAK的過表達可以使腫瘤細胞更易侵犯周圍組織,加速轉移[1]。此外,通過FAK-pl30CAS信號通路,FAK還可以活化下游分子基質金屬蛋白酶(MMP)-2、MMP-9。在腫瘤侵襲和轉移的過程中,構成組織學屏障的基底膜(BM)和細胞外基質(ECM),有阻止、限制腫瘤細胞侵襲和轉移的功能[13]。作為基質金屬蛋白酶MMPs家族成員的MMP-2和MMP-9,能有效降解細胞外基質和基底膜中各種膠原纖維和蛋白,破壞組織學屏障,促進腫瘤細胞的侵襲和轉移[14-15]。
綜上所述,沉默FAK基因可誘導舌鱗癌細胞CAL-27的凋亡,有效抑制其侵襲能力,提示FAK有望成為抑制舌鱗癌生長和轉移的新靶點,但具體的作用機制仍需進一步地研究。

