miR-155在3-oxo-C12-HSL阻礙人單核細胞源性樹突狀細胞成熟過程中的表達變化
李沫,吳行貴,李啟偉,李有強
(1廣東省中醫院,廣州 510006;2廣州中醫藥大學第二附屬醫院)
銅綠假單胞菌(PA)是醫院內常見的引起嚴重獲得性感染的條件致病菌之一[1],可通過調節人體免疫細胞功能實現免疫逃逸從而引起機體致病。N-3-氧代十二烷酰-L-同型絲氨酸內酯(3-oxo-C12-HSL)是PA分泌的一種重要的信號分子。本課題組前期發現3-oxo-C12-HSL可阻礙單核細胞源性樹突狀細胞(Mo-DCs)成熟,從而介導免疫逃逸[2],但具體機制尚未完全明確。微小核糖核酸(miRNA)可調控免疫細胞的分化及免疫功能。近年來有研究[3~5]發現,miR-155的表達與樹突狀細胞(DCs)的成熟與功能密切相關。基于miR-155轉錄后調控功能,我們推測miR-155可能與3-oxo-C12-HSL阻礙Mo-DCs的成熟相關。2017年4~11月,本研究通過檢測與DCs成熟狀態相關的CD80、CD40、CD11c、HLA-DR及IL-10、IL-12水平,觀察miR-155在3-oxo-C12-HSL阻礙Mo-DCs成熟過程中的表達變化,并探討3-oxo-C12-HSL阻礙Mo-DCs成熟的機制。
1 材料與方法
1.1主要試劑PRIM1640、胎牛血清購于Gibco公司,人淋巴細胞分離液購于天津灝洋生物制品科技有限公司;重組人白介素4(rhIL-4)及人粒-單核細胞集落刺激因子(hGM-CSF)購于Peprotech公司,CCK-8試劑盒購于南京恩晶生物科技有限公司,3-oxo-C12-HSL購自Sigma公司,IL-12、IL-10及酶聯免疫吸附試驗試劑盒購于達科為科技有限公司;熒光標記APC-CD11c、FITC-CD80和PE-CD40購于eBioscience公司,PEcy5-HLA- DR、FITC-CD14、抗人CD14+免疫磁珠和磁架購于BD公司;小RNA抽提試劑盒購自美國Qiagen公司,RNA抽提試劑TRIzol和逆轉錄試劑Superscript Ⅲ購自美國Invitrogen公司,PCR試劑盒和DNA DL2000 Marker購自大連寶生物(TaKaRa)公司,引物由上海生工合成。
1.2方法
1.2.1人Mo-DCs的誘導和培養取廣州市血液中心分離的健康志愿獻血者血液中的白膜(富含單核細胞)4~10 mL,淋巴細胞分離液密度梯度離心法分選出單個核細胞。PBS洗滌后加入抗人CD14+免疫磁珠,室溫孵育30 min,上磁架8 min,分選出經流式細胞儀鑒定后純度大于95%的CD14+單核細胞。加入含10%胎牛血清PRIM1640完全培養基、終濃度500 U/mL的hGM-CSF、500 U/mL的rhIL-4培養。第3天半量換液,誘導培養6 d后收獲不成熟Mo-DCs。
1.2.2Mo-DCs的分組及處理將不成熟Mo-DCs制成細胞懸液接種于96孔板中,1×104/孔,懸液體積為200 μL。將其分為4組:陰性對照組、模型組、實驗組1、實驗組2。模型組加入終濃度為1 μg/mL的LPS,陰性對照組加入同體積PBS作為平衡。實驗組1和實驗組2分別加入終濃度為1 μg/mL的LPS后分別加入終濃度為50 μmol/L和100 μmol/L的3-oxo-C12-HSL。每組設3個復孔。
1.2.3Mo-DCs表型檢測48 h后收集各組Mo-DCs,調整細胞密度為1×106/mL;分別加入Anti-CD80-FITC、Anti-CD40-PE、Anti-CD11c-APC、Anti-HLA-DR-PEcy5,4 ℃避光孵育30 min;PBS洗滌,流式細胞儀檢測,記錄CD80、CD40、CD11c、HLA-DR平均熒光強度。
1.2.4各組Mo-DCs培養上清液IL-10、IL-12水平檢測48 h后收集各組Mo-DCs培養的上清液,按照ELISA試劑盒說明,測定上清液IL-10和IL-12水平。每孔重復3次,取3次實驗結果的平均值。
1.2.5Mo-DCs中miR-155檢測采用實時熒光定量PCR法。分組處理48 h后收集Mo-DCs,按QIAGEN公司小RNA抽提試劑盒說明書要求,提取各組細胞中小RNA。瓊脂凝膠電泳法鑒定純度,紫外分光光度法鑒定濃度。鑒定RNA后上Applied Biosystems?Veriti PCR儀進行逆轉錄。逆轉錄循環參數:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min,終止溫度4 ℃。取RT產物進行實時熒光定量PCR檢測,qPCR循環參數:95 ℃ 10 min,95 ℃ 15 s變性,60 ℃ 60 s退火,40個循環。miR-155引物序列:正向為5′-AGTGCGTGTCGTGGAGTC-3′,反向為5′-GGGGTTAATGCTAATTGTGA-3′。U6引物序列:正向為5′-CTCGCTTCGGCAGCACA-3′,反向為5′-AACGCTTCACGAATTTGCGT-3′。以U6作為內參,所有qPCR在Light Cycler?480(Roche Diagnostics)中進行反應,采用其自帶軟件進行數據分析。在指數期內得到樣品PCR循環反應的閾值(Ct),每個樣品均有3個復孔。以2-ΔΔCt計算miR-155相對表達量。

2 結果
2.1各組Mo-DCs表型檢測結果比較見表1。
2.2各組Mo-DCs培養上清IL-10、IL-12水平比較見表2。
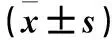
表1 各組Mo-DCs表型檢測結果比較
注:與陰性對照組相比,aP<0.05;與模型組相比,bP<0.05;與實驗組1相比,cP<0.05。
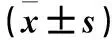
表2 各組Mo-DCs培養上清液IL-10、IL-12水平比較
注:與陰性對照組相比,aP<0.05;與模型組相比,bP<0.05;與實驗組1相比,cP<0.05。
2.3各組Mo-DCs中miR-155的表達 陰性對照組、模型組、實驗組1、實驗組2 miR-155相對表達量分別為0.93±0.41、2.14±0.63、1.29±0.51、1.06±0.48,模型組與陰性對照組相比,實驗組1、實驗組2與模型組相比,實驗組1與實驗組2相比,P均<0.05。
3 討論
PA是醫院內常見的引起嚴重獲得性感染的條件致病菌之一,目前臨床以抗生素治療為主[6,7]。但近年來PA對抗生素高度耐藥的現象日益嚴重,并表現出多重耐藥,如對亞胺培南、頭孢他啶、哌拉西林和環丙沙星等均具有耐藥性[8]。在PA感染嚴重威脅患者健康的嚴峻形勢下,深入研究PA感染形成的內在機制對PA感染的預防和非抗生素治療有重要意義。
DCs是機體免疫系統中功能最強的抗原遞呈細胞[9]。DCs的功能與其成熟狀態密切相關:成熟DCs傾向于激發免疫應答,而未成熟DCs傾向于誘導免疫耐受[10]。在免疫穩定狀態下,絕大多數DCs處于非成熟狀態,主要功能為識別和攝取抗原。與其功能相適應,未成熟的DCs表面表達低水平的主要組織相容性復合體MHC分子Ⅱ類分子(HLA-DR)、協同刺激分子B7(CD80、CD86)和黏附分子(CD40)等,并能分泌免疫抑制因子IL-10等。未成熟的DCs在攝取抗原或接受某些刺激因素如LPS后可以分化成熟。成熟DCs表面表達大量的HLA-DR、CD80、CD40等分子,并分泌IL-12等具有免疫激活作用的細胞因子[11],這是DCs將抗原呈遞給T淋巴細胞并激活免疫應答的基礎。因此,本研究選擇與DCs抗原遞呈功能密切相關的DCs表面標志物HLA-DR、CD80、CD40,以及與DCs成熟狀態相關的細胞因子IL-10、IL-12作為判斷DCs成熟狀態的判定指標。結果發現,與陰性對照組相比,模型組CD80、CD40、HLA-DR表達高,IL-10水平低,IL-12水平高,表明LPS可刺激人Mo-DCs的分化成熟。模型組CD11c與陰性對照組相比無明顯變化,因CD11c為髓源性DCs的標志,本實驗選用的是Mo-DCs,故本實驗模型有效可靠。
在病理條件下如各種感染,病原菌通過抑制DCs表面的信號分子和細胞因子表達水平阻礙DCs成熟,使DCs逐漸成為具有免疫抑制功能的半成熟或未成熟DCs[12],抑制免疫反應或誘導免疫耐受。3-oxo-C12-HSL是PA分泌的一種重要信號分子[13],可作用于樹突狀細胞、巨噬細胞及淋巴細胞等多種免疫細胞,調節PA的耐藥、毒力因子的表達和宿主免疫功能[2,14,15]。本研究結果發現,實驗組1、實驗組2較模型組CD80、CD40、HLA-DR表達低,IL-10水平高,IL-12水平低。表明3-oxo-C12-HSL可通過阻礙LPS誘導的Mo-DCs成熟而促進耐受性免疫應答的形成,參與免疫逃逸。
Mo-DCs的成熟狀態和功能與眾多基因的表達水平密切相關,而miRNA可通過轉錄及轉錄后水平調控基因的表達,在Mo-DCs的功能成熟過程中發揮重要的作用。miR-155是近年來已發現的與機體免疫調控密切相關的經典miRNA,有多項研究發現miR-155與Mo-DCs的成熟和功能相關:在不同TLR配體、TNF-α和IFN-α刺激的小鼠與人的多種DCs亞群分化成熟過程中,可觀察到其miR-155表達升高[16]。miR-155通過下調DCs特異性黏附分子結合非整合素因子表達,從而調節DCs的成熟及抗原攝取能力,從而影響機體的免疫應答[17]。基于miR-155調控基因表達水平的功能和與Mo-DCs的成熟狀態的相關性,我們推測miR-155可能與3-oxo-C12-HSL阻礙Mo-DCs的成熟相關。本研究結果發現,模型組較陰性對照組miR-155表達上調,表明miR-155可能通過調控相關基因的表達促進Mo-DCs的成熟,這與之前的一些研究[16,17]相符。實驗組1、實驗組2較模型組miR-155表達降低,表明3-O-C12-HSL可能通過降低miR-155表達阻礙Mo-DCs成熟,這與我們的推測一致。目前發現的miR-155與DCs成熟相關的信號機制主要有以下幾種。①PU.1:Martinez-Nunez等[17]發現,在人外周血DCs的成熟過程中miR-155表達上調,它直接抑制PU.1,影響DCs與真菌及HIV-gp120的結合能力。②SOCS-1:Lu等[3]發現,小鼠miR-155通過抑制SOCS-1,引起成熟DCs中IL-12p70的減少。③TAB-2:Ceppi等[18]用LPS刺激人Mo-DCs后發現miR-155表達上調,它作用于TAB-2,抑制TLR/IL-1炎性信號通路的活性。但是,3-oxo-C12-HSL具體通過何種機制降低miR-155表達從而阻礙Mo-DCs成熟,仍需進一步驗證。

