3-胺基-4-氯馬來酰亞胺類化合物的合成研究
孔德歡,安玉龍,邵志宇,趙圣印
(東華大學化學化工與生物工程學院,上海 201620)
鄰鹵胺化產物是有機合成中一類重要的中間體,通過對鹵原子的親核取代轉換成各種衍生物[1]。近年來,烯烴的氯胺化反應吸引了科學家的研究興趣,這樣的烯烴包括α,β-不飽和酮[2]、α,β-不飽和腈[3]等。此外,氯胺化產物,如2-氯甲基吡咯烷類化合物還是天然產物中重要的結構組成部分[4]。關于馬來酰亞胺類化合物氯胺化反應的報道很少,2016年,本課題組[5]報道了一類馬來酰亞胺類化合物氯胺化反應,但反應是以氯苯作為溶劑,給反應的后處理帶來了困難。
本文以馬來酰亞胺類化合物為原料,以正丁醇作為反應溶劑,脂肪胺作為氮的來源,氯化銅作為催化劑和氯的來源,反應回流3 h,實現了馬來酰化合物的氯胺化反應,共得到5個氯胺化產物(3a~3e),收率在68%~85%。其中3d和3e還未見相關文獻報道。
1 實驗部分
1.1 儀器與試劑
RY-1型熔點儀;Bruker AM-400型核磁共振儀(CDCl3為溶劑,TMS為內標);Agilent Technologies 5973N型質譜儀。所用試劑均為分析純,使用前未進行干燥處理。
1.2 條件優化
開始以1.0 mmol的N-苯基馬來酰亞胺1a和1.0 mmol的哌啶2a為底物模板來優化反應條件,如圖1所示,當在1.0 equiv的CuCl2催化下,以PhCl作為溶劑,反應回流3 h,可以得到分離產率為78%的氯胺化產物3a(Entry 1)。因此,在基礎上篩選了其他的溶劑,如 toluene(Entry 2)、1,4-dioxane(Entry 3)、THF(Entry 4)、n-BuOH(Entry 5)、MeCN(Entry 6)、CH2Cl2(Entry 7)、ClCH2CH2Cl(Entry 8),研究發現n-BuOH作為反應溶劑效果最好,可以得到分離產率為85%的氯胺化產物3a(Entry 5)。然而,增加催化劑CuCl2的量到1.5 equiv(Entry 9)和減少催化劑CuCl2的量到0.5 equiv(Entry 10),并沒有提高反應的產率。因此,取得了優化的反應條件,即1.0 mmol的馬來酰亞胺類化合物1、1.0 mmol的胺2和1.0 equiv的CuCl2混合在n-BuOH中回流反應3 h。
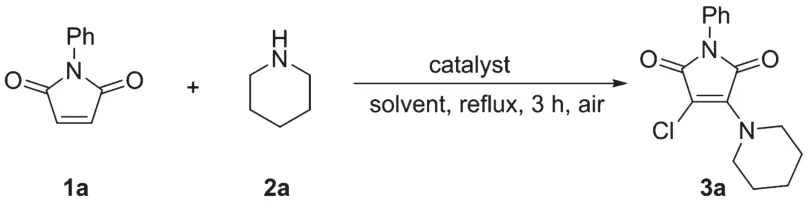
圖1 馬來酰亞胺類化合物的氯胺化反應的條件優化
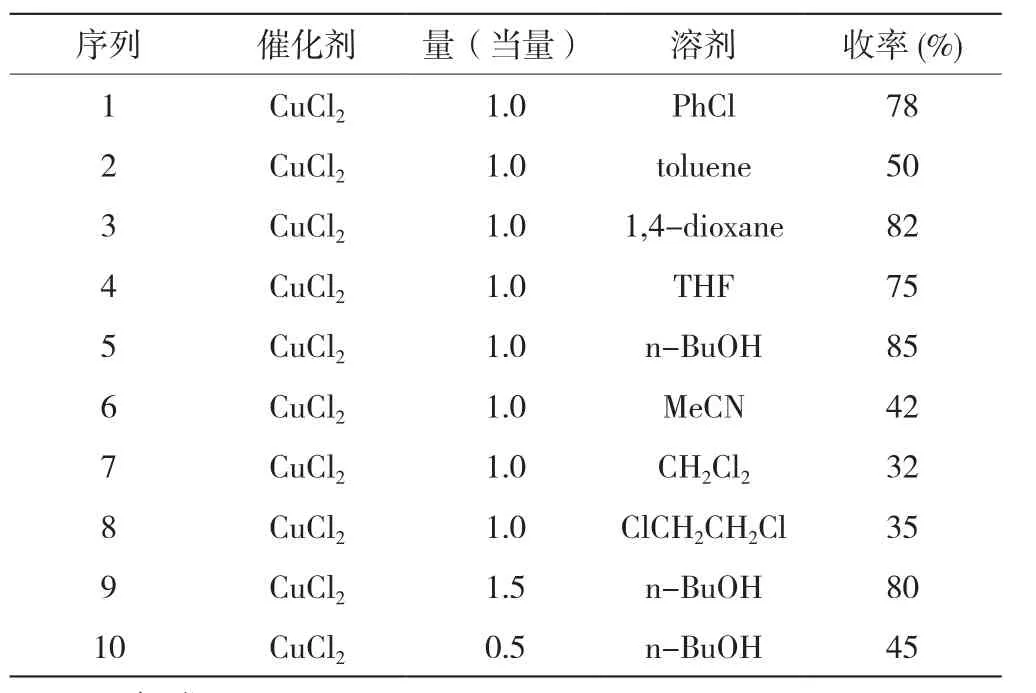
表1 馬來酰亞胺類化合物的氯胺化反應的條件優化一覽表
1.3 合成
在優化的反應條件下,對馬來酰亞胺類化合物的氯胺化反應進行了底物適用性拓展,如圖2所示,對不同N取代的馬來酰亞胺類化合物如N-苯基馬來酰亞胺、N-H馬來酰亞胺和不同取代的仲胺進行了探討,共得到5個3-胺基-4-氯馬來酰亞胺類化合物(3a~3e),收率在68%~85%。
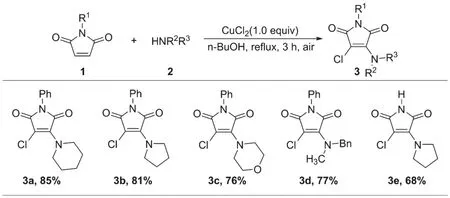
圖2 馬來酰亞胺類化合物的氯胺化反應的底物適用性拓展
1.3.1 操作步驟
向50 mL圓底燒瓶中加入1.0 mmol的馬來酰亞胺類化合物1和1.0 equiv的CuCl2,然后加入4 mL的n-BuOH作溶劑,最后加入1.0 mmol的胺2,將反應混合物置于回流的條件下反應3 h,TLC監控反應進程。反應結束后,將n-BuOH溶劑蒸除去,然后向反應混合物中加入10 mL的乙酸乙酯,通過硅藻土過濾出不溶物,然后用飽和食鹽水萃取有機相3次(3×60 mL),使用無水硫酸鈉干燥有機相,將有機相濃縮,最后通過柱層析分離得到3-胺基-4-氯馬來酰亞胺類化合物3。
1.3.2 產物表征
3a:洗脫劑(乙酸乙酯∶石油醚=1∶50),得到黃色固體0.25g,分離產率85%,熔點:126~128℃,1HNMR(400 MHz,CDCl3)δ1.73(s,6H),3.93(s,4H),7.33(t,J=7.5Hz,3H),7.44(t,J=7.8Hz,2H);13CNMR(101 MHz,CDCl3)δ24.14,26.79,49.80,94.07,126.28,127.67,128.98,131.50,141.53,164.70,165.60;MS(ESI):m/z=293[M+H+2]+,291[M+H]+.
3b:洗脫劑(乙酸乙酯∶石油醚=1∶10),得到黃色固體0.22g,分離產率81%,熔點:136~138℃,1HNMR(400MHz,CDCl3)δ1.93 ~ 2.01(m,4H),4.00(t,J=6.3Hz,4H),7.32(dd,J=7.3,5.4Hz,3H),7.40~7.47(m,2H);13CNMR(101MHz,CDCl3)δ25.20,50.58,90.61,126.21,12 7.56,128.96,131.66,140.27,164.10,166.17;MS(ESI):m/z=279[M+H+2]+,277[M+H]+.
3c:洗脫劑(乙酸乙酯∶石油醚=1∶5),得到黃色固體0.22g,分離產率76%,熔點:160~162℃,1HNMR(400MHz,CDCl3)δ3.83(t,J=8Hz,4H),4.03(t,J=8H z,4H),7.31(d,J=8Hz,2H),7.36(d,J=8Hz,1H),7.45(t,J=8Hz,2H);13CNMR(101MHz,CDCl3)δ48.47,67.06,95.95,126.27,127.91,129.07,131.23,140.68,164.64,165.22;MS(ESI):m/z=295[M+H+2]+,293[M+H]+.
3d:洗脫劑(乙酸乙酯∶石油醚=1∶20),得到黃色固體0.25g,分離產率77%,熔點:96~98℃,1HNMR(400MHz,CDCl3)δ3.35(s,3H),5.02(s,2H),7.27~7.37(m,6H),7.37~7.41(m,2H),7.44(t,J=7.8Hz,2H);13CNMR(101MHz,CDCl3)δ39.35,56.38,94.05,126.28,127.56,127.77,128.00,128.94,129.02,131.42,136.30,141.69,164.56,1 65.60;MS(ESI):m/z=329[M+H+2]+,327[M+H]+.
3e:洗脫劑(乙酸乙酯∶石油醚=1∶20),得到黃色固體0.14g,分離產率68%,熔點:98~100℃,1HNMR(400MHz,CDCl3)δ1.94(t,J=6.6Hz,4H),3.94(t,J=7.2Hz,4H),7.58(s,1H);13CNMR(101MHz,CDCl3)δ25.10,50.35,90.67,140.98,164.96,167.10;MS(ESI):m/z=203[M+H+2]+,201[M+H]+.
2 結果與討論
如圖2所示,對氯胺化反應的適用性進行了探討,對不同N取代的馬來酰亞胺類化合物如N-苯基馬來酰亞胺、N-H馬來酰亞胺和不同取代的仲胺進行了探討,共得到了5個3-胺基-4-氯馬來酰亞胺類化合物(3a~3e),收率在68%~85%。實驗發現,N-苯基馬來酰亞胺的反應性要比N-H馬來酰亞胺好(3b為81%,3e為68%),這可能是由于N-H馬來酰亞胺上的N-H鍵性質較為活潑,參與了一些復雜的反應。
3 結論
本文以馬來酰亞胺類化合物為原料,以CuCl2作為催化劑且提供氯的來源,以脂肪胺作為氮的來源,實現了馬來酰亞胺類化合物的氯胺化反應,共得到了5個3-胺基-4-氯馬來酰亞胺類化合物,收率在68%~85%。
[1]Chen D, Guo L, Liu J, et al. Functionalization of α,β-Unsaturated Esters and Ketones: A Facile and Highly Stereoselective One-Pot Approach to N-Protectedα,β-Dehydroamino Acid Derivatives[J].Organic Letters, 2005,7(5):921-924.
[2]Li G, Wei H X, Kim S H.Unexpected Copper-Catalyzed Aminohalogenation Reaction of Olefins Using N-halo-N-metallo-sulfonamide as the Nitrogen and Halogen Sources[J].Tetrahedron,2001,57(40):8407-8411.
[3]Han J L,Zhi S J, Wang L Y, et al.CuCl-Catalyzed Regio- and Stereose lectiveAminohalogenation ofα,β-Unsaturated Nitriles[J].European Journal of Organic Chemistry,2007(8):1332-1337.
[4]Kim W G, Kim J P, Kim, C J, et al. Benzastatins A, B, C, and D: New Free Radical Scavengers from Streptomyces nitrosporeus 30643. I.Taxonomy, Fermentation, Isolation, Physico-chemical Properties and Biological Activities[J]. Journal of Antibiotics,1996,49(1):20-25.
[5]An Y L, Zhang H H, Zhao S Y, et al. Cu/Ag Cocatalyzed Aerobic Oxidative Amination and CuCl2Mediated Aerobic Oxidative Chloroamination of Maleimides[J]. European Journalof Organic Chemis try,2016,2016(32):5405-5414.

