HPLC-MS/MS法測定嬰幼兒配方乳粉中膽堿、左旋肉堿、牛磺酸與肌醇
黃金鳳,尋知慶,汪晨霞,郭新東*,冼燕萍,盧宇靖,吳玉鑾
(1.廣州質量監督檢測研究院,廣東 廣州 511447;2.廣東工業大學 輕工化工學院,廣東 廣州 510006)
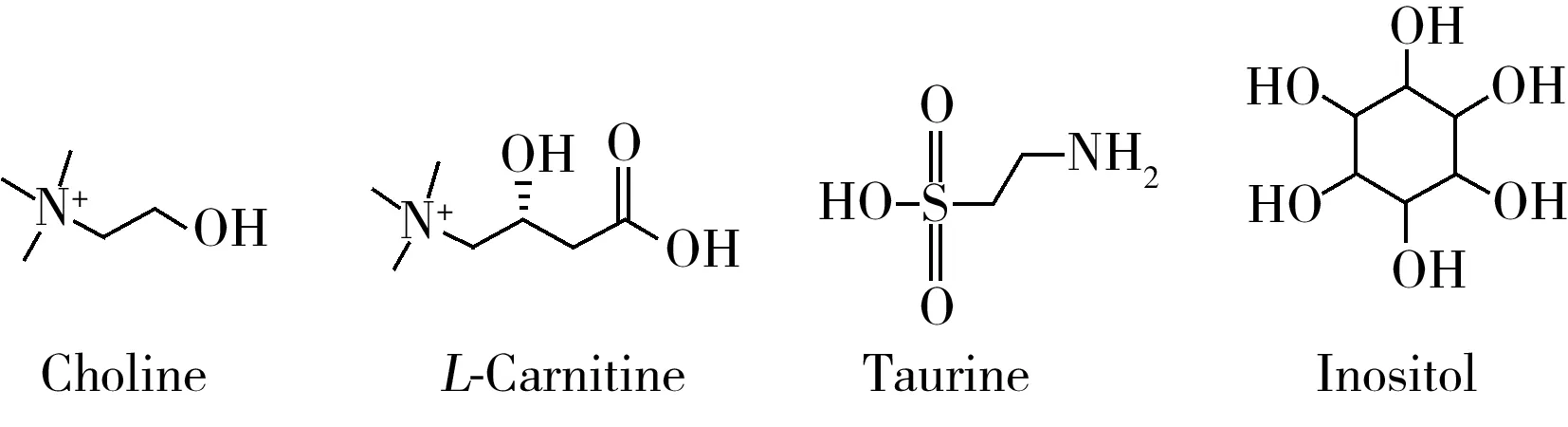
圖1 4種化合物的結構式Fig.1 Structures of four compounds
嬰幼兒配方乳粉因與母乳成分較接近而被用作母乳的替代品,膽堿、左旋肉堿、牛磺酸和肌醇為嬰幼兒配方食品可選擇添加的營養物質[1-2](結構式見圖1)。其中,膽堿是強堿性有機物,為卵磷脂組成成分,在生物體內常以游離態或與卵磷脂、鞘磷脂等結合態形式存在,當體內膽堿不足時會導致生長受阻、營養不良、繁殖力差等;左旋肉堿結構與膽堿類似,其可促使長鏈脂肪轉化為能量,缺乏時會造成細胞能量代謝的紊亂,導致肌肉無力、脂肪堆積等;牛磺酸又稱α-氨基乙磺酸,能促進機體的激素分泌,增強和改善機體的免疫力,牛磺酸攝入不足會影響嬰幼兒的智力或引起腦的疾病;肌醇是一種水溶性維生素,易溶于水,廣泛存在于各種天然動物、植物及微生物組織中,能降低膽固醇、促進脂肪代謝等,并對脂肪肝、肝硬化、肥胖等疾病有治療和預防作用。成人所需膽堿、左旋肉堿、牛磺酸和肌醇部分可由自身合成,也可通過食物補充,而嬰幼兒的各種器官未發育健全,自身合成量非常有限,絕大部分需通過食品補充。國家標準[1-2]規定了嬰幼兒配方食品中膽堿、左旋肉堿、牛磺酸和肌醇的添加量,膽堿添加量為1.7~12.0 mg/100kJ,左旋肉堿添加量不低于0.3 mg/100kJ,牛磺酸添加量為0~3.0 mg/100kJ,肌醇添加量為1.0~9.5 mg/100kJ。因此,建立嬰幼兒配方食品中膽堿、左旋肉堿、牛磺酸和肌醇的檢測方法十分必要。
現有國家標準GB 5413.20-2013[3]以比色法或分光光度法測定嬰幼兒食品或乳品中的膽堿;GB 29989-2013[4]使用分光光度法測定嬰幼兒食品或乳品中左旋肉堿。兩種方法均需酸或堿水解,將結合態或其它形式的膽堿、左旋肉堿均轉變為游離態,然后進行測定。GB 5009.169-2016[5]中使用鄰苯二甲醛(OPA)柱后衍生或丹磺酰氯柱前衍生高效液相色譜法測定牛磺酸,GB 5009.270-2016[6]規定了肌醇的微生物檢測或硅烷化衍生、氣相色譜檢測方法,但微生物法耗時長,衍生化法操作復雜,且高濃度的衍生劑較易殘留從而污染儀器。其它相關文獻報道的測定方法主要有高效液相色譜法[7-11]、氣相色譜法[12]、氣相色譜-質譜聯用法[13]、液相色譜-質譜聯用法[14-16]、離子色譜法[17-18]、電化學發光法[19]、氨基酸自動分析儀法[20]等,上述方法均僅涉及1~2種分析物,每種營養素建立一套獨立的檢測方法,耗時相對較長,檢測工作量大大增加。因此,本研究以嬰幼兒配方乳粉為研究對象,采用亞鐵氰化鉀和乙酸鋅沉淀蛋白后直接用高效液相色譜-串聯三重四極桿質譜儀檢測。方法前處理簡單快捷,其線性范圍、檢出限、穩定性、準確性均可滿足嬰幼兒配方乳粉中膽堿、左旋肉堿、肌醇和牛磺酸的分析要求。
1 實驗部分
1.1 儀器與試劑
DIONEX Ultimate 3000 高效液相色譜儀-Thermal TSQ Endura三重四極桿質譜儀 (HPLC-MS/MS,熱電公司),MS3 basic旋渦混合器(德國IKA公司),KQ-250DV型數控超聲波清洗儀(昆山市超聲儀器有限公司),Milli-Q去離子水發生器(美國Millipore公司),高速離心機(美國Sigma公司)。
標準品:氯化膽堿(純度為98.0%,CNW公司)、d9-氯化膽堿-三甲基(TRC)、左旋肉堿(純度≥98.0%,Dr.Ehrenstorfer公司)、d3-左旋肉堿鹽酸鹽(純度為98%,Cambridge Isotop公司)、肌醇(純度≥98.0%,CNW公司)、牛磺酸(純度≥98.0%,CNW公司)均購于上海安譜有限公司;甲醇、乙醇、乙腈(色譜純,德國Merck公司);乙酸銨、乙酸鋅、亞鐵氰化鉀(分析純,廣州化學試劑廠);實驗用超純水(18.2 MΩ·cm)由Milli-Q純水系統制備。
1.2 標準溶液的配制
分別稱取各標準品及內標10.0 mg(精確至0.1 mg ),置于100 mL 棕色容量瓶中,以水溶解并定容至刻度,得到質量濃度為100 mg/L 的單標儲備液。分別吸取適量的單標儲備液配制4種分析物的混合標準工作液,其中膽堿和左旋肉堿的質量濃度為1.0 mg/L,牛磺酸和肌醇的質量濃度為10.0 mg/L。臨用時,以水逐級稀釋成所需濃度的系列混合標準工作液。所有標準溶液于4 ℃冰箱中保存。
1.3 樣品處理
準確稱取乳粉樣品0.20 g(精確至0.001 g)于100 mL比色管中,加入d9-氯化膽堿-三甲基和d3-左旋肉堿鹽酸鹽內標溶液(均為100 mg/L)各100 μL,加40 mL 40 ℃水溶解,渦旋1 min,超聲提取10 min,加入1 mL 15%亞鐵氰化鉀溶液,渦旋混合均勻后,再加入1 mL 30%乙酸鋅溶液,渦旋混合均勻,用水定容至100 mL,室溫靜置10 min后,取上清液于4 000 r/min離心3 min,經0.2 μm濾膜過濾后待檢測。當測試溶液濃度超出線性范圍時,可用水進一步稀釋后再測定。同時做試劑空白試驗(除不加樣品外,其它步驟相同)。
1.4 儀器條件
高效液相色譜條件:色譜柱:ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm);流動相:A為5 mmol/L 乙酸銨,B為甲醇;梯度洗脫程序:0~3.0 min,15%B;3.0~5.0 min,15%~70%B;5.0~6.0 min,70%~15%B;后運行時間:2 min;流速:0.20 mL/min;進樣體積:5.0 μL;柱溫:30 ℃。
質譜條件:離子源:電噴霧離子源,正負模式切換(ESI+和ESI-);檢測方式:多反應監測(MRM);干燥氣:氮氣,溫度400 ℃;傳輸毛細管溫度:350 ℃;毛細管電壓:3 500 V(正模式)和2 500 V(負模式);相應的電離模式、監測離子對(m/z)、碰撞電壓和RF棱鏡參數見表 1。
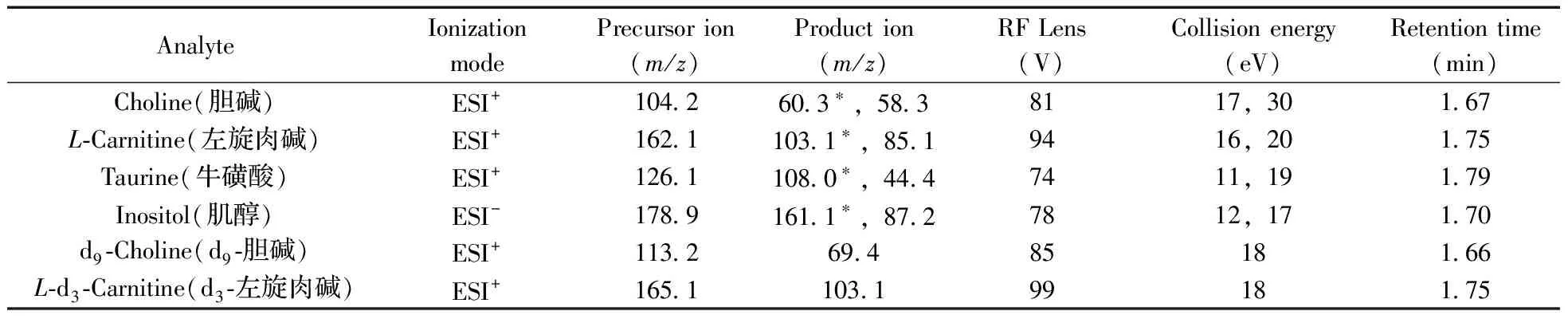
表1 化合物的MRM參數Table 1 The multiple reaction monitoring conditions of the analytes
*quantitative ion
1.5 樣品分析物的含量計算
樣品中分析物含量計算如下:Xi=(Csi-C0)V/m。式中:Xi為試樣中待測目標化合物的含量(mg/kg);Csi為待測試樣溶液中目標化合物的質量濃度(mg/L);C0為空白試驗中目標化合物的質量濃度(mg/L);V為濃縮至干后試樣的定容體積(mL);m為試樣質量(g)。
2 結果與討論
2.1 前處理條件的選擇
2.2.1提取溶劑的選擇膽堿、左旋肉堿、牛磺酸和肌醇水溶性好,可用水直接提取,但由于嬰幼兒配方乳粉中含有許多水溶性蛋白質和脂溶性營養成分,基質復雜,需凈化后檢測。脂溶性成分不溶于水,用水提取時只需將水溶性蛋白沉淀。實驗比較了乙腈、乙醇、乙酸、三氯乙酸、亞鐵氰化鉀/乙酸鋅等沉淀劑對蛋白質的沉淀效果。結果發現,乙腈和乙醇沉淀蛋白質緩慢,沉降不完全,樣品高速離心后也不澄清;乙酸和三氯乙酸對大多數乳粉樣品的蛋白質沉降效果較好,但部分乳粉樣品沉淀不完全;而亞鐵氰化鉀/乙酸鋅沉淀劑對所有樣品的沉淀效果好,低速離心后即可澄清。因此實驗采用亞鐵氰化鉀/乙酸鋅為沉淀劑。
2.2.2提取條件的選擇比較了振蕩提取和超聲提取兩種提取方法。結果表明,超聲提取操作簡便,提取效率較高。研究了超聲時間分別為5、10、15、20 min時的提取率,發現超聲10 min時,提取率基本達最大值,超聲時間超過10 min后對提取率無顯著影響。因此,確定超聲時間為10 min。
2.2 質譜條件的優化
膽堿和左旋肉堿均含有季銨鹽結構,分子帶正電荷;牛磺酸含有氨基,在酸性條件下易加氫形成正電荷化合物[M+H]+;肌醇含有6個羥基,易形成[M-H]-母離子,因此實驗選擇ESI正負切換電離模式,膽堿、左旋肉堿和牛磺酸使用ESI+模式,肌醇使用ESI-模式。實驗中以1.0 mg/L單標準溶液直接注入三重四極桿質譜儀,通過質譜自動優化MS/MS采集參數和特征碎片離子。表1列出了各化合物的母離子、子離子、RF棱鏡參數以及碰撞能量。在優化的碰撞能下,選擇每個母離子所對應豐度最大的子離子進行定量分析。
2.3 流動相條件的優化
ESI正負切換模式下檢測時,流動相多使用甲醇、乙腈和水。實驗比較了甲醇-水和乙腈-水流動相體系的分離效果,發現兩種流動相下分析物的響應強度差別不大,但采用甲醇-水體系的峰形明顯優于乙腈-水體系。此外,牛磺酸在兩種流動相體系下響應均不高,而在流動相中加入乙酸銨可明顯提高牛磺酸響應,且肌醇響應未見明顯降低;綜合考慮,實驗選擇甲醇-乙酸銨體系為流動相。考察了乙酸銨溶液濃度(3、4、5、6 mmol/L)對各組分分離度、響應值和峰形的影響。結果表明,乙酸銨溶液的濃度對4種組分的分離度、響應值無顯著影響。由于5 mmol/L乙酸銨溶液作為水相時的峰形最好,故選擇5 mmol/L乙酸銨溶液作為水相。
2.4 色譜柱的選擇
膽堿、左旋肉堿、牛磺酸和肌醇均屬大極性親水化合物,在常規C18色譜柱上很難實現保留,因此需選用親水性色譜柱進行分離。實驗比較了ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm)和BEH HILIC(2.1 mm ×150 mm,1.7 μm)的分離效果。結果發現,雖然兩種色譜柱對4種化合物的保留效果均不強,但ACQUITY UPLC HSS T3保留時間的穩定性更優;由于4種化合物的提取離子色譜圖之間互不干擾,可通過提取離子對各化合物進行定量,因此選擇ACQUITY UPLC HSS T3色譜柱。在優化的HPLC-MS/MS條件下,化合物的提取離子色譜圖如圖2所示。
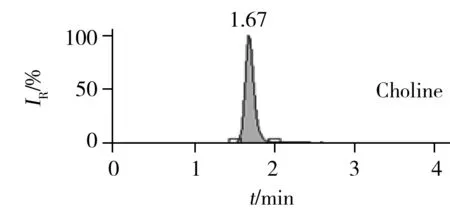
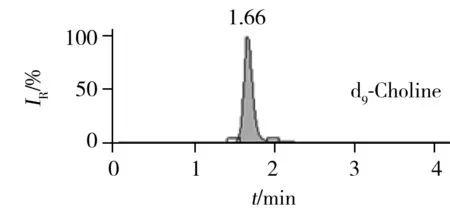
2.5 線性方程及檢出限
在最優實驗條件下,取質量濃度為0.01、0.02、0.05、0.1、0.2、0.5、1.0、2.0 mg/L的膽堿、左旋肉堿、牛磺酸和肌醇混合標準工作溶液進行HPLC-MS/MS檢測,每個濃度標準工作液中均含100 μg/L的同位素內標溶液。膽堿和左旋肉堿采用內標法計算,以目標物定量離子峰面積(A)和內標物色譜峰面積(Ai)的比值(y)對相應的目標物質量濃度(x,mg/L)進行線性回歸分析;牛磺酸和肌醇采用外標法計算,以目標物定量離子峰面積(y)對相應的目標物質量濃度(x,mg/L)進行線性回歸分析,實驗結果見表2。結果表明,膽堿和左旋肉堿在0.01~2.0 mg/L質量濃度范圍內線性關系良好,相關系數r2>0.999;牛磺酸和肌醇在0.1~2.0 mg/L質量濃度范圍內線性關系良好,r2>0.997。以3倍信噪比計算方法檢出限(LOD),得膽堿和左旋肉堿的LOD為1.5 mg/kg,牛磺酸和肌醇的LOD為15 mg/kg;以10倍信噪比計算方法定量下限(LOQ),得膽堿和左旋肉堿的LOQ為4.5 mg/kg,牛磺酸和肌醇的LOQ為45 mg/kg。本方法靈敏度高,適用于嬰幼兒配方乳粉中膽堿、左旋肉堿、牛磺酸和肌醇的定性和定量分析。
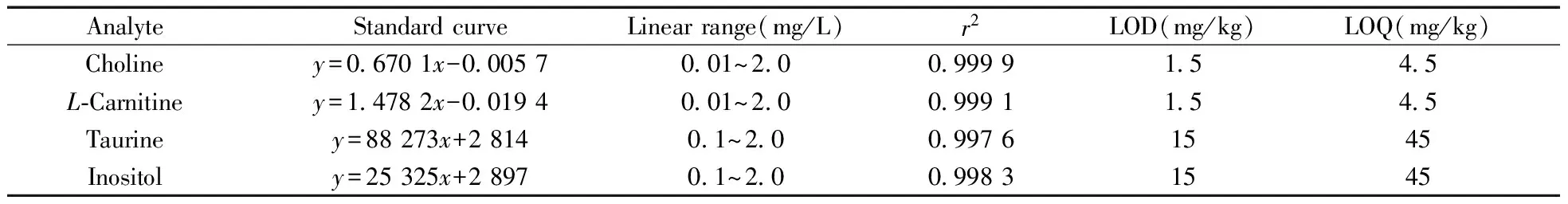
表2 4種分析物的線性方程、線性范圍、相關系數、檢出限及定量下限Table 2 Standard curves,linear ranges,correlation coefficients(r2),LODs and LOQs of 4 analytes
2.6 基質效應
基質效應是由樣品中復雜的干擾物抑制或增強分析物的響應導致,可用基質校準曲線的斜率與標準校準曲線斜率的比值進行評估[21-22]。由于左旋肉堿和膽堿使用內標法進行定量,內標校正了基質效應的影響,因此僅對牛磺酸和肌醇進行了基質效應研究。其標準曲線如表2所示,基質校準曲線可以通過使用樣品提取液作為溶劑獲得。結果表明,肌醇和牛磺酸的基質效應比值分別為0.91和0.87,表明兩者的響應可能被乳粉樣品中的干擾物質輕微抑制。考慮到嬰幼兒配方乳粉的復雜性,實驗得到的基質效應在可接受范圍內。
2.7 回收率與精密度
在最優實驗條件下,選取嬰幼兒配方乳粉樣品,分別添加3 個濃度水平的膽堿、左旋肉堿、牛磺酸和肌醇混合標準工作液,按照本方法進行前處理和檢測,每個濃度水平平行測定6 次,計算平均回收率和相對標準偏差(RSD),實驗結果見表3。4 種化合物在不同加標水平下的平均回收率為87.5%~102.4%,RSD為3.0%~7.3%。表明本方法精密度良好,能夠滿足嬰幼兒配方乳粉中膽堿、左旋肉堿、牛磺酸和肌醇的測定要求。
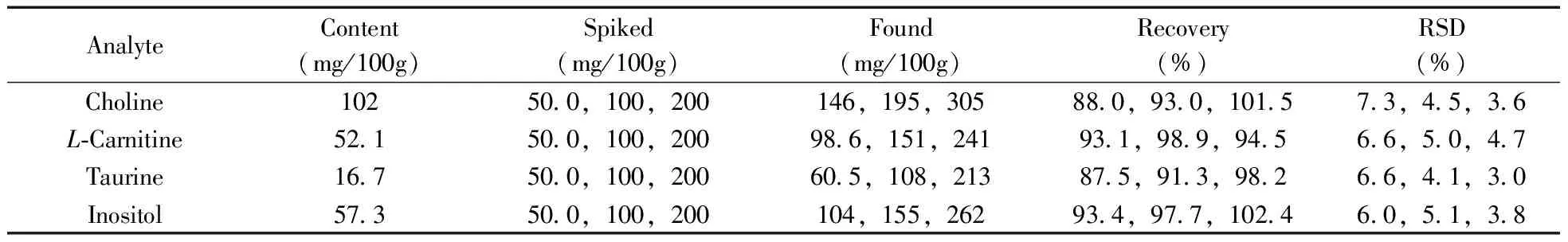
表3 樣品的加標回收率及相對標準偏差(n=6)Table 3 Spiked recoveries and RSDs for analytes(n=6)
2.8 準確度
為驗證本方法的準確性,實驗采用質控樣品進行確證。采用本方法對美國國家標準與技術研究院奶粉質控樣品SRM 1849a進行3次平行檢測,結果表明,所有結果均在質控樣品含量范圍內(表4)。
2.9 實際樣品的測定
在市場上隨機挑選10個品牌的嬰幼兒配方奶粉(標簽上均標注了該4種成分的含量),分別采用本方法以及現行有效的國家標準方法[3-6]進行測定。結果表明,兩種方法的測定結果一致(表5),且測定結果均符合國家強制性產品標準及標簽明示值的要求。
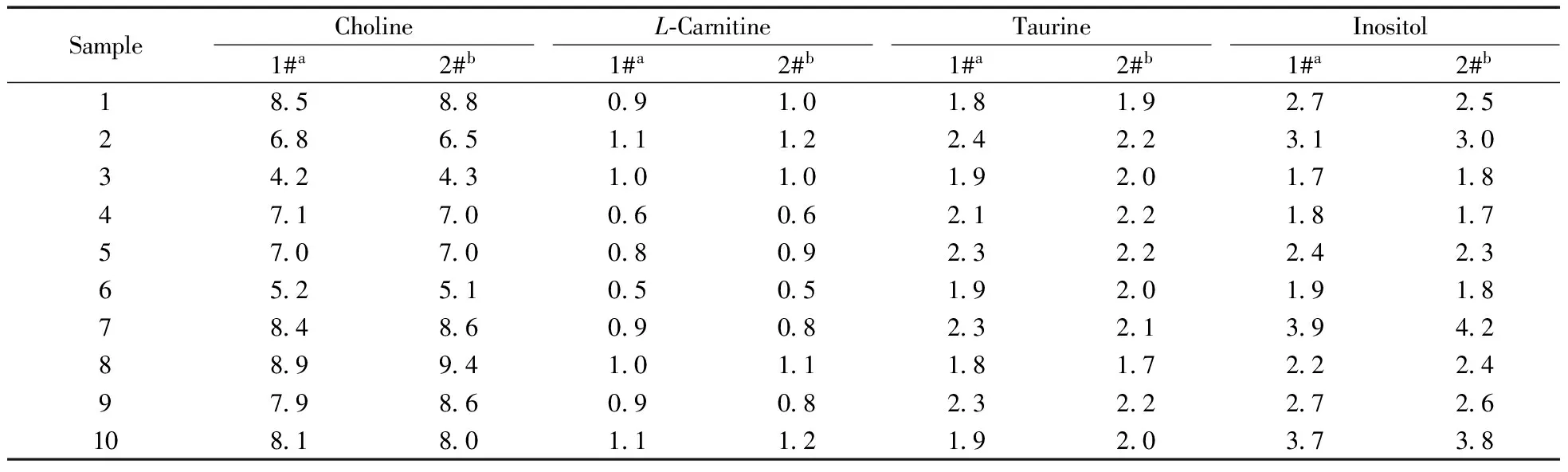
表5 實際樣品的測定結果Table 5 Analytical results for the market samples (mg/100kJ)
a:obtained by national standard method;b:obtained by the developed method
3 結 論
本研究針對嬰幼兒配方乳粉中膽堿、左旋肉堿、牛磺酸和肌醇尚缺少方便、快速同時檢測方法的現狀,利用同位素內標和HPLC-MS/MS,建立了嬰幼兒配方乳粉中該4種成分的同時檢測方法。結果表明,膽堿和左旋肉堿在0.01~2.0 mg/L范圍內,牛磺酸和肌醇在0.1~2.0 mg/L范圍內線性關系良好,膽堿和左旋肉堿的檢出限均為1.5 mg/kg,牛磺酸和肌醇的檢出限均為15 mg/kg。樣品基質加標測定結果表明該方法回收率高、精密度良好;質控樣品檢測以及實際樣品的測定結果表明方法準確度高,能滿足嬰幼兒配方乳粉中膽堿、左旋肉堿、牛磺酸和肌醇的定量檢測要求。
參考文獻:
[1] GB 10765-2010.National Food Safety Standard Infant Formula.National Standard of the People's Republic of China (食品安全國家標準 嬰兒配方食品.中華人民共和國國家標準).
[2] GB 10767-2010.National Food Safety Standard Older Infants and Young Children Formula.National Standard of the People's Republic of China (食品安全國家標準 較大嬰兒和幼兒配方食品.中華人民共和國國家標準).
[3] GB 5413.20-2013.National Food Safety Standard Determination of Choline in Foods for Infants and Young Children,Milk and Milk Products.National Standard of the People's Republic of China (食品安全國家標準 嬰幼兒食品和乳品中膽堿的測定.中華人民共和國國家標準).
[4] GB 29989-2013.National Food Safety Standard Determination ofL-Carnitine in Foods for Infants and Young Children,Milk and Milk Products.National Standard of the People's Republic of China (食品安全國家標準 嬰幼兒食品和乳品中左旋肉堿的測定.中華人民共和國國家標準).
[5] GB 5009.169-2016.National Food Safety Standard Determination of Taurine in Foods.National Standard of the People’s Republic of China (食品安全國家標準 食品中牛磺酸的測定.中華人民共和國國家標準).
[6] GB 5009.270-2016.National Food Safety Standard Determination of Inositol in Foods.National Standard of the People’s Republic of China (食品安全國家標準 食品中肌醇的測定.中華人民共和國國家標準).
[7] Liu X M,Liu B,Guo Y,Shen Y,Chen B.Chin.J.FoodHyg.(劉雪梅,劉波,郭園,沈遙,陳波.中國食品衛生雜志),2016,28(2):219-223.
[8] Kagawa M,Machda Y,Nishi H.J.Chromatogr.A,1999,857:127-135.
[9] Dai C B,Li J Q,Li J X.Sci.Technol.FoodInd.(戴傳波,李建橋,李健秀.食品工業科技),2007,4:222-223.
[10] Zhang Z G,Liu N,Jia Y H,Xie Y,Li Q.FoodFerment.Ind.(張志國,劉寧,賈云虹,謝焱,李琦.食品與發酵工業),2004,30(9):100-103.
[11] Li H Y,Chen X Z,Zhang S F,Zhao S H,Shao L L,Zhang D L.Mod.FoodSci.Technol.(李紅艷,陳小珍,張水鋒,趙素華,邵亮亮,張東雷.現代食品科技),2013,29(9):2300-2305.
[12] Cai Q X,Dai Z R,Zhang C X.J.QinzhouUniv.(蔡秋杏,戴梓茹,張晨曉.欽州學院學報),2011,26(6):44-46.
[13] Jiang R Q,Li M,Chang J J,Chen J,Hu G L,Zhou L.Sci.Technol.FoodInd.(姜瑞清,李梅,常建軍,陳軍,胡桂林,周琳.食品工業科技),2010,31(10):375-376.
[14] Zhu Q,Su L K,Zheng J G,Nong Y J.J.Instrum.Anal.(竺琴,蘇流坤,鄭家概,農云軍.分析測試學報),2012,31(3):355-358.
[15] Vernez L,Hopfgartner G,Wenk M,Krahenbuhl S.J.Chromatogr.A,2003,984:203-213.
[16] Xu D M,Chen Y,Zhang J,Yu Y C,Feng F,Zhang F,Chu X G.J.Instrum.Anal.(徐敦明,陳燕,張縉,余宇成,馮峰,張峰,儲曉剛.分析測試學報),2016,35(1):96-100.
[17] Chen J,Zhong X L,Yu Y H.Phys.Test.Chem.Anal.:Chem.Anal.(陳軍,鐘新林,余彥海.理化檢驗-化學分冊),2013,49(1):6-10.
[18] Zou X L,Li Y Q,Zeng H Y,Zhang J,Zheng B.J.Instrum.Anal.(鄒曉莉,黎源倩,曾紅燕,張婧,鄭波.分析測試學報),2009,28(4):470-473.
[19] Gong S Y,Liu M,Zhu C Y,Kang W J,Shi H M,Xu X D.Chin.J.HealthLab.Technol.(龔尚于,劉明,朱辰瑤,康維鈞,石紅梅,徐向東.中國衛生檢驗雜志),2015,25(11):1685-1688.
[20] Wang H J,Zhou X Q,Feng Z Q,Zeng N Q.Mod.FoodSci.Technol.(王洪健,周興起,馮志強,曾暖茜.現代食品科技),2012,28(3):348-350.
[21] Xun Z Q,Liu D H,Huang R R,He S,Hu D,Guo X D,Xian Y P.J.Sep.Sci.,2017,40:1966-1973.
[22] Xun Z Q,Huang J F,Li X Y,Lin S Y,He S,Guo X D,Xian Y P.Anal.Methods,2016,8:3953-3958.

