43例賁門失弛緩癥患者回顧分析
楊 琴,呂沐瀚,唐世孝
(西南醫科大學附屬醫院消化內科,四川瀘州 646000)
賁門失弛緩癥(achalasiaa,AC)是一種病因不明的以食管下括約肌(lower esophageal sphincter,LES)松弛異常及食管體部缺乏推進性蠕動為特征的食管運動功能障礙性疾病[1]。其發病可能與環境、病毒感染、自身免疫及遺傳有關,情緒及精神壓力可能為其誘發因素。AC的主要臨床癥狀為:吞咽困難、反酸、燒心、胸痛、體重下降等。主要檢查方法包括胃鏡、鋇餐造影、胸部CT、食管測壓等。現如今沒有根除此病的治療手段,均是通過消除由異常LES功能所引起的食管下段食物流出障礙,從而改善相關的癥狀[2]。治療方法包括:①藥物治療,主要是促進胃排空及降低食管壓力,如硝酸酯類、鈣通道阻滯劑等;②內鏡下治療:食管下段注射肉毒素、球囊(氣囊、水囊)擴張、支架擴張、POEM術治療;③外科手術:經胸或經腹的各種改良的食管賁門部黏膜外肌層切開手術(Heller手術)。該研究擬通過分析收集的43例住院患者的相關信息來探討關于AC的檢查及治療方案的臨床意義。
1 資料與方法
1 資料
1.1 患者信息
我院2014年1月至2017年6月期間,經胃鏡、鋇餐造影等相關檢查診斷為AC的具有完整信息的住院患者共計43例,并排除如食管腫瘤性疾病或強酸、強堿所致器質性吞咽困難患者,或者已明確診斷為GERD所致的以反酸或燒心為主要表現的患者,搜集其姓名、性別、年齡、病程、誘因、主要癥狀、既往診治情況、胃鏡及鋇餐造影檢查結果、治療方式、住院日、住院費用及治療后3個月隨訪情況,將上述信息進行統計分析。
1.2 儀器
胃鏡Olympus CV-260SL 、Olympus GIF-260,數字胃腸SDR-100購自北京島津醫療器械有限公司
2 方法
2.1 診斷方法
2.1.1 胃鏡檢查
可見食管腔內食物潴留,下段可見食管狹窄,狹窄部位以上可見食管擴張。胃鏡下活檢還可排除食管腫瘤等病變。
2.1.2 X線鋇劑造影檢查[3]
典型的特點可見食管不同程度的擴張,蠕動減弱或停止,狹窄處呈“鳥嘴征”。
2.1.3 食管測壓[4-5]
食管測壓是臨床診斷AC的金標準,可以測定食管下段括約肌的蠕動及異常松弛以及食管的平均壓力。
2.2 治療方法
2.2.1 內科藥物
硝酸異山梨酯片5 mg早餐前舌下含服、硝苯地平片10 mg早餐前舌下含服。
2.2.2 內鏡下治療
水囊擴張、POEM術
2.3 療效判定
治療3個月后隨訪患者,根據癥狀、胃鏡或鋇餐造影檢查結果綜合判斷。顯效:癥狀完全緩解,相關檢查顯示病變消失。有效:癥狀部分緩解,相關檢查顯示病變改善,但未完全消失。無效:癥狀無緩解甚至加重,或癥狀緩解后復發,相關檢查顯示病變無改善或加重。某種治療方式的有效率=(該治療方式顯效患者人數+有效患者人數)/該治療方式總人數。
2.4 統計方法
使用SPSS 17.0軟件對計數資料進行c2檢驗,對計量資料進行t檢驗。
2 結 果
2.1 患者各年齡段患病情況比較
43例患者中男22例(51.16%),女 21例(48.84%),男女比為1.05∶1。性別差異無統計學意義(P>0.05)。年齡區間為16~81歲,男女兩組年齡均呈正態分布,采用均數±標準差,整體平均年齡為(44.56±15.18)歲,男性平均年齡為(45.19±15.76)歲,女性平均年齡為(43.90± 14.51)歲,男女年齡差異無統計學意義(t=0.29,P=0.3874)以50~59歲為發病高峰期(見圖1)。
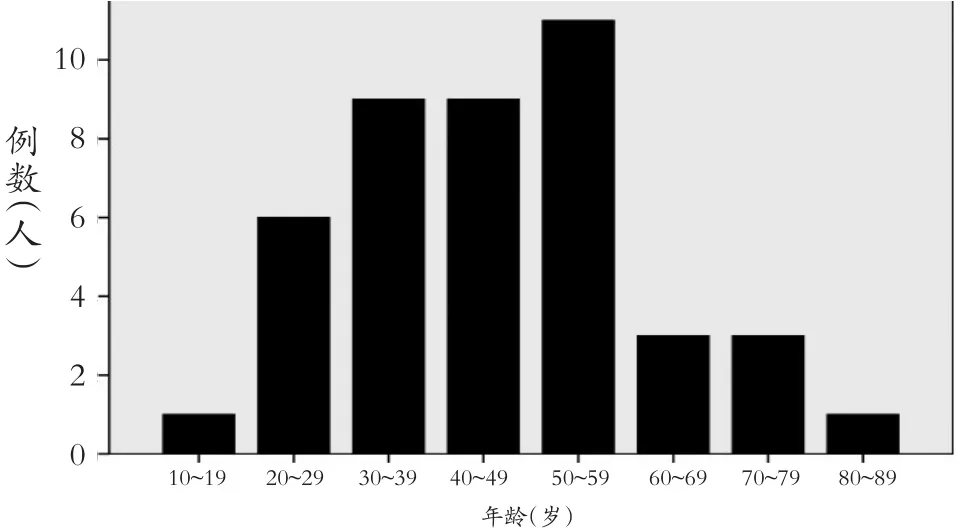
圖143 例AC患者各年齡段患病情況
2.2 AC患者不同誘因比較
43例患者中有誘因30例(69.8%),其中與飲食相關10例(33.3%),與情緒相關12例(40.0%),與精神因素相關11例(36.7%),無誘因13例(30.2%)。有誘因者比例更高,誘因中飲食、情緒、精神三者對AC的發病差異無統計學意義(P=0.866)
2.3 AC患者常見的臨床癥狀
43例患者表現為吞咽困難10例(23.3%),惡心和(或)嘔吐22例(51.2%),反酸和(或)燒心29例(67.4%),體重下降14例(32.6%),腹痛、腹脹14例(32.6%),胸痛、胸悶等11例(25.6%)(見圖2)。
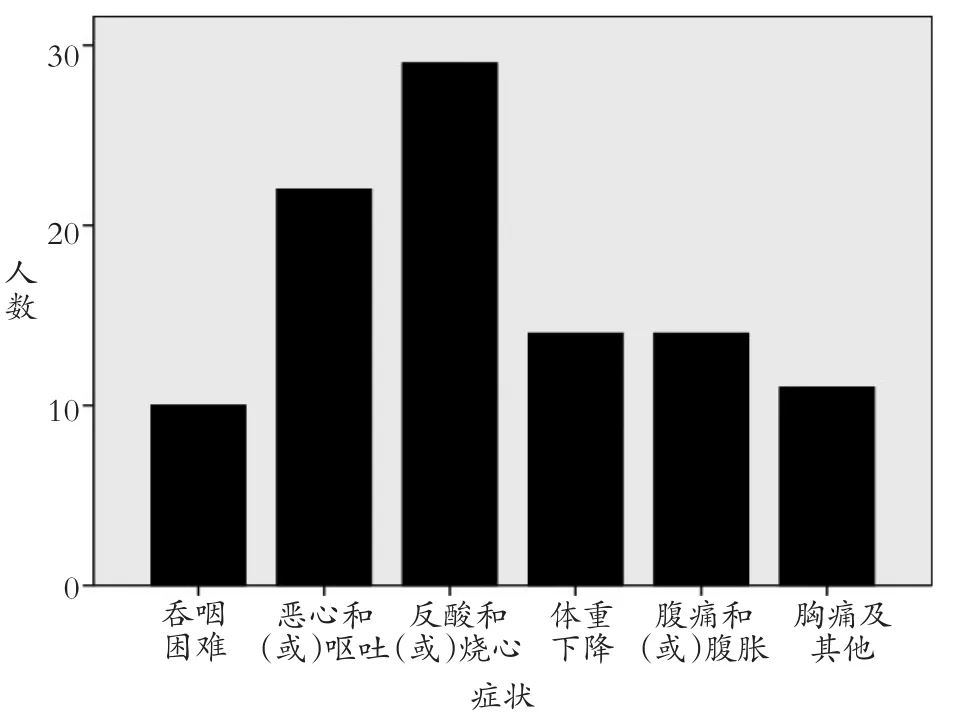
圖2 43例AC患者各癥狀對比
2.4 AC患者胃鏡及壩餐檢查情況比較
43例患者胃鏡檢查陽性21例(檢出率48.8%),鋇餐檢查陽性35例(檢出率81.4%),其中胃鏡及鋇餐均陽性14例,均陰性1例(見表1),二者檢查均陰性者依據院外食管測壓結果及患者癥狀診斷為AC。胃鏡及鋇餐造影檢查對于AC患者的診斷差異有統計學意義(P=0.019)。43例患者中合并其他食管疾病最多的是GERD16例。
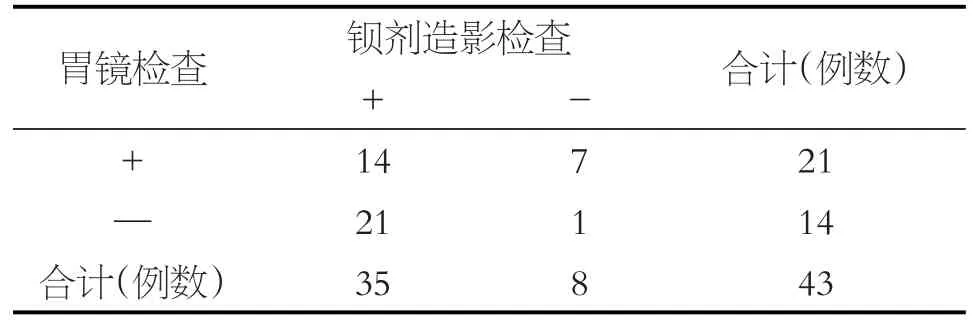
表1 43例AC患者胃鏡及鋇餐造影檢查結果對比
2.5 AC患者不同治療方式效果的比較
43例患者20例行藥物治療,3月后隨訪顯效4例,有效2例,無效14例,有效率為30.0%。16例行水囊擴張治療,顯效4例,有效2例,無效9例,失訪1例,失訪者為食管癌患者,已死亡,記為無效,有效率為37.5%。7例行POEM治療,顯效5例,有效1例,無效1例,有效率為85.7%。43例患者中總顯效12例,有效6例,無效25例,總有效率41.9%(見表2)。3種治療方式差異有統計學意義(c2=6.812,P=0.033)。
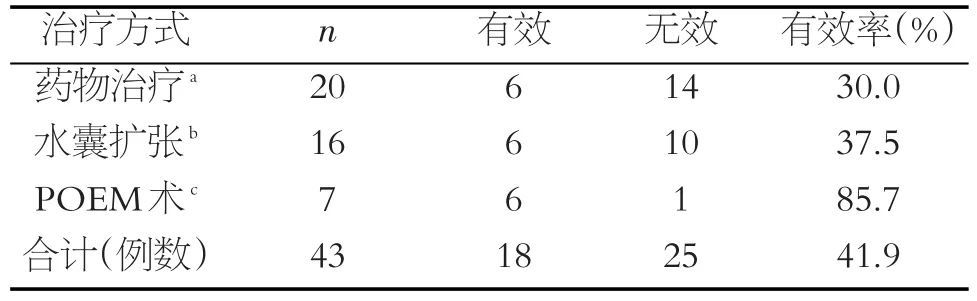
表2 43例AC患者不同治療方式效果對比
2.6 不同的治療方式的AC患者的住院日及住院費用情況
43例患者中3種不同治療方式平均住院日及平均住院費用(見表3)。
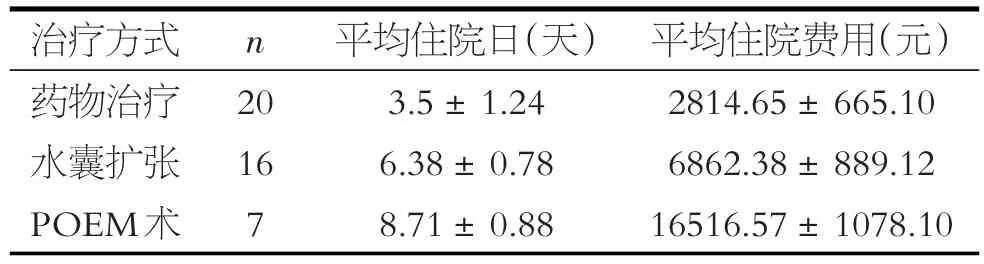
表3 43例AC患者平均住院日及平均住院費用
3 討 論
AC是一種少見病,國內有[6]研究報道該病在成年人群中發病率僅為0.30~1.63/10萬人·年,國外有研究報道其發病率為1.6/10萬人·年[7],1/10萬人·年[8]。有研究[9-10]表明AC的發生在性別上差異無統計學意義,且以30~60歲為發病高峰。本研究男女比例1.05∶1,性別構成差異無統計學意義(P > 0.05),在30~60歲年齡段發病率為67.4%,與多數研究相符合,提示我們在以后的診療中需關注30~60歲人群此病的可能性。
AC病因至今不明確,有研究[11]認為精神因素為其主要誘因,可通過腦-腸軸機制影響感覺功能及食管動力。本研究中該病有誘因者比例較無誘因者高(2.3:1),但是誘因中飲食、情緒因素及精神因素三者的構成比差異無統計學意義(P=0.866),仍需大樣本數據進行研究,并需關注除上述3種誘因之外有無其他可能誘因影響該病的發生。
有研究[12]認為AC的癥狀主要為吞咽困難、反流(包括燒心)、胸骨后疼痛及體重下降。本研究各癥狀的發生率與外文報道有區別。AC患者感到反流和(或)燒心可能與食管蠕動功能減弱、排空受阻,長期食物潴留引起食管黏膜損傷引起不適,這也可能和患者感到胸痛不適有關。主要的檢查方式為胃鏡、影像學、食管測壓。胃鏡可見食管腔內食物潴留,下段可見食管狹窄,狹窄部位以上可見食管擴張。胃鏡還可排除食管腫瘤、病理性食管狹窄等病變[5,7]。影像學檢查主要指鋇餐食管造影及CT掃描,典型的鋇餐食管造影可見“鳥嘴征”。診斷的金標準為高分辨率食管測壓,可以發現食管下括約肌的蠕動障礙,表現為蠕動減弱或停止。有研究認為鋇餐造影的陽性檢出率較胃鏡高,且因該方式無創傷、無痛苦,更易被大眾接受,與本研究鋇餐劑胃鏡陽性率分別為81.8%、48.8%結果相符合,兩者差異有統計學意義。但是對于AC早期患者,食管病變往往不典型,容易漏診,故胃鏡及鋇餐造影檢查均是必要的。該病最易合并GERD,在診斷過程中需注意鑒別。
AC的病因至今尚不明確,現有的治療方法并不能有效逆轉或者阻止賁門周圍括約肌神經叢的退行性病變[5]。治療的核心要點即早期對該病的診斷和預防,以便維持食道的結構和功能。目前較為可行的治療方案的目的是通過降低LES的張力來緩解食管流出障礙,包括藥物治療、內鏡治療以及外科手術干預治療。用于松弛平滑肌,減輕LES張力的藥物能有效緩解癥狀,然而這種效果在臨床上是有限的,通常情況下這些藥物被用于不能耐受侵襲性治療方案的短期替代治療或者作為最終治療方案前的過渡[13]。內窺鏡肉毒素注射能有效緩解癥狀,但效果往往是短暫的[14],與口服藥物制劑一樣,此方法適用于那些不能忍受侵入性治療的病人。內鏡下水囊擴張方法能準確定位于LES處膨脹,能有效阻斷肌肉在該部位的收縮壓力,進而達到治療的目的[15-16]。另外一種有效治療方案為POEM,自2008年在全球推廣以來,獲得了廣泛的認可,該內鏡下手術能在短期內明顯改善患者癥狀,相比于經腹腔Heller肌切開術的創傷性更小,且能達到水囊或氣囊擴張的效果[17-18]。POEM優點是從食道到胃的肌肉切開的長度可以自由調整,以適應個別情況,這使POEM更合適,更安全[19]。不僅如此,相比于其他治療方法,POEM幾乎適用于所有種類的食道運動障礙的患者[20-21]。綜合來說POEM方案更具有臨床指導意義,結合本研究藥物治療、水囊治療、POEM治療的有效率分別為30.0%、37.5%、85.7%,POEM治療較另外兩種治療方式的效果更為顯著,差異有統計學意義,結果相一致。不足之處在于行POEM治療患者平均住院日較其他治療方案長,且所產生的平均住院費用也相對較高。因此,我們建議患者結合自身病情以及經濟條件選擇更為適合的治療方案。
本研究的不足在于我院未開展高分辨率食管測壓,可能導致某些病例診斷有誤差,且未收集到經胸或腹Heller肌切開術患者,可能對患者治療方式的選擇有影響,另外可加強隨訪力度,如治療后6月、1年等來評估治療效果。
4 結論
在AC的診斷中鋇餐造影檢查陽性率優于胃鏡,藥物及水囊擴張為多數人選擇的治療方式,但DOEM較前兩者更為有效,在以后的工作中,需要大樣本,多中心的研究對AC的發病機制、診治及預后作進一步探討。
1. 文光旭,馬洪升.賁門失弛緩癥的治療現狀[J].華西醫學,2009,12:3 273-3 275.
2. 王剛,張遜.賁門失弛緩癥的治療現狀及進展[J].中國胸心血管外科臨床雜志,2014,1:107-111.
3. 張月.49例賁門失弛緩癥病例回顧分析[D].大連醫科大學,2017.
4. Pandolfino J E,Ghosh S K,Rice J,et al.Classifying esophageal motility by pressure topography characteristics:a study of 400 patients and 75 controls[J].Am J Gastroenterol.2008,103(1):27-37.
5. Tuason J,Inoue H.Current status of achalasia management:a review on diagnosis and treatment[J].J Gastroenterol.2017,52(4):401-406.
6. 李淑香,曲波,李惠.賁門失弛緩癥發病機制的研究進展[J].世界華人消化雜志,2015,8:1 252-1 257.
7. Arora Z,Thota PN,Sanaka MR.Achalasia:current therapeutic options[J].Ther Adv Chronic Dis,2017,8(6-7):101-108.
8. Krill JT,Naik R D,Vaezi MF.Clinical management of achalasia:current state of the art[J].Clin Exp Gastroenterol,2016,9:71-82.
9. Reas DL,Zipfel S,Ro O.Is it an eating disorder or achalasia or both?A literature review and diagnostic challenges[J].Eur Eat Disord Rev,2014,22(5):321-330.
10. Francis DL,Katzka DA.Achalasia:update on the disease and its treatment[J].Gastroenterology, 2010, 139(2):369-374.
11. Bredenoord A J,Fox M,Kahrilas P J,et al.Chicago classification criteria of esophageal motility disorders defined in high resolution esophageal pressure topography[J].Neurogastroenterol Motil,2012,24 Suppl 1:57-65.
12. Kessing BF,Bredenoord AJ,Smout AJ.Erroneous diagnosis of gastroesophageal reflux disease in achalasia[J].Clin Gastroenterol Hepatol,2011,9(12):1 020-1 024.
13. Vela MF.Management strategies for achalasia[J].Neurogastroenterol Motil,2014,26(9):1 215-1 221.
14. Vaezi MF,Pandolfino JE,Vela MF.ACG clinical guideline:diagnosis and management of achalasia[J].Am J Gastroenterol,2013,108(8):1 238-1 250.
15. Persson J,Johnsson E,Kostic S,et al.Treatment of achalasia with laparoscopic myotomy or pneumatic dilatation:long-term results of a prospective,randomized study[J].World J Surg,2015,39(3):713-720.
16. Fuchs KH,Schulz T,Varga G,et al.The potential and perspective of peroral endoscopic esophageal myotomy for achalasia[J].World J Surg,2015,39(7):1 598-1 602.
17. Ujiki MB,Yetasook AK,Zapf M,et al.Peroral endoscopic myotomy:Ashort-termcomparisonwiththestandardlaparoscopicapproach[J].Surgery,2013,154(4):893-900.
18. Von Renteln D,Fuchs KH,Fockens P,et al.Peroral endoscopic myotomy for the treatment of achalasia:an international prospective multicenter study[J].Gastroenterology,2013,145(2):309-311.
19. Tuason J,Inoue H.Current status of achalasia management:a review on diagnosis and treatment[J].J Gastroenterol,2017,52(4):401-406.
20. Patel K,Abbassi-Ghadi N,Markar S,et al.Peroral endoscopic myotomy for the treatment of esophageal achalasia:systematic review and pooled analysis[J].Dis Esophagus,2016,29(7):807-819.
21.Youn YH,Minami H,Chiu PW,et al.Peroral endoscopic myotomy for treating achalasia and esophageal motility disorders[J].JNeurogastroenterolMotil,2016,22(1):14-24.

