腺苷蛋氨酸對妊娠期肝內膽汁淤積癥產婦圍生期及妊娠結局的影響
馬 玲,李 花,穆蘭芳,馬永萍,陳玉芬,殷文俏
(青海省婦女兒童醫院婦產科,西寧 810000)
妊娠期肝內膽汁淤積癥為妊娠中、晚期產婦常見、高發、高復發婦科疾病。據我國流行病學資料顯示,妊娠期肝內膽汁淤積癥在我國妊娠期產婦中的發病率高達9.8%,且有逐年上升趨勢[1]。妊娠期肝內膽汁淤積癥產婦臨床癥狀明顯,如皮膚瘙癢難耐、黃疸高發等,而在臨床生化指標上主要表現為膽汁酸異常升高而導致的肝功能指標異常[2-3]。妊娠期肝內膽汁淤積癥不僅給產婦身心健康帶來影響,而且也是產婦不良妊娠結局的重要影響因素[4]。因此,控制膽汁酸水平,緩解瘙癢癥狀及改善妊娠結局是當前妊娠期肝內膽汁淤積癥臨床治療方案的最終目的。但由于妊娠期產婦具有眾多藥物禁忌,同時目前地塞米松、多烯磷脂酰膽堿等臨床常用藥物的療效欠佳[5],故本研究觀察腺苷蛋氨酸在妊娠期肝內膽汁淤積癥治療中的臨床療效及對產婦妊娠結局的影響,為臨床用藥提供參考。
1 資料與方法
1.1一般資料 收集2015年6月至2016年12月本院婦產科收治的126例妊娠期肝內膽汁淤積癥產婦的臨床資料。納入標準:(1)均根據中華醫學會婦產科學分會產科學組《妊娠期肝內膽汁游積癥診療指南(2015年版)》[6]診斷標準確診為妊娠期肝內膽汁淤積癥;(2)年齡小于35歲,孕周不少于27周;(3)受孕前無肝臟、膽道病史及妊娠期糖尿病、皮膚病、高血壓等疾病;(4)入組前均未進行相關藥物治療;(5)患者隨訪資料齊全,隨訪時間至少為產后3個月。排除標準:(1)排除多胎妊娠,子癇前期重度,以及中央性前置胎盤、疤痕子宮等嚴重并發癥;(2)排除肝臟、膽道病史及妊娠前期糖尿病、皮膚病、高血壓等。根據治療方式,將所有產婦分為常規治療組與腺苷蛋氨酸組。常規治療組58例,年齡23~34歲,平均(24.4±3.8)歲;孕周在28~37周,平均(30.4±3.9)周。腺苷蛋氨酸組68例,年齡22~33歲,平均(24.9±3.6)歲,孕周28~39周,平均(30.1±3.8)周。兩組產婦孕周、年齡等一般資料比較,差異無統計學意義(P>0.05)。本研究經本院倫理委員會審核批準,患者及家屬知情并簽訂知情同意書。
1.2方法
1.2.1治療方法 入院后囑所有孕婦注意休息,保證充值蛋白質和熱量攝入,為保證睡眠充足,必要時于睡前給予鎮靜劑地西泮(山西昂生藥業有限公司;國藥準字:H14021559;每片25 mg)1片。常規治療組給予熊去氧膽酸膠囊(德國Losan Pharma GmbH公司;批號:0H005202;每片150 mg),口服,每次300 mg,每天早中晚各1次,連續14 d。腺苷蛋氨酸組在常規治療組基礎上加用腺苷蛋氨酸(意大利雅培制藥;進口藥品證號:H20040384;每支50 mg),肌內注射,1支/次,每天1次,連續14 d。
1.2.2觀察指標 (1)生化指標檢測。兩組產婦治療前后均抽血2 mL,采用全自動生化分析儀(北京宏潤達)檢測丙氨酸氨基轉移酶(ALT)、天門冬氨酸氨基轉移酶(AST)、膽紅素(TB)、總膽汁酸(TBA)、肝膽酸(DB)等生化指標,并記錄膽酸(CA)、鵝脫氧膽酸(CDCA)、脫氧膽酸(DCA)、石膽酸(LCA)、熊去氧膽酸(UDCA)等血清膽汁酸譜情況,以分析兩組產婦肝功能改善情況。(2)瘙癢程度評價[7]。兩組產婦治療后均進行瘙癢程度評價,評價標準:重度瘙癢,白晝持續性瘙癢;間斷性瘙癢,但間隔時間較短(平均5次/天以上)判為中度瘙癢;輕度瘙癢:陣發性瘙癢但間隔時間較長(平均不大于5次/天);無瘙癢。(3)妊娠結局指標。產婦出院后3個月以電話方式隨訪,隨訪信息包括妊娠期早產率、剖宮產率、胎兒窘迫率、胎膜早破率、羊水過多率、產后出血率、泌尿系感染率、新生兒不良癥率等指標,統計由專職護士完成。

表1 兩組治療前后血清膽汁酸譜指標比較±s)
*:P<0.05,與同組治療前比較

表2 兩組治療前后肝功能生化指標比較±s)
注:**P<0.05,與同組治療前比較
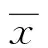
2 結 果
2.1兩組治療前后血清膽汁酸譜比較 兩組妊娠期產婦治療后LCA、UDCA、CDCA、CA、DCA等血清膽汁酸譜指標與治療前比較均明顯降低,且治療后腺苷蛋氨酸組上述各指標水平明顯低于常規治療組,差異均有統計學意義(P<0.05),見表1。
2.2兩組治療前后肝功能生化指標比較 兩組妊娠期產婦治療后ALT、AST、TB、TBA、DB等肝功能生化指標與治療前比較均明顯降低,且治療后腺苷蛋氨酸組上述各項指標水平明顯低于常規治療組,差異均有統計學意義(P<0.05),見表2。
2.3兩組治療后瘙癢程度比較 治療后腺苷蛋氨酸組產婦瘙癢程度較常規治療組改善,差異有統計學意義(χ2=25.998,P<0.05),見表3。
2.4兩組妊娠結局指標比較 腺苷蛋氨酸組產婦的妊娠期早產、剖宮產、胎兒窘迫、胎盤前置、胎膜早破、羊水過多、產后出血、泌尿系感染、妊娠期高血壓、新生兒不良癥的發生率均明顯低于常規治療組,差異均有統計學意義(P<0.05),見表4。
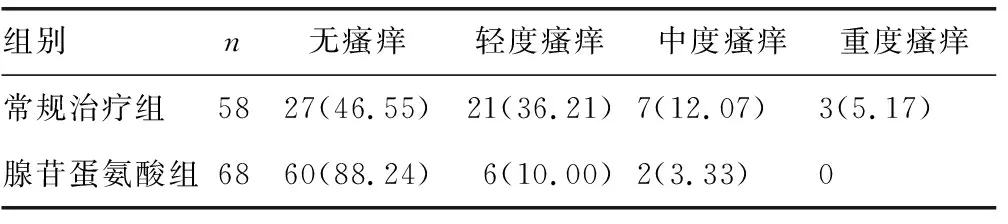
表3 兩組治療后瘙癢程度比較[n(%)]
3 討 論
妊娠期肝內膽汁淤積癥作為妊娠中、晚期產婦高發疾病,會給孕產婦及宮中胎兒發育帶來不良影響,從而威脅產婦身體健康及誘導不良妊娠結局[8]。當前妊娠期肝內膽汁淤積癥的病因研究已經基本明確,即產婦體內雌激素分泌上升,導致肝內膽汁酸代謝功能異常,使肝內膽汁的流動受阻或回流,其中膽汁酸水平異常升高是導致宮中胎兒發育不良的主要原因[9-10]。雖然當前妊娠期肝內膽汁淤積癥臨床治療藥物較多,如地塞米松、多烯磷脂酰膽堿、熊去氧膽酸等,但研究證實這些藥物的臨床療效欠佳,治療有效率在70%左右。鑒于腺苷蛋氨酸具有護肝、退黃及改善孕產婦宮內環境的功效[11]。故本研究特觀察腺苷蛋氨酸在妊娠期肝內膽汁淤積癥治療中的臨床療效及對產婦妊娠結局的影響,以期為臨床用藥提供參考。
腺苷蛋氨酸是一種蛋氨酸與三磷酸腺苷合成的化學藥劑,可與肝膽細胞膜磷脂產生甲基化反應,從而利于肝膽內恢復細胞膜的流動,從而利于肝膽汁排泄[12]。研究表明,腺苷蛋氨酸與人體肝內源性膽汁酸具有競爭性作用,當腺苷蛋氨酸達到10 mmol/L時,可以起到保護肝細胞,抑制膽汁分泌的作用[13]。瘙癢是妊娠期肝內膽汁淤積癥產婦的主要臨床表現,因此緩解瘙癢是臨床治療用藥的目標。本研究結果顯示,腺苷蛋氨酸組治療后無瘙癢率(88.24%)明顯高于常規治療組(46.55%),輕度瘙癢率(10.00%vs.36.21%)、中度瘙癢率(3.33%vs.12.07%)、重度瘙癢率(0vs.5.17%)均明顯低于常規治療組,兩組瘙癢程度比較差異有統計學意義(χ2=25.998,P<0.05),可見腺苷蛋氨酸可顯著改善妊娠期肝內膽汁淤積癥產婦瘙癢癥狀,從而提升產婦妊娠期舒適度和生活質量。妊娠期肝內膽汁淤積癥產婦肝膽內膽汁酸的異常升高,是引起產婦肝功能ALT、AST、TB、TBA、DB等指標異常及LCA、UDCA、CDCA、CA、DCA等血清膽汁酸譜指標異常的主要原因,因此有效控制肝功能生化指標是妊娠期肝內膽汁淤積癥臨床治療的又一用藥方向[14-15]。本研究結果證實,腺苷蛋氨酸組產婦治療后的肝功能指標(ALT、AST、TB、TBA、DB)異常及血清膽汁酸譜指標(LCA、UDCA、CDCA、CA、DCA)水平均低于常規治療組(P<0.05),可見腺苷蛋氨酸的應用可有效改善產婦肝功能及血清膽汁酸譜指標,從而使產婦肝內膽汁淤積癥得到緩解。妊娠期肝內膽汁淤積癥給妊娠結局帶來的負面影響已經被臨床研究證實,故早期針對性解除產婦的膽汁淤積,可以有效改善妊娠期肝內膽汁淤積癥產婦妊娠結局[16-17]。本研究結果顯示,應用腺苷蛋氨酸治療的產婦其妊期早產、剖宮產、胎兒窘迫、胎膜早破、羊水過多、產后出血、泌尿感染及新生兒不良癥的發生率均明顯低于常規治療組(P<0.05),可見腺苷蛋氨酸的應用可有效改善產婦不良妊娠結局。
綜上所述,腺苷蛋氨酸在妊娠期肝內膽汁淤積癥產婦治療中的療效確切,在緩解產婦瘙癢癥狀,改善肝功能,改善妊娠結局等方面具有顯著的作用,但本研究樣本量較小,期待今后有更多的深入研究。
[1]古航,胡電.妊娠期肝內膽汁淤積癥[J].中華婦產科雜志,2003,38(2):121-124.
[2]GABZDVL E M,SCHLAGER J M.Intrahepatic cholestasis of pregnancy:a critical clinical review[J].J Perinat Neonatal Nurs,2015,29(1):41-50.
[3]ERLINGER S.Ursodeoxycholic acid in intrahepatic cholestasis of pregnancy:good,but can do better[J].Clin Res Hepatol Gastroenterol,2013,37(2):117-118.
[4]丁依玲,付霞霏.妊娠肝內膽汁淤積癥胎兒總膽汁酸濃度與腎上腺皮質功能變化的關系[J].中華圍產醫學雜志,2005,8(3):168-170.
[5]王曉東,彭冰,姚強,等.妊娠肝內膽汁淤積癥1210例圍生結局分析[J].中華醫學雜志,2006,86(7):446-449.
[6]中華醫學會婦產科學分會產科學組.妊娠期肝內膽汁游積癥診療指南(2015)[J].中華婦產科雜志,2015,50(7):481-485.
[7]DOLINSKY B M,ZELIG C M,PAONESSA D J,et al.Effect of taurocholic acid on fetoplacental arterial pressures in a dual perfusion placental cotyledon model:a novel approach to intrahepatic cholestasis of pregnancy[J].J Reprod Med,2014,59(7/8): 367-370.
[8]OZKAN S,CEVLAN Y,OZKAN O V,et al.Review of a challenging clinical issue:intrahepaticcholestasis of pregnancy[J].World J Gastroenterol,2015,21(23):7134-7141.
[9]JOSHI D,JAMES A,QUAGLIA A,et al.Liver disease in pregnancy[J].Lancet,2010,375(9714):594-605.
[10]HALIBASIC E,CLAUDEL T,TRAUNER M.Bile acid transporters and regulatory nuclear receptors in the liver and beyond[J].J Hepatol,2013,58(1):155-168.
[11]JOUTSINIEMI T,TIMONEN S,LEINO R,et al.Ursodeoxycholic acid in the treatment of intrahepatic cholestasis of pregnancy:a randomized controlled trial[J].Arch Gynecol Obstet,2014,289(3):541-547.
[12]張莉,李曉麗,蘭遠霞.妊娠期肝內膽汁淤積癥孕婦血液流變學、凝血功能和細胞因子的變化及臨床意義[J].海南醫學院學報,2015,21(8):1088-1090.
[13]王玥,趙曉杰.妊娠期肝內膽汁淤積癥及其不良結局的發病機制研究進展[J].現代婦產科進展,2015,24(2):155-157.
[14]LULEV L,SCHUMACHER A,MULLA M J,et al.Low molecular weight heparin modulates maternal immune response in pregnant women and mice with thrombophilia[J].American J Reprod Immunol,2015,73(5):417-427.
[15]LARSON S P,KOVILAM O,AGRAWAL D K.Immunological basis in the pathogenesis of intrahepatic cholestasis of pregnancy[J].Expert Rev Clin Immunol,2016,12(1):39-48.
[16]BROUWERS L,KOSTER M P,PAGE-CHRISTIAENS G C,et al.Intrahepatic cholestasis of pregnancy:maternal and fetal outcomes associated with elevated bile acid levels[J].Am J Obstet Gynecol,2015,212(1):1-7.
[17]KRETSCHY D,GROEGER M,ZINKL D A,et al.High-throughput flow injection analysis of labeled peptides in cellular samples-ICP-MS analysis versus fluorescence based detection[J].Int J Mass Spectrom,2011,307(1/3): 105-111.

