雷公藤紅素腹腔注射對大鼠卵巢癌移植瘤的抑瘤作用及其機制
王詩堯,孫晶
(1廣州中醫藥大學第二臨床醫學院,廣州 510000;2深圳市婦幼保健院)
近年來卵巢癌的發病率和病死率仍不斷增加,尤其有遠處轉移的患者,預后較差,5年生存率不足30%。研究表明雷公藤紅素可抑制多種類型腫瘤生長并誘導其凋亡,有良好的抗腫瘤的作用[1,2],但有關雷公藤紅素治療卵巢癌移植瘤的研究較少,且具體機制尚不明確[3]。本研究觀察了雷公藤紅素對大鼠卵巢癌移植瘤的抑瘤作用,并探討PI3K/mTOR信號通路和PTEN 蛋白在其中發揮的作用。現報告如下。
1 材料與方法
1.1 動物、細胞及主要藥物、儀器 60只SPF級F344大鼠由廣東省職業衛生檢測中心提供,動物許可證號: SYXK(粵)2014-0048,周齡4~6周,雌性,體質量160~180 g。人卵巢癌HO-8910 細胞由上海鈺博生物科技有限公司提供,用含有10%胎牛血清、100 U/mL青霉素、100 U/mL鏈霉素的Hyclone培養液,在37 ℃、5%CO2培養箱中培養,間隔2~3 天需用胰酶消化傳代1 次,傳代3次后用于造模。
1.2 大鼠分組、卵巢癌移植瘤模型的建立及雷公藤紅素應用 將60只F344大鼠隨機分為A、B、C組,各20只。各組大鼠飼養1周適應環境后,消毒右腋下皮膚,皮下接種人卵巢癌HO-8910 細胞溶液0.2 mL(細胞濃度2×107/mL),密切觀察,移植瘤肉眼可見即為造模成功[4]。3組大鼠均造模成功。造模成功后固定大鼠,碘伏消毒大鼠反麥氏點皮膚、回抽無血無氣泡,C組予雷公藤紅素40 mg / (kg·d)腹腔注射、B組予順鉑注射液40 mg /(kg·d)腹腔注射,A組予同等體積生理鹽水腹腔注射。各組均給藥30 d。
1.3 各組大鼠移植瘤體積測算 給藥前、給藥后30 d每組各處死10只大鼠,測移植瘤長徑、短徑,腫瘤體積=(長徑×短徑2)/2。
1.4 各組大鼠卵巢癌移植瘤組織PI3K、p-mTOR、PTEN檢測 采用Western blotting法。取給藥30 d各組大鼠移植瘤,加入1 mg/mL的RIPA裂解液1 mL,勻漿機3 000 r/min勻漿15 min, 低溫離心機 12 000 r/min 離心10 min后取上清,-20 ℃保存待用。BCA法測定蛋白濃度。8%十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離蛋白質,將蛋白轉移至硝酸纖維素膜,TBST洗3 次,每次10 min,5%牛奶封閉2 h后,TBST 再洗3 次,每次10 min。加入PI3K抗體(工作濃度1∶1 000)、 p-mTOR抗體(工作濃度1∶1 000)、 PTEN抗體(工作濃度1∶1 000)、β-actin抗體(工作濃度1∶2 000)4 ℃過夜,TBST 再洗3 次。加入堿性磷酸酶標記山羊抗兔抗體(工作濃度1∶2 000),室溫2 h , TBST 再洗3 次,顯色。采用Flo urChem V2 .0 凝膠成像分析軟件記錄每條電泳條帶的灰度值。 以目的蛋白條帶與內參照β-actin條帶灰度值之比表示目的蛋白相對表達量。
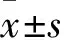
2 結果
2.1 給藥前和給藥后30 d各組大鼠卵巢癌移植瘤體積比較 給藥前和給藥后30 d各組大鼠卵巢癌移植瘤體積見表1。與給藥前相比,給藥后30 d各組大鼠卵巢癌移植瘤體積均大于給藥前(P均<0.05);給藥后30 d,C組腫瘤體積小于A、B組(P均<0.05),B組腫瘤體積小于A組(P<0.05)。
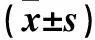
表1 給藥前和給藥后30 d各組大鼠卵巢癌移植瘤體積比較
注:與給藥前相比,*P<0.05;與A組相比,#P<0.05;與B組相比,ΔP<0.05。
2.2 各組大鼠卵巢癌移植瘤組織PI3K、p-mTOR、PTEN表達比較 各組大鼠卵巢癌移植瘤組織PI3K、p-mTOR、PTEN相對表達量見表2。卵巢癌移植瘤組織PI3K、p-mTOR、PTEN相對表達量C組高于B組(P均<0.05),B組高于A組(P均<0.05)。
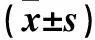
表2 各組大鼠卵巢癌移植瘤組織PI3K、p-mTOR、PTEN相對表達量比較
注:與A組相比,#P<0.05;與B組相比,ΔP<0.05。
3 討論
近年來隨著生活環境的不斷惡化和人們生活壓力的增加,各種癌癥的發病率不斷攀升,卵巢癌的發病率、病死率也在全國范圍內急劇增長[4]。盡管近幾十年來隨著醫療水平的發展癌癥死亡人數有所下降,但卵巢癌仍然是世界范圍內與癌癥相關死亡的最主要原因之一。雷公藤紅素是第一個從雷公藤藤本植物中提取的主要活性物質,是一種五環三萜類化合物[5,6]。研究表明雷公藤紅素可抑制多種類型腫瘤生長并誘導其凋亡,有良好的抗腫瘤作用[7,8]。雷公藤紅素除具有良好的抗炎功能外,還可以抑制C6 膠質瘤、黑色素瘤抗炎、人慢性髓系白血病等多種癌癥惡性增殖[9~11]。但是目前雷公藤紅素對卵巢癌轉移瘤抑制情況的相關報道較少,且具體機制尚不明確。因此研究雷公藤紅素對卵巢癌轉移瘤的抑制作用及分子機制具有重要臨床意義。本研究結果顯示,給藥后30 d各組大鼠卵巢癌轉移瘤體積均大于給藥前,C組大鼠卵巢癌轉移瘤體積小于A、B組,B組大鼠卵巢癌轉移瘤體積小于A組。說明雷公藤紅素腹腔注射可抑制F344大鼠卵巢癌轉移瘤生長,且效果優于傳統化療藥物順鉑。
PI3K/mTOR信號通路是在腫瘤形成中起關鍵作用的細胞內信號通路,PI3K/mTOR信號通路相關蛋白PI3K、p-mTOR是調節腫瘤細胞增殖、代謝、細胞周期進程、凋亡的核心蛋白[12~15]。PTEN基因是一種經典的抑癌基因,該基因編碼的蛋白具有特異性磷酸酶活性,可調控細胞核生長周期來抑制腫瘤生長、轉移[16~18]。本研究結果顯示,給藥30 d后B、C組大鼠卵巢癌轉移瘤組織PI3K、p-mTOR、PTEN相對表達量與A組相比增加,且C組大于B組。因此我們推測雷公藤紅素可能通過激活PI3K/mTOR信號通路,增加瘤體內PTEN表達增加來抑制大鼠卵巢癌轉移瘤。但是若要進一步驗證這一推測,我們仍需要進行進一步研究。
本研究的不足之處在于僅初步探討了雷公藤紅素對大鼠卵巢癌轉移瘤的抑制作用及可能涉及分子機制,但是沒有考慮雷公藤紅素劑量濃度對于卵巢癌影響,下一步我們將研究高、中、低劑量雷公藤紅素對卵巢癌抑制作用的影響。
參考文獻:
[1] Couttenier A, Lacroix O, Vaes E, et al. BMC Complement AlStatin use is associated with improved survival in ovarian cancer: A retrospective population-based study[J]. PLoS One, 2017, 12(12):189233.
[2] Shen W, Chen X, Luan J, et al. Sustained Codelivery of Cisplatin and Paclitaxel via an Injectable Prodrug Hydrogel for Ovarian Cancer Treatment[J]. ACS Appl Mater Interfaces, 2017,9(46):40031-40046.
[3] 張志強, 高體云, 李暐,等.雷公藤紅素通過活性氧誘導結腸癌sw620細胞凋亡[J]. 中國醫院藥學雜志, 35(17):1558-1563.
[4] Peres LC, Risch H, Terry KL,et al. Racial/ethnic differences in the epidemiology of ovarian cancer: a pooled analysis of 12 case-control studies[J]. Int J Epidemiol, 2017 ,11(2):1093.
[5] Hacker NF. Neoadjuvant chemotherapy for advanced epithelial ovarian cancer. Who really benefits[J]. Aust N Z J Obstet Gynaecol, 2017,57(6):585-587.
[6] Yin J, Wang P, Yin Y, et al, 2017,Optimization on biodistribution and antitumor activity of tripterine using polymeric nanoparticles through RES saturation[J].Drug Deliv, 2017,24(1):1891-1897.
[7] Li W, Zhang T, Ye Y, et al. Enhanced bioavailability of tripterine through lipid nanoparticles using broccoli-derived lipids as a carrier material[J]. Inter J Pharmaceutics, 2015,495(2):948-955.
[8] Lu C, Yu X, Zuo K, et al. Tripterine treatment improves endothelial progenitor cell function via integrin-linked kinase[J]. Cell?Physiol Biochem, 2015,37(3):1089-1103.
[9] 張朝弘,劉丹彥.雷公藤紅素后處理對大鼠局灶性腦缺血再灌注損傷后腦組織nf-κb及tnf-α、il-1β的影響[J].重慶醫科大學學報,2015,23(1):37-41.
[10] 張曉玲, 李愛萍, 環飛,等.雷公藤紅素對白血病hl-60和jurkat細胞增殖及凋亡的影響[J]. 中國藥科大學學報, 2015,46(1):89-93.
[11] 許陽賢, 宋海燕,季光.雷公藤紅素對肝癌細胞smmc-7721凋亡和周期的調控作用及機制[J]. 中成藥,2015,37(6):1153-1157.
[12] 徐佳,伍春蓮.雷公藤紅素抑制食管癌細胞轉移及其機制[J].生理學報,2015,67(3): 341-347.
[13] Su Y, Li X, Ma J, et al. Targeting PI3K, mTOR, ERK, and Bcl-2 signaling network shows superior antileukemic activity against AML ex vivo[J]. Biochem Pharmacol, 2017,10(2):30703-30707.
[14] Wainberg ZA, Alsina M, Soares HP, et al. A Multi-Arm Phase I Study of the PI3K/mTOR Inhibitors PF-04691502 and Gedatolisib (PF-05212384) plus Irinotecan or the MEK Inhibitor PD-0325901 in Advanced Cancer[J]. Target Oncol, 2017,12(6):775-785.
[15] Yim CY, Bikorimana E, Khan E, et al. G0S2 represses PI3K/mTOR signaling and increases sensitivity to PI3K/mTOR pathway inhibitors in breast cancer[J]. Cell Cycle, 2017,8(14):1-10.
[16] Reeves PM, Abbaslou MA, Kools FRW, et al. Ruxolitinib sensitizes ovarian cancer to reduced dose Taxol, limits tumor growth and improves survival in immune competent micep[J]. Oncotarget, 2017,8(55):94040-94053.
[17] Brana I, Pham NA, Kim L, et al. Novel combinations of PI3K-mTOR inhibitors with dacomitinib or chemotherapy in PTEN-deficient patient-derived tumor xenografts[J]. Oncotarget, 2017,8(49):84659-84670.
[18] Langer LR, Evans B, Saam J, et al. The genetic basis of ovarian cancer: Identifying hereditary ovarian cancer using a 25-gene panel[J]. Gynecol Oncol, 2015,137(4):8-18.

