高孕激素促排卵在長方案移植失敗患者行IVF/ICSI中的療效
張宜家,陳秋菊,匡延平
(1.上海交通大學醫學院附屬第九人民醫院 輔助生殖科,上海 200011;2.上海交通大學醫學院九院臨床醫學院,上海 200011)
降調節方案可有效預防早發黃體生成素(luteinizing hormone,LH)峰[1],其中長方案是卵巢正常反應人群的首選,臨床妊娠率可達50%[2]。但仍有患者使用長方案未能臨床妊娠,其能否通過改變促排卵方案來改善妊娠結局,目前尚缺少研究。長方案使用促性腺激素釋放激素激動劑(gonadotropin releasing hormone agonist,GnRH-a),長期占據垂體GnRH受體,抑制LH分泌[3],使血清LH濃度始終保持在低水平。因此對于長方案移植失敗患者,或許可以改用激素變化模式不同的促排卵方案。
高孕激素促排卵(progestin-primed ovarian stimulation,PPOS)使用孕激素預防早發LH峰[4],主要由下丘腦前腹側室旁核與弓狀核的孕激素受體介導,抑制下丘腦GnRH脈沖性分泌,進而抑制LH分泌[5]。促排卵過程中,血清LH濃度逐漸下降,后保持較低水平[1,6],與長方案有所不同。既往研究顯示,PPOS方案與長方案的臨床妊娠率沒有明顯差異,但這基于無特定長方案移植失敗史的患者[7]。臨床中有部分長方案移植失敗患者改用PPOS方案獲得臨床妊娠與活產,但PPOS方案對于這類患者的有效性仍待評估。本研究回顧性分析長方案移植失敗患者使用PPOS方案的臨床結局,探討PPOS方案能否作為這類患者的可選替代方案。
1 資料和方法
1.1 一般資料 回顧性分析2014年1月至2016年12月間,在外院生殖中心有≥2次長方案移植失敗史的患者,于上海交通大學醫學院附屬第九人民醫院使用PPOS方案接受體外受精/卵胞漿內單精子注射(in vitro fertilization/intracytoplasmic sperm injection,IVF/ICSI)治療的臨床結局。納入標準:①年齡<38歲;②BMI為18~30 kg/m2;③月經周期第3天基礎竇卵泡數(antral follicle count,AFC)≥5;④基礎血清卵泡刺激素(follicle-stimulating hormone,FSH)≤10 IU/L。排除標準:①卵巢儲備或功能下降;②多囊卵巢綜合征;③子宮內膜異位癥I I I級及以上;④先天性子宮發育異常;⑤近1個月內接受過激素治療。本研究經本院倫理委員會批準。
1.2 方法
1.2.1 PPOS方案:從月經周期第3天開始,患者口服安宮黃體酮(medroxyprogesterone acetate tablets,MPA,浙江仙琚制藥股份有限公司)4~10 mg/d,肌注尿促性素(human menopausal gonadotrophin,hMG,上海麗珠制藥有限公司)150~225 IU/d。從月經周期第9~第11天開始,經陰道超聲監測卵泡發育,并同時測定血清FSH、LH、雌二醇(estradiol,E2)、孕酮(progesterone,P)水平。根據卵泡發育和性激素水平調整藥物劑量。當有3個卵泡直徑≥18 mm或1個優勢卵泡直徑≥20 mm,給予短效GnRH-a(達必佳,德國輝凌制藥公司)0.1 mg和人絨毛膜促性腺素(human chorionic gonadotrophin,hCG,上海麗珠制藥有限公司)1000~5000 IU雙重誘發卵母細胞成熟。36~38 h后,經陰道超聲引導取卵。
1.2.2 樣本收集及激素測定:收集卵泡早期(月經第3~第5天)、卵泡中期(月經第9~第11天)、誘發排卵日、誘發排卵次日的血液樣本,使用化學發光微粒子免疫檢測法(chemiluminescence microparticle immunoassay,CMIA)測定血液中的性激素水平,包括FSH、LH、E2和P。
1.2.3 取卵、授精及胚胎質量的實驗室評估:采用雙腔取卵針,在陰道超聲引導下穿刺抽取所有直徑≥10 mm的卵泡。根據取卵日男方精液情況或既往的授精情況,將激活的卵母細胞行IVF或ICSI,胚胎培養按本中心常規進行。胚胎質量根據G1-5分級法[8]進行評估:1級:卵裂球大小均等,胞質透明均勻,無碎片;2級:卵裂球大小均等,有少量碎片(<20%);3級:卵裂球大小不均等,有少量碎片(<20%);4級:卵裂球大小不均等,碎片較多(20%~50%);5級:卵裂球不能識別,大量碎片(>50%)。所有優質胚胎(包括1級和2級)均玻璃化冷凍保存,非優質胚胎(3級及以上)繼續培養至囊胚形成后冷凍保存。
1.2.4 凍融胚胎移植(frozen-thawed embryo transfer,FET)的內膜準備方式、黃體支持方法及臨床妊娠監測:關于子宮內膜準備方案和FET具體方法參考文獻[4,9-10]中的說明。根據患者具體情況分別采用自然周期、促排卵周期或激素替代周期來進行內膜準備。自然周期適用于月經周期規律的女性。月經周期不規律的女性采用促排卵周期,使用來曲唑,或必要時加用hMG刺激單個優勢卵泡生長。子宮內膜過薄的患者則采用激素替代周期,從月經周期第3天起口服炔雌醇片(信可止,上海信怡制藥公司),當子宮內膜厚度>8 mm,改用口服雌二醇地屈孕酮片(芬嗎通,荷蘭蘇威制藥公司),同時陰道塞黃體酮軟膠囊(安琪坦,法國Capsugel公司)進行黃體支持。FET后28 d陰道超聲見妊娠囊及原始心管搏動確定為臨床妊娠。
1.2.5 評價指標:主要觀察指標為活產率。次要
指標包括:獲卵數、可用胚胎數、臨床妊娠率、胚胎種植率、繼續妊娠率。
1.3 統計學處理方法 采用SPSS24.0統計軟件進行分析。計量資料以±s表示,計數資料以率表示;正態分布的計量資料采用兩獨立樣本t檢驗、單因素方差分析;非正態分布的計量資料采用Mann-WhitneyU檢驗;計數資料采用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 患者基本特征 本研究共納入患者278例,其基本特征見表1。患者既往長方案移植失敗總次數為(2.7±0.9)次;既往長方案FET失敗次數為(1.7±1.1)次;既往長方案鮮胚移植(embryo transfer,ET)失敗次數為(1.0±0.8)次。
表1 患者基本特征( ±s)

表1 患者基本特征( ±s)
指標數值例數 278年齡(歲) 31.9±3.4 BMI(kg/m2) 21.6±2.7不孕年限 5.1±2.7原發不孕(%) 57.6(160/278)月經第3天基礎性激素水平FSH(IU/L) 5.7± 1.3 LH(IU/L) 3.5± 1.5 E2(pg/mL) 34.0±14.0 P(ng/mL) 0.3± 0.1 AFC 12.1± 4.7既往長方案移植總失敗次數(%)254.7(152/278)329.1( 81/278)≥4 16.2( 45/278)既往長方案移植FET失敗次數(%)012.2( 34/278)137.1(103/278)231.7( 88/278)312.9( 36/278)≥4 6.1( 17/278)既往長方案移植ET失敗次數(%)024.5( 68/278)151.7(144/278)221.2( 59/278)32.2( 6/278)≥4 0.4( 1/278)
2.2 長方案移植失敗患者在PPOS方案和既往長方案的促排卵結果 長方案移植失敗患者使用PPOS方案的獲卵數和可用胚胎數顯著少于既往長方案(P<0.05),卵子利用率也顯著少于既往長方案(P<0.01)。見表2。
表2 長方案移植失敗患者在PPOS方案和既往長方案的促排卵結果( ±s)
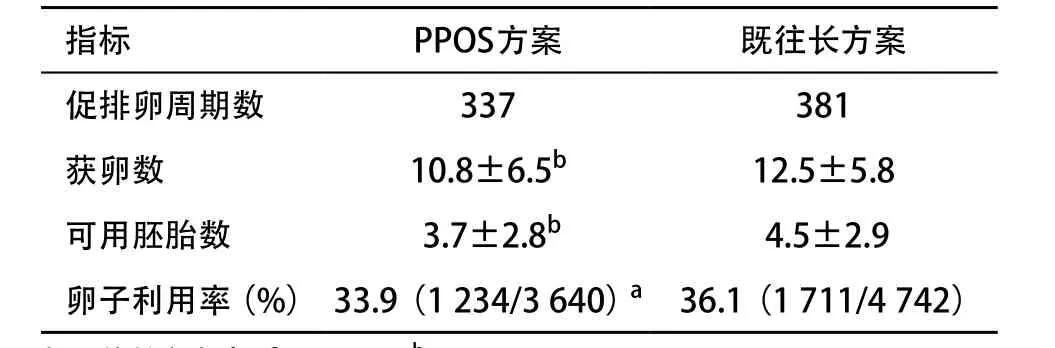
表2 長方案移植失敗患者在PPOS方案和既往長方案的促排卵結果( ±s)
與既往長方案比:aP<0.05,bP<0.01
指標 PPOS方案 既往長方案促排卵周期數 337 381獲卵數 10.8±6.5b 12.5±5.8可用胚胎數 3.7±2.8b 4.5±2.9卵子利用率(%) 33.9(1234/3640)a 36.1(1711/4742)
2.3 長方案移植失敗患者在PPOS方案和既往長方案的移植結局 278例長方案移植失敗患者,既往長方案促排卵獲得胚胎后,共進行FET 245周期,ET 209周期;改用PPOS方案促排卵后有251例獲得可用胚胎,其中208例進行FET共331周期。如表3所示,PPOS方案的每周期移植胚胎數顯著少于既往長方案(P<0.01)。長方案移植失敗的患者使用PPOS方案的FET周期,移植日內膜厚度為(10.8±2.1)mm,生化妊娠率、臨床妊娠率、胚胎種植率、繼續妊娠率和活產率分別為54.1%、49.2%、31.4%、42.6%和41.7%。
2.4 長方案不同移植方式的移植失敗患者在PPOS方案的移植結局 長方案移植失敗后改用PPOS方案獲得可用胚胎并進行FET的208例患者,根據患者既往長方案接受的移植方式不同,分為3組:第1組患者僅接受過FET,第2組患者僅接受過ET,第3組患者ET與FET均有接受過。3組患者在PPOS的FET中,每周期移植胚胎數和內膜厚度差異均無統計學意義(P>0.05)。3組各項妊娠結局指標差異無統計學意義(P>0.05)。既往長方案僅FET的患者,在PPOS方案中同樣接受FET后,生化妊娠率、臨床妊娠率、胚胎種植率、繼續妊娠率和活產率分別為50.7%、45.2%、30.2%、43.8%、41.1%。見表4。
3 討論
本研究結果顯示,長方案移植失敗≥2次的患者,在PPOS方案的FET周期中,臨床妊娠率、胚胎種植率、繼續妊娠率和活產率分別為49.2%、31.4%、42.6%和41.7%。在既往研究中,卵巢儲備功能正常的患者(無特定長方案移植失敗史)使用PPOS方案的臨床妊娠率在43.7%~52.8%,活產率在37.7%~42.6%[6]。本研究中,長方案移植失敗≥2次的患者再次行輔助生殖治療時,選擇PPOS方案促排卵是有效的,可以獲得良好的妊娠結局。
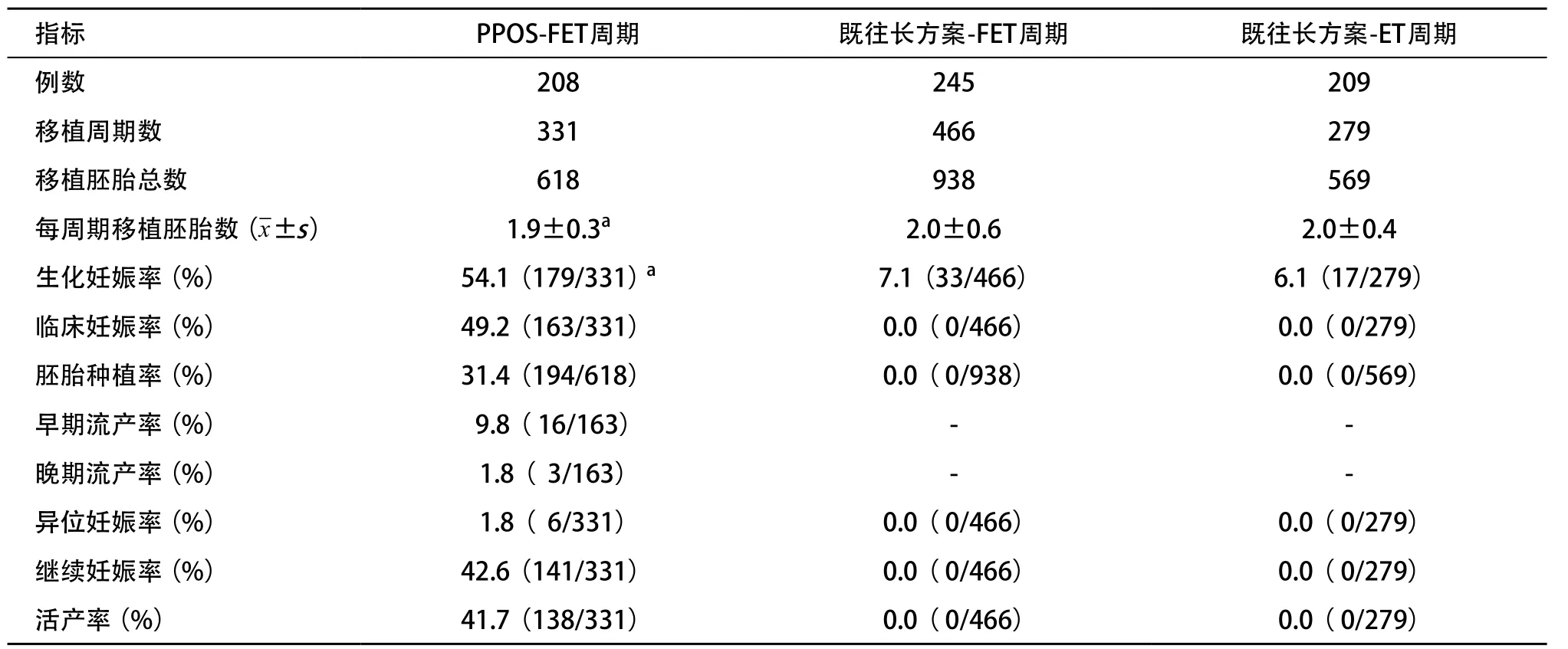
表3 長方案移植失敗患者在PPOS方案和既往長方案的移植結局
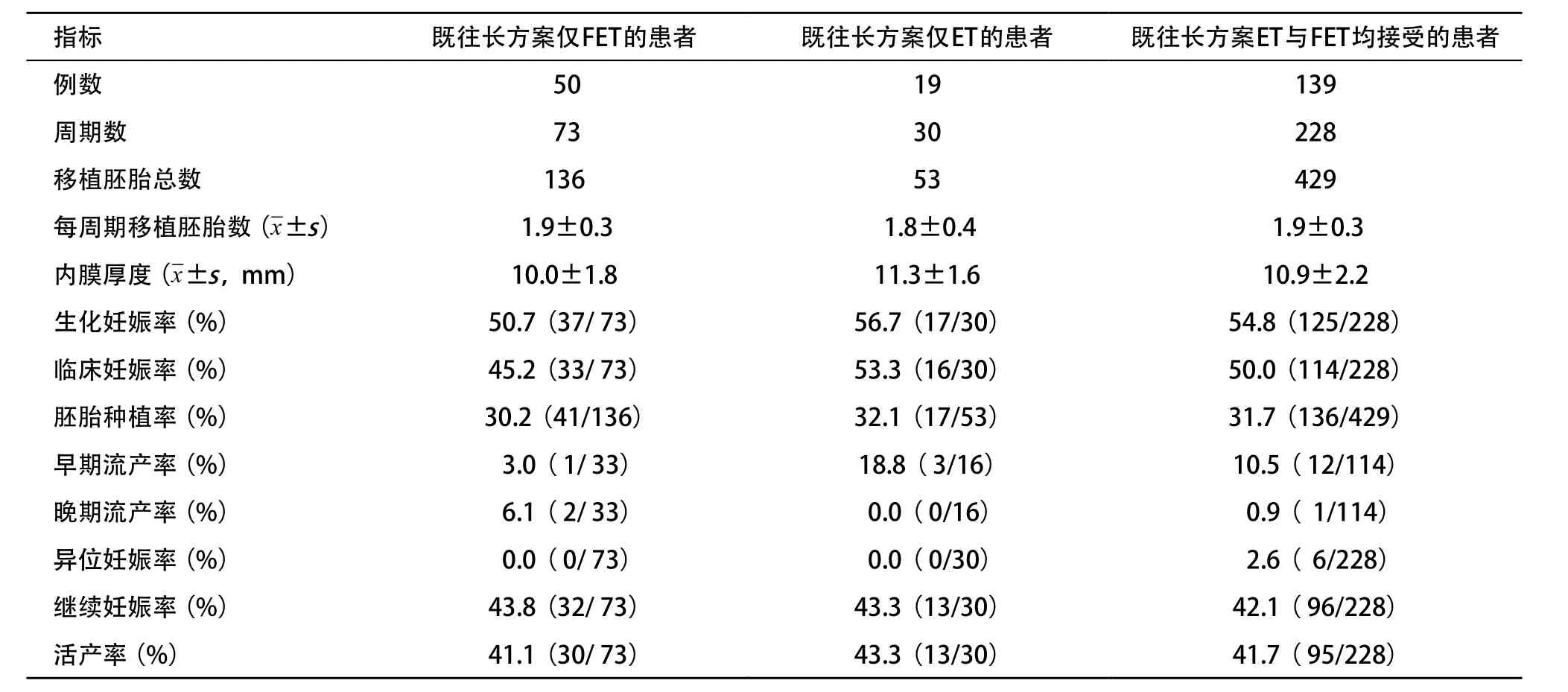
表4 既往長方案移植方式不同的失敗患者在PPOS方案的FET結局
在促排卵過程中,卵泡生長發育、內分泌、內膜均經歷動態的變化。在本研究中,長方案移植失敗患者使用PPOS方案促排卵的獲卵數和可用胚胎數均顯著少于既往長方案,說明PPOS方案并不是通過增加卵母細胞或胚胎的數量來改善這類患者的妊娠結局。張欣等[7]研究也顯示,PPOS方案的獲卵數少于長方案,但2種方案的臨床妊娠率差異無統計學意義。相對長方案較少的獲卵數和可用胚胎數可能是PPOS方案促排卵的特點,但不一定影響妊娠結局。其次,長方案移植失敗患者在PPOS方案的FET每周期移植胚胎數顯著少于既往長方案,因此,PPOS方案也并不是通過增加每周期移植的胚胎數量從而改善患者的妊娠結局。再者,當比較既往長方案不同移植方式失敗患者在PPOS方案的FET結局時,3組的妊娠結局各項指標差異均無統計學意義,且既往長方案僅接受過FET的患者,在PPOS方案中同樣接受FET后,能大幅改善妊娠結局,臨床妊娠率、胚胎種植率、繼續妊娠率和活產率分別為45.2%、30.2%、43.8%和41.1%。可見PPOS方案對長方案移植失敗患者妊娠結局的改善也并非在于移植方式改變或不同促排卵方案對內膜的影響。綜上,對于長方案移植失敗而改用PPOS方案后改善妊娠結局的患者,原因并不在于卵母細胞數量、胚胎數量、移植方式或內膜,而可能在于PPOS方案改善了這類特定患者的卵母細胞或胚胎的質量。
PPOS方案促排卵時,孕激素抑制LH峰的作用機制與長方案不同[3,5],從而血清LH水平的變化也與長方案有所不同。郭麗娜等[2]研究發現,長方案在扳機日的LH水平顯著低于PPOS方案(P<0.05)。另有回顧性隊列研究顯示,PPOS的促性腺激素(gonadotropin,Gn)用藥天數和Gn總用量均顯著少于長方案(P<0.05),可能在于GnRH-a對垂體有深度抑制作用,而PPOS既能有效抑制早發性LH峰的出現,也不過度抑制LH分泌[7]。許多研究表明垂體過度抑制會導致卵巢對Gn的敏感性下降而反應低下,卵泡發育不均,卵母細胞質量下降,妊娠率降低[11]。適量LH有利于卵泡的發育成熟:一是直接作用于卵泡膜細胞,使其產生雄激素,后者在卵泡發育過程中起重要作用;二是在卵泡生長中期誘導卵巢旁分泌,局部產生各種因子促進卵泡膜細胞的生長[12]。卵泡的發育成熟和類固醇激素的合成需要適量的LH,如果LH水平低于閾值,則無雌激素和雄激素合成,卵母細胞不能完全成熟[13]。還有研究表明,在長效長方案量效分析時,胚胎種植率有隨LH升高而上升的趨勢,機制可能是在避免早發LH峰的前提下,不過深抑制垂體,相對更高的LH有利于保持卵巢反應性[14]。或許對于長方案移植失敗而使用PPOS方案改善妊娠結局的這類特定患者,PPOS方案相比長方案更高但不引起早發LH峰的LH水平,可能改善卵母細胞的質量,但有待更多研究。
長方案基于垂體降調,選用hCG誘導卵母細胞成熟;而PPOS方案阻斷LH峰的機制并非垂體脫敏,故常可使用GnRH-a聯合hCG共同誘導,在外源性補充hCG的同時,誘發垂體釋放內源性LH。有研究表明GnRH-a與hCG聯用在誘導卵母細胞最終成熟方面具有優勢,這種治療被稱為“雙重觸發”[15]。回顧性研究顯示,無論是卵巢反應正常還是反應低下的患者,使用雙重觸發獲得的成熟卵數、受精卵數都更多,也顯著提高胚胎質量[15]。另外,雙重觸發還會誘發內源性FSH分泌,從而比單純使用hCG更貼近生理性作用[16-17]。內源性LH和FSH釋放,能夠促進卵泡的最終成熟,使卵母細胞和胚胎獲得正常的發育潛能,提高妊娠結局[18-20]。這一作用也可能有利于長方案移植失敗的特定患者改善卵母細胞和胚胎質量,但需要進一步研究。
綜上所述,長方案移植失敗≥2次的患者使用
PPOS方案可以獲得良好的妊娠結局,可能原因在于
提高卵母細胞和胚胎的質量。PPOS方案可以作為長
方案移植失敗患者的有效替代促排卵方案。然而本
研究為回顧性自身前后對照研究,需進行前瞻性隨
機對照試驗進一步深入研究。
[1] YU S, LONG H, CHANG H Y, et al. New application of dydrogesterone as a part of a progestin-primed ovarian stimulation protocol for IVF: a randomized controlled trial including 516 fi rst IVF/ICSI cycles[J]. Hum Reprod, 2018, 33(2):229-237.
[2] 郭麗娜, 賈新轉, 呂翠婷, 等. 高孕激素狀態下促排卵方案用于卵巢正常反應患者I V F-E T的自身對照研究[J]. 生殖醫學雜志, 2017, 26(2): 127-132.
[3] VAN LOENEN A C, HUIRNE J A, SCHATS R, et al. GnRH agonists, antagonists, and assisted conception[J]. Semin Reprod Med, 2002, 20(4): 349-364.
[4] KUANG Y P, CHEN Q J, FU Y L, et al. Medroxyprogesterone acetate is an effective oral alternative for preventing premature luteinizing hormone surges in women undergoing controlled ovarian hyperstimulation for in vitro fertilization[J]. Fertil Steril, 2015, 104(1): 62-70.
[5] HE W, LI X, ADEKUNBI D, et al. Hypothalamic effects of progesterone on regulation of the pulsatile and surge release of luteinising hormone in female rats[J]. Sci Rep, 2017, 7(1): 80-96.
[6] 葉靜, 陳秋菊, 匡延平. 卵巢功能正常患者高孕激素狀態下促排卵的內分泌特征及I V F/I C S I臨床結局的研究[J]. 生殖與避孕, 2015, 35(6): 393-400.
[7] 張欣, 張玉, 王雪瑩, 等. 高孕激素狀態促排卵與長方案用于不同年齡組供精體外受精的結局[J]. 生殖醫學雜志,2017, 26(5): 452-456.
[8] CUMMINS J M, BREEN T M, HARRISON K L, et al. A formula for scoring human embryo growth rates in in vitro fertilization: its value in predicting pregnancy and in comparison with visual estimates of embryo quality[J]. J In Vitro Fert Embryo Transf, 1986, 3(5): 284-295.
[9] KUANG Y P, HONG Q Q, CHEN Q J, et al. Luteal-phase ovarian stimulation is feasible for producing competent oocytes in women undergoing in vitro fertilization/intracytoplasmic sperm injection treatment, with optimal pregnancy outcomes in frozen-thawed embryo transfer cycles[J]. Fertil Steril, 2014, 101(1): 105-111.
[10] QIN N X, CHEN Q J, HONG Q Q, et al. Flexibility in starting ovarian stimulation at different phases of the menstrual cycle for treatment of infertile women with the use of in vitro fertilization or intracytoplasmic sperm injection[J]. Fertil Steril, 2016, 106(2): 334-341.
[11] 朱潔茹, 歐建平. 垂體降調節方案的不足及適用性探討[J].生殖醫學雜志, 2016, 25(10): 893-896.
[12] DRAKAKIS P, LOUTRADIS D, KALLIANIDIS K, et al.Small doses of LH activity are needed early in ovarian stimulation for better quality oocytes in IVF-ET[J]. Eur J Obstet Gynecol Reprod Biol, 2005, 121(1): 77-80.
[13] 宋娟, 龔斐, 羅克利, 等. G n R H激動劑長效劑型和短效劑型在長方案中的應用比較[J]. 生殖與避孕, 2015, 35(6):389-392, 424.
[14] 羅穎怡, 鄧明芬, 胡曉坤, 等. 不同降調節長方案G n R H-a劑量與L H水平的關系及臨床結局的比較[J]. 中山大學學報(醫學科學版), 2017, 38(2): 278-284.
[15] OLIVEIRA S A, CALSAVARA V F, CORTES G C. Final oocyte maturation in assisted reproduction with human chorionic gonadotropin and gonadotropin-releasing hormone agonist (dual trigger)[J]. JBRA Assist Reprod, 2016, 20(4):246-250.
[16] GRIFFIN D, FEINN R, EENMANN L, et al. Dual trigger with gonadotropin-releasing hormone agonist and standard dose human chorionic gonadotropin to improve oocyte maturity rates[J]. Fertil Steril, 2014, 102(2): 405-409.
[17] DECLEER W, OSMANAGAOGLU K, SEYNHAVE B,et al. Comparison of hCG triggering versus hCG in combination with a GnRH agonist: a prospective randomized controlled trial[J]. Facts Views Vis Obgyn, 2014, 6(4): 203-209.
[18] ALYASIN A, MEHDINEJADIANI S, GHASEMI M. GnRH agonist trigger versus hCG trigger in GnRH antagonist in IVF/ICSI cycles: A review article[J]. Int J Reprod Biomed(Yazd), 2016, 14(9): 557-566.
[19] HUMAIDAN P, POLYZOS N P, ALSBJERG B, et al. Gn-RHa trigger and individualized luteal phase hCG support according to ovarian response to stimulation: two prospective randomized controlled multi-centre studies in IVF patients[J]. Hum Reprod, 2013, 28(9): 2511-2521.
[20] HUMAIDAN P, EJDRUP BREDKJAER H, WESTERGAARD L G, et al. 1,500 IU human chorionic gonadotropin administered at oocyte retrieval rescues the luteal phase when gonadotropin-releasing hormone agonist is used for ovulation induction: a prospective, randomized, controlled study[J]. Fertil Steril, 2010, 93(3): 847-854.

