丹參酮IIA對(duì)慢性腎功能衰竭大鼠認(rèn)知障礙的神經(jīng)保護(hù)作用及其機(jī)制
朱鳴,王小同,閔晶晶,陳琪,王霄一
(1.湖州市第一人民醫(yī)院 腎內(nèi)科,浙江 湖州 313000;2.溫州醫(yī)科大學(xué)附屬第二醫(yī)院 康復(fù)科,浙江溫州 325027;3.湖州市第一人民醫(yī)院 神經(jīng)內(nèi)科,浙江 湖州 313000)
慢性腎功能衰竭(chronic renal failure,CRF)是指各種原發(fā)性腎臟疾病或繼發(fā)于其他相關(guān)疾病引起的腎功能受損及惡化,是全球老年患者最普遍的公共健康問(wèn)題之一。近年來(lái)我國(guó)的一項(xiàng)大型研究顯示慢性腎臟疾病(chronic kidney disease,CKD)的患病率為10.8%,這意味著我國(guó)大約有1.2億患者[1],這些患者可能最終都會(huì)進(jìn)入CRF階段。越來(lái)越多的研究開(kāi)始關(guān)注到CRF患者的認(rèn)知障礙問(wèn)題,通常表現(xiàn)為注意力不集中、暫時(shí)性和延遲性記憶障礙、定向障礙、執(zhí)行功能下降和思維遲緩、失眠、冷漠、煩躁易怒等癥狀,甚者可出現(xiàn)幻聽(tīng)、幻視、偏執(zhí)和妄想等精神障礙,并且會(huì)隨腎功能水平下降而惡化,嚴(yán)重影響了患者對(duì)治療計(jì)劃的依從性以及生活質(zhì)量。約1/3的CKD患者和終末期腎病患者都存在不同程度的認(rèn)知功能障礙[2]。透析治療雖然是治療終末期腎臟病并從體內(nèi)去除累積毒素的首選方法,但仍無(wú)法阻止CRF患者認(rèn)知障礙的發(fā)生與進(jìn)展,有研究表明在接受透析的CRF患者中約70%存在中度或重度認(rèn)知障礙[3]。
內(nèi)質(zhì)網(wǎng)是細(xì)胞內(nèi)專(zhuān)門(mén)從事蛋白質(zhì)合成、折疊、裝配和修飾的細(xì)胞器。當(dāng)內(nèi)質(zhì)網(wǎng)中的未折疊蛋白聚集負(fù)荷超過(guò)了內(nèi)質(zhì)網(wǎng)的正常折疊能力時(shí),將誘發(fā)內(nèi)質(zhì)網(wǎng)應(yīng)激(endoplasmic reticulum stress,ERS)。其中GRP78是內(nèi)質(zhì)網(wǎng)的關(guān)鍵分子伴侶之一,在ERS的激活中起重要作用。ERS不僅可以啟動(dòng)有保護(hù)作用的未折疊蛋白反應(yīng)和內(nèi)質(zhì)網(wǎng)相關(guān)降解,持續(xù)過(guò)度的ERS還可以觸發(fā)ERS相關(guān)凋亡,這其中包括ERS誘導(dǎo)的CHOP/GADD153表達(dá)、JNK的活化和Caspase-12蛋白水解酶的活化等[4-5]。氧化應(yīng)激是指人體受到有害刺激時(shí)由活性氧自由基ROS引起的病理反應(yīng)。研究表明,氧化應(yīng)激與認(rèn)知障礙的發(fā)生和發(fā)展密切相關(guān)。過(guò)度的ROS可能破壞細(xì)胞結(jié)構(gòu),誘導(dǎo)凋亡甚至壞死[6]。
丹參酮I IA(tanshinone I IA,Tan I IA)是丹參中含量最高的二萜醌類(lèi)化合物,具有抗炎、抗凋亡、抗氧化及抗動(dòng)脈粥樣硬化等作用[7-9]。有研究證明Tan I IA可以改善ERS誘導(dǎo)的心肌細(xì)胞凋亡[10],還可逆轉(zhuǎn)血管性癡呆大鼠的學(xué)習(xí)和記憶缺陷,主要機(jī)制可能與其抗自由基損傷、調(diào)節(jié)谷氨酸和γ-氨基丁酸等神經(jīng)遞質(zhì)含量有關(guān)[11]。但目前關(guān)于Tan I IA是否能保護(hù)CRF誘導(dǎo)的認(rèn)知功能障礙及其與ERS相關(guān)凋亡的關(guān)系尚未明確。本研究旨在評(píng)估Tan I IA對(duì)CRF相關(guān)認(rèn)知功能障礙大鼠的神經(jīng)保護(hù)作用及是否與調(diào)控ERS相關(guān)凋亡、氧化應(yīng)激有關(guān)。
1 材料和方法
1.1 材料
1.1.1 主要試劑和藥物:Tan I IA磺酸鈉注射液(諾新康)(2 mL∶10 mg)購(gòu)自杭州華東醫(yī)藥股份有限公司,由上海第一生化藥業(yè)有限公司生產(chǎn)。ERS激活劑衣霉素(tunicamycin,TM,美國(guó)Sigma-Aldrich公司),小鼠抗大鼠多克隆GRP78抗體(1∶1000)、小鼠抗大鼠多克隆CHOP抗體(1∶1000)、兔抗大鼠多克隆GAPDH抗體(1∶1000)均購(gòu)買(mǎi)自美國(guó)Santa Cruz公司,兔抗大鼠Caspase-12抗體(1∶2000)購(gòu)買(mǎi)自美國(guó)Abcam公司。Tunel試劑盒購(gòu)買(mǎi)自瑞士羅氏公司。丙二醛(malonaldehyde,MDA)測(cè)定試劑盒和超氧化物歧化酶(superoxide dismutase,SOD)測(cè)定試劑盒均購(gòu)自南京建成生物工程研究所。
1.1.2 主要儀器和設(shè)備:醫(yī)用微波爐(廣東格蘭仕公司),DK-S12型電熱恒溫水浴鍋(上海森信實(shí)驗(yàn)儀器有限公司),顯微鏡(日本Nikon公司),STP12脫水機(jī)、HM335E切片機(jī)、AP280-2包埋機(jī)(德國(guó)Microm公司),LEICA彩色病理圖像分析系統(tǒng)(德國(guó)LEICA公司),超低溫冰箱(日本Sanyo公司),Morris水迷宮(北京碩林苑科技有限公司)。
1.2 方法
1.2.1 分組與造模:SD雄性大鼠60只,初始體質(zhì)量150~180 g,購(gòu)于上海西普爾必凱實(shí)驗(yàn)動(dòng)物有限公司,實(shí)驗(yàn)動(dòng)物許可證號(hào):SYXK(浙)2013-0184。隨機(jī)分為5組,每組12只,分別為:對(duì)照組、模型組、TM組、TM+Tan I IA組和Tan I IA組。模型組、TM組、TM+Tan I IA組和Tan I IA組大鼠用10%水合氯醛麻醉,呈俯臥位固定于操作臺(tái)上,從距右側(cè)脊肋骨1.5 cm處斜向外方切口,暴露出右側(cè)腎臟,將整個(gè)右腎切除。1周后再次用10%水合氯醛麻醉后,俯臥位固定于操作臺(tái)上,從距左脊肋骨1.5 cm處斜向外方切口,暴露左側(cè)腎臟,分離腎周?chē)灸液髮⒛I的上下極各1/3切除,明膠海綿壓迫切面止血,復(fù)位腎臟,縫合,2次手術(shù)共切除5/6腎臟。4周時(shí)檢測(cè)血肌酐、尿素氮水平,若均大于對(duì)照組20%,證實(shí)造模成功。造模4周后開(kāi)始至12周,TM組和TM+Tan I IA組腹腔注射TM,劑量為4.5 mg/kg,2次/周;TM+Tan I IA組和Tan I IA組各給予Tan I IA 15 mg/kg,1次/d,腹腔注射,對(duì)照組注射等量0.9%氯化鈉溶液。
1.2.2 Morris水迷宮實(shí)驗(yàn):采用Morris水迷宮檢測(cè)大鼠的學(xué)習(xí)記憶能力。造模12周后進(jìn)行訓(xùn)練測(cè)試,將大鼠頭朝池壁放入水中,取東、南、西、北4個(gè)象限任選1個(gè)放入水中,水迷宮上方掛有自動(dòng)攝像系統(tǒng)用以記錄實(shí)驗(yàn)大鼠尋找平臺(tái)的路線,逃避潛伏期。若60 s后仍不能找到平臺(tái),則系統(tǒng)自動(dòng)默認(rèn)潛伏期為60 s,在第1、第2天若未找到則將其引導(dǎo)至平臺(tái)適應(yīng)10 s,第3天開(kāi)始不再引導(dǎo)。每只大鼠訓(xùn)練5 d,每天訓(xùn)練3次。第6天進(jìn)行平臺(tái)搜索實(shí)驗(yàn),將平臺(tái)撤去,任選一個(gè)象限將大鼠放入水中,其后4組大鼠均從同一個(gè)象限入水,觀察并記錄60 s內(nèi)大鼠穿越平臺(tái)的次數(shù)。
1.2.3 取材:水迷宮實(shí)驗(yàn)結(jié)束后,將大鼠經(jīng)6%水合氯醛腹腔麻醉,0.9%氯化鈉溶液快速心臟灌注將血液沖凈后,置于冰盤(pán)上取腦,快速分離海馬-80 ℃冰箱保存。HE染色、Tunel染色海馬標(biāo)本置于4%多聚甲醛固定。
這樣,如果司法機(jī)關(guān)嚴(yán)格執(zhí)行寬嚴(yán)相濟(jì)刑事政策,判處死刑的案件就會(huì)增加。這種增加顯然不符合刑罰輕緩化的世界潮流。在刑罰輕緩化思潮與寬嚴(yán)相濟(jì)刑事政策之間沖突的協(xié)調(diào)中,對(duì)嚴(yán)重刑事案件判處死刑但緩期二年執(zhí)行是一條走得通的道路。這種死刑緩期兩年執(zhí)行的判決,一方面滿(mǎn)足了從嚴(yán)辦理嚴(yán)重刑事案件的政策要求,另一方面又不至于使刑罰整體上呈現(xiàn)出過(guò)分偏重于重刑而完全有悖于刑罰輕緩化趨勢(shì)的情況。
1.3 統(tǒng)計(jì)學(xué)處理方法 采用SPSS17.0統(tǒng)計(jì)軟件進(jìn)行統(tǒng)計(jì)學(xué)處理。所有數(shù)據(jù)均進(jìn)行正態(tài)性、方差齊性檢驗(yàn),以±s表示,水迷宮逃避潛伏期采用重復(fù)測(cè)量資料的方差分析,其他數(shù)據(jù)組間比較均采用單因素方差分析。P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 Morris水迷宮檢測(cè)大鼠學(xué)習(xí)記憶能力 圖1顯示了各組搜索平臺(tái)的路線圖,模型組、TM組搜索平臺(tái)路線較對(duì)照組明顯延長(zhǎng),加入Tan I IA后路線距離明顯縮短。各組之間,訓(xùn)練前2 d逃避潛伏期差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05);與對(duì)照組比,模型組、TM組大鼠從第3天開(kāi)始逃避潛伏期明顯延長(zhǎng)(P<0.05),且TM組較模型組逃避潛伏期更長(zhǎng)(P<0.05)。
1.2.4 海馬組織、血清中MDA和SOD含量測(cè)定:取海馬組織勻漿液和血清各0.1 mL,采用TBA比色法,比色波長(zhǎng)532 nm,按照試劑盒說(shuō)明檢測(cè)MDA含量。使用冷的0.9%氯化鈉溶液作為勻漿介質(zhì),海馬勻漿液3000 r/min離心10 min,取40 μL上清液,取血清20 μL,采用黃嘌呤氧化酶法,比色波長(zhǎng)550 nm,按照試劑盒說(shuō)明書(shū)檢測(cè)SOD含量。
1.2.5 HE染色:取經(jīng)過(guò)4%多聚甲醛固定的海馬,在0.01 mol/L的PBS中浸泡過(guò)夜,按照常規(guī)梯度乙醇脫水,石蠟包埋,切片,經(jīng)二甲苯脫蠟及梯度乙醇復(fù)水后,行HE染色,再使用梯度乙醇脫水,滴加中性樹(shù)膠封片,顯微鏡拍照觀察。
1.2.6 Tunel染色:經(jīng)4%多聚甲醛固定的海馬石蠟切片用蒸餾水洗滌后,在37 ℃下與蛋白質(zhì)消化酶一起溫育20 min,然后,使用Tunel凋亡試劑盒按照說(shuō)明書(shū)進(jìn)行分析。
1.2.7 Western blot檢測(cè):取60 mg海馬組織使用RIPA裂解液充分裂解后抽提總蛋白,離心后取上清液。依照BCA蛋白定量試劑盒的使用方法檢測(cè)上清中蛋白濃度。根據(jù)蛋白濃度加入相應(yīng)體積的總蛋白與5×SDS-PAGE加樣緩沖液混合煮沸5~10 min后加入加樣孔,進(jìn)行SDS-PAGE電泳。用濕轉(zhuǎn)法將分離膠上的蛋白轉(zhuǎn)移到PVDF膜上,用5%脫脂奶粉封閉,分別加入CHOP(1∶1000)、GRP78(1∶1000)和Caspase-12一抗(1∶2000)稀釋液,以及內(nèi)參GAPDH抗體(1∶1000)稀釋液,4 ℃搖床孵育過(guò)夜,TBST洗膜后用稀釋好的二抗(HRP標(biāo)記山羊抗鼠/抗兔二抗1∶5000)室溫下孵育2 h,洗膜,顯影后定影,自動(dòng)成像系統(tǒng)成像并分析。TM組在使用Tan I IA干預(yù)后水迷宮訓(xùn)練的第3天開(kāi)始逃避潛伏期較TM組明顯縮短(P<0.05),造模后單純使用Tan I IA干預(yù)的大鼠第3天逃避潛伏期縮短更明顯,第5天時(shí)接近正常水平(P<0.05),見(jiàn)圖2。水迷宮實(shí)驗(yàn)第6天的空間探索實(shí)驗(yàn)中,與對(duì)照組比,模型組穿越平臺(tái)次數(shù)明顯減少(P<0.05),TM組減少更加明顯(P<0.05),而TM組在使用Tan I IA干預(yù)后穿越平臺(tái)次數(shù)增加(P<0.05),單純使用Tan I IA干預(yù)組大鼠穿越平臺(tái)次數(shù)接近對(duì)照組,見(jiàn)圖3。
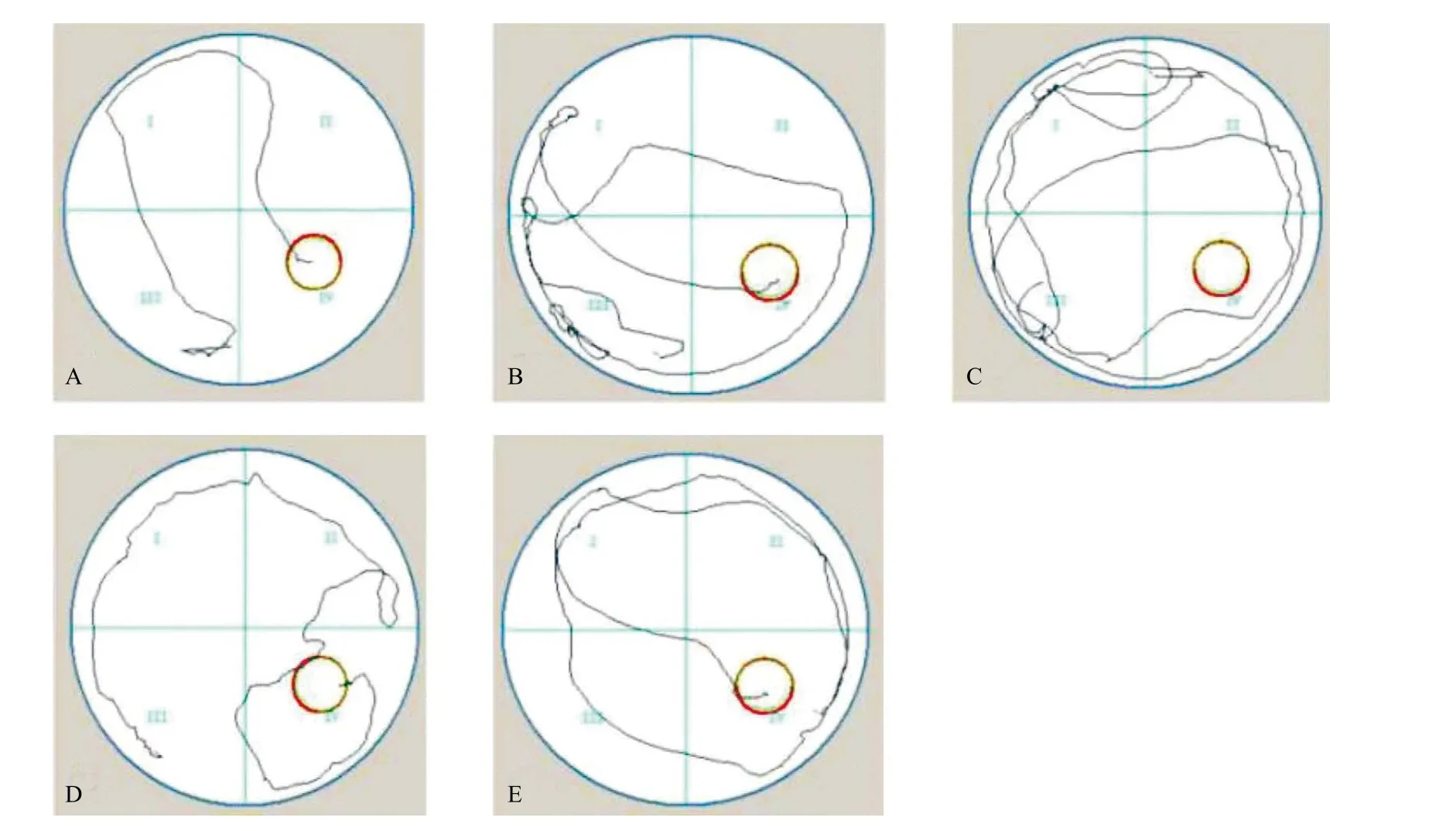
圖1 各組搜索平臺(tái)的路線圖
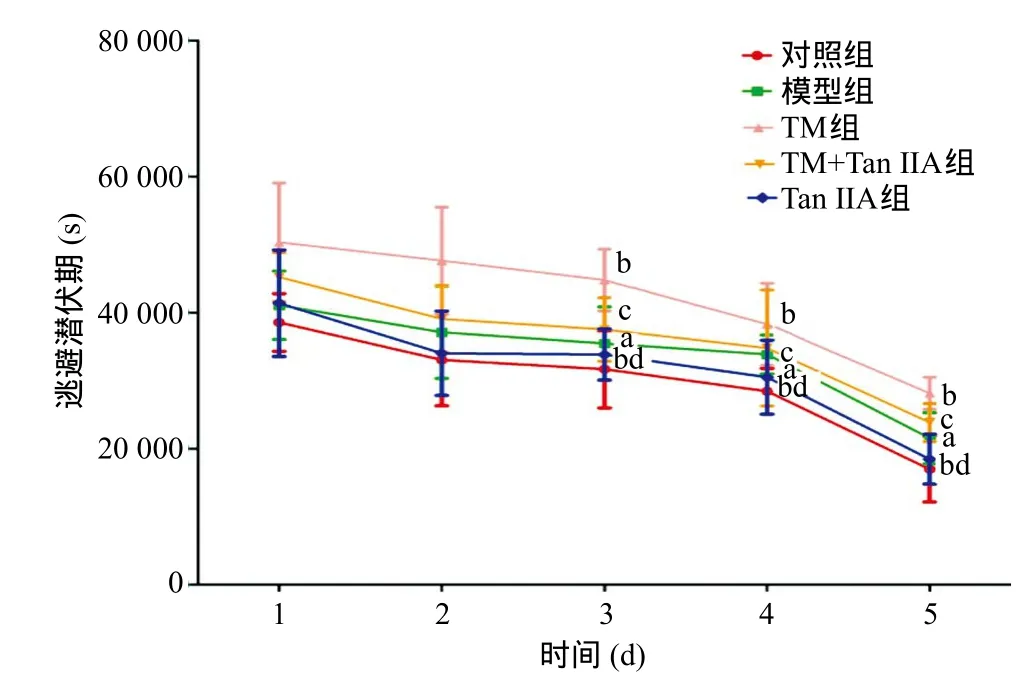
圖2 各組逃避潛伏期
2.2 大鼠血清和海馬MDA、SOD含量比較 模型組血清、海馬組織中MDA含量較對(duì)照組明顯升高(P<0.05),加入TM干預(yù)后進(jìn)一步升高(P<0.05),而模型組和TM組在各自加入Tan I IA干預(yù)后MDA含量明顯下降(P<0.05),造模后單純加入Tan I IA較TM+Tan I IA組大鼠大鼠血清、海馬MDA含量下降更明顯(P<0.05)。模型組血清、海馬組織中SOD含量較對(duì)照組明顯下降(P<0.05),加入TM干預(yù)后進(jìn)一步下降(P<0.01),而模型組和TM組在分別加入Tan I IA干預(yù)后SOD含量明顯升高(P<0.05),單純加入Tan I IA的較TM+Tan I IA組大鼠血清、海馬SOD含量升高更明顯(P<0.01)。見(jiàn)表1。
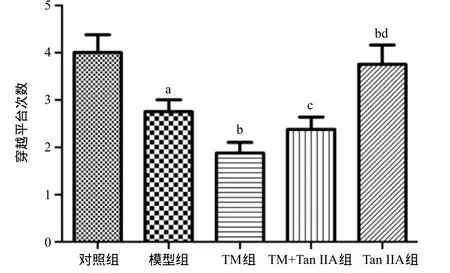
圖3 穿越平臺(tái)次數(shù)
表1 各組大鼠血清和海馬MDA含量及SOD活力比較(n=12, ±s)
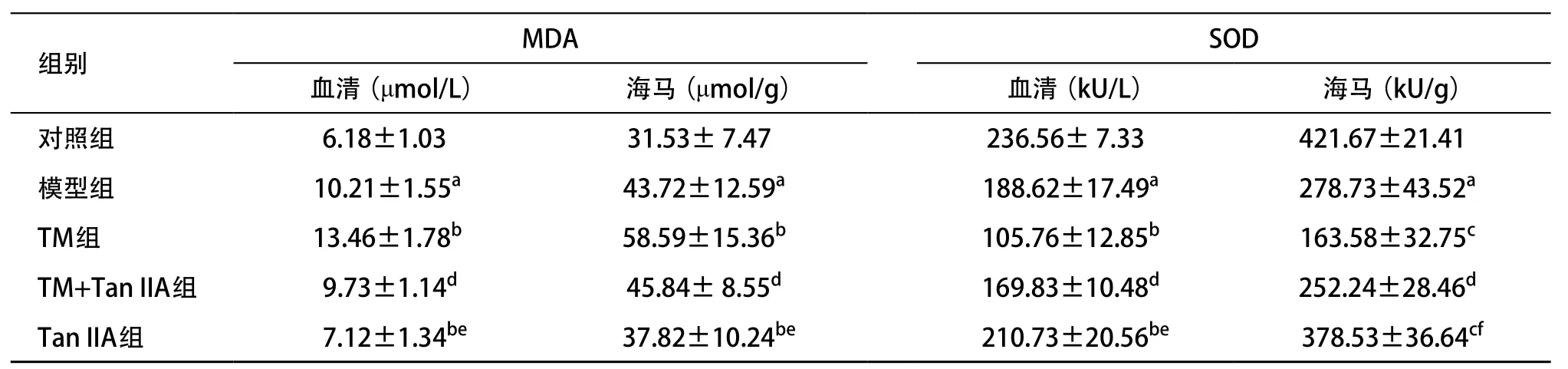
表1 各組大鼠血清和海馬MDA含量及SOD活力比較(n=12, ±s)
與對(duì)照組比:aP<0.05;與模型組比:bP<0.05,cP<0.01;與TM組比:dP<0.05;與TM+Tan I IA組比:eP<0.05,fP<0.01
SOD血清(μmol/L) 海馬(μmol/g) 血清(kU/L) 海馬(kU/g)對(duì)照組 6.18±1.03 31.53± 7.47 236.56± 7.33 421.67±21.41模型組 10.21±1.55a 43.72±12.59a 188.62±17.49a 278.73±43.52a TM組 13.46±1.78b 58.59±15.36b 105.76±12.85b 163.58±32.75c TM+Tan IIA組 9.73±1.14d 45.84± 8.55d 169.83±10.48d 252.24±28.46d Tan IIA組 7.12±1.34be 37.82±10.24be 210.73±20.56be 378.53±36.64cf組別 MDA
2.4 各組大鼠12周時(shí)海馬凋亡情況比較 與對(duì)照組比,模型組凋亡細(xì)胞百分比明顯增高(P<0.05);與模型組比,TM組凋亡細(xì)胞百分比更進(jìn)一步升高,使用Tan I IA干預(yù)后可明顯降低模型組和TM組的凋亡率(P<0.05),造模大鼠單純使用Tan I IA干預(yù)較TM+Tan I IA組凋亡百分比降低更明顯(P<0.01)。見(jiàn)圖5。
2.5 Western blot檢測(cè)各組海馬組織GRP78、CHOP、Caspase-12蛋白表達(dá) Western blot結(jié)果顯示模型組大鼠海馬GRP78、CHOP、Caspase-12蛋白水平較對(duì)照組比明顯增加(P<0.05),TM組上述蛋白表達(dá)更進(jìn)一步升高(P<0.05),加入Tan I IA干預(yù)后上述蛋白表達(dá)明顯下降(P<0.05),單純加入Tan I IA干預(yù)較TM+Tan I IA組GRP78、CHOP、Caspase-12蛋白表達(dá)下降更明顯(P<0.05)。見(jiàn)圖6。
3 討論
ERS在細(xì)胞應(yīng)激過(guò)程中起著重要作用,作為ERS的重要信號(hào)通路之一,未折疊蛋白反應(yīng)(unfolded protein reaction,UPR)主要是通過(guò)改善內(nèi)質(zhì)網(wǎng)中蛋白質(zhì)負(fù)載和折疊能力之間的平衡,以及營(yíng)養(yǎng)因子和(或)生長(zhǎng)因子的分泌,進(jìn)而減輕ERS并促使細(xì)胞存活[12-14]。嚴(yán)重而持續(xù)的ERS超過(guò)內(nèi)質(zhì)網(wǎng)所能承受的范圍時(shí),則會(huì)對(duì)細(xì)胞造成損傷或觸發(fā)細(xì)胞凋亡信號(hào)途徑引起細(xì)胞死亡,這被稱(chēng)為ERS相關(guān)的細(xì)胞凋亡[4,12-14]。GRP78是內(nèi)質(zhì)網(wǎng)的關(guān)鍵分子伴侶之一,在ERS的激活中起重要作用。GRP78表達(dá)的上調(diào)是ERS活化的標(biāo)志。ERS誘導(dǎo)的凋亡與CHOP和Caspase-12表達(dá)密切相關(guān)。CHOP是轉(zhuǎn)錄因子家族C/EBP的成員,在正常生理?xiàng)l件下其表達(dá)水平非常低,當(dāng)內(nèi)質(zhì)網(wǎng)受到應(yīng)激時(shí),CHOP被顯著誘導(dǎo)并參與下游凋亡相關(guān)基因的表達(dá)[4,12-14]。Caspase-12是內(nèi)質(zhì)網(wǎng)膜蛋白,通過(guò)ERS誘導(dǎo)的降解誘導(dǎo)細(xì)胞凋亡。因此,Caspase-12是內(nèi)質(zhì)網(wǎng)凋亡信號(hào)通路中的關(guān)鍵分子[4,12-14]。
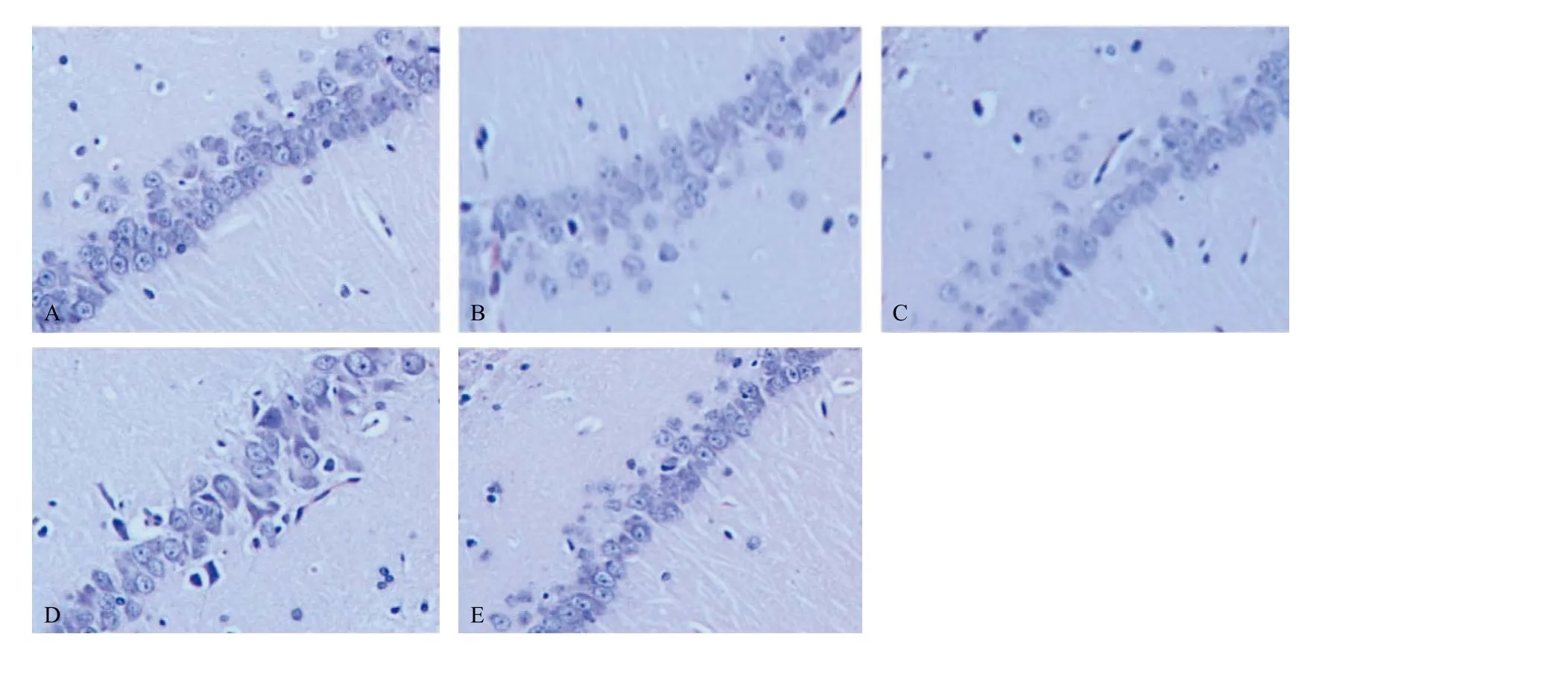
圖4 各組大鼠海馬12周病理形態(tài)學(xué)改變(HE,×200)
許多神經(jīng)退行性疾病的發(fā)病機(jī)制與ERS及其相關(guān)凋亡密切相關(guān)。阿爾茨海默病(Alzheimer’s disease,AD)是最常見(jiàn)的神經(jīng)退行性疾病,其特征在于漸進(jìn)性認(rèn)知功能減退和神經(jīng)元退行性改變。AD的主要病理改變是錯(cuò)誤折疊的Aβ蛋白,以及作為神經(jīng)原纖維纏結(jié)成分的老年斑和tau蛋白的形成[15-16]。人腦中的早老素1蛋白(presenilin 1,PS-1)隨著年齡的增長(zhǎng)而增加并且影響老年人的記憶。編碼這種蛋白質(zhì)的PS-1基因的突變被認(rèn)為與AD的發(fā)病密切相關(guān)。有研究發(fā)現(xiàn),PS-1突變細(xì)胞可提高ERS的敏感性,使GRP78/Bip mRNA的表達(dá)受到明顯抑制,進(jìn)而使神經(jīng)元更易受到過(guò)度應(yīng)激引起損傷[17]。與此不同,在AD大鼠模型中,敲除Caspase-12可明顯抑制ERS誘導(dǎo)的細(xì)胞凋亡[17]。在持續(xù)光照誘導(dǎo)空間認(rèn)知障礙的大鼠模型中發(fā)現(xiàn)tau蛋白存在多個(gè)位點(diǎn)磷酸化且GRP78/Bip及CHOP表達(dá)增加,從而證明AD樣分子病理?yè)p傷也涉及ERS[18]。帕金森氏病(Parkinson’s disease,PD)被認(rèn)為是一種以α-突觸核蛋白為主要成分的聚集體在胞漿內(nèi)聚積,進(jìn)而引起黑質(zhì)多巴胺能神經(jīng)元細(xì)胞選擇性死亡的神經(jīng)退行性病變。有研究表明,ERS誘導(dǎo)劑,如毒胡蘿卜素(thapsigargin,TG)和布雷菲德菌素A(brefeldin A,BFA),能引起大量多巴胺能神經(jīng)元的死亡,并且發(fā)現(xiàn)人神經(jīng)母細(xì)胞瘤SH-SY5Y在經(jīng)過(guò)多巴胺處理以后出現(xiàn)了CHOP等一些與ERS相關(guān)的凋亡蛋白表達(dá)的增加及細(xì)胞的死亡[19-20]。本研究觀察到CRF大鼠中存在著一定程度的學(xué)習(xí)記憶障礙以及海馬神經(jīng)元結(jié)構(gòu)的破壞,同時(shí)伴隨有GRP78、CHOP及Cas-pase-12表達(dá)的增加,而ERS誘導(dǎo)劑TM更進(jìn)一步加重了上述改變,說(shuō)明CRF大鼠的認(rèn)知障礙與ERS誘導(dǎo)的細(xì)胞凋亡密切相關(guān)。
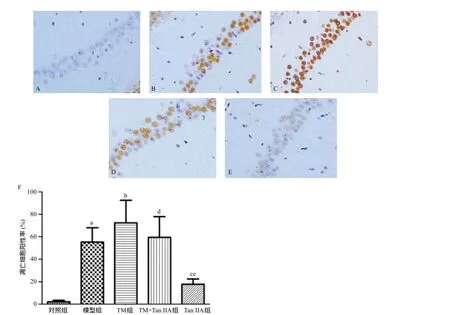
圖5 各組大鼠12周海馬凋亡圖(A-E,Tunel染色,×200)及細(xì)胞凋亡率比較(F)
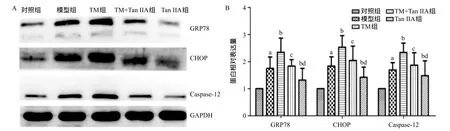
圖6 各組海馬組織GRP78、CHOP、Caspase-12蛋白Western blot檢測(cè)(A)及統(tǒng)計(jì)圖(B)
Tan IIA是丹參中含量最高的活性成分,具有清除自由基、抗氧化、降低血液黏度、抑制血液凝固、促進(jìn)纖維蛋白溶解、抑制血小板聚集、促進(jìn)血栓溶解的作用。最近的研究證實(shí)Tan I IA具有神經(jīng)保護(hù)作用[7-9]。研究表明Tan I IA可以通過(guò)維持錐體細(xì)胞在海馬CA1區(qū)域的興奮性和突觸可塑性來(lái)改善慢性缺氧大鼠的認(rèn)知缺陷[21]。Tan I IA也可以通過(guò)減少海馬長(zhǎng)時(shí)程增強(qiáng)抑制來(lái)改善癲癇大鼠的認(rèn)知功能障礙[22]。它可以通過(guò)抗氧化應(yīng)激、增加海馬谷氨酸和γ-氨基丁酸含量,在血管性癡呆大鼠中起到神經(jīng)保護(hù)作用[11]。
MDA是脂質(zhì)過(guò)氧化物的最終產(chǎn)物,可反映氧自由基的產(chǎn)生,SOD是人體內(nèi)重要的氧化自由基清除劑,可以消除氧化自由基對(duì)體內(nèi)脂質(zhì)和碳水化合物代謝的影響及其對(duì)細(xì)胞的損傷,從而保護(hù)身體免受損傷。本研究表明,Tan I IA可以降低大鼠血清、海馬組織MDA活性,增加SOD水平,表明Tan I IA具有抗氧化應(yīng)激的作用并且可以抑制脂質(zhì)過(guò)氧化。在抗凋亡研究方面,有學(xué)者發(fā)現(xiàn)Tan I IA能顯著抑制H2O2誘導(dǎo)的心肌細(xì)胞凋亡,增加心肌細(xì)胞中Bcl-2/Bax蛋白比率,減少Tunel陽(yáng)性細(xì)胞和Caspase-3的激活[23]。也有研究發(fā)現(xiàn)Tan I IA可通過(guò)激活PI3K/Akt和磷酸化GSK3/β抑制Aβ25-35誘導(dǎo)的凋亡[24]。此外,還有研究發(fā)現(xiàn)Tan I IA能通過(guò)調(diào)控Bcl-2家族蛋白中抗凋亡蛋白和線粒體膜超極化、抑制cytC釋放和Caspase-3活性,從而靶向抑制線粒體凋亡途徑來(lái)抑制慢性低氧誘導(dǎo)的H9C2細(xì)胞凋亡[25]。本研究發(fā)現(xiàn)Tan I IA可以改善CRF模型組大鼠記憶障礙,下調(diào)GRP78、CHOP及Caspase-12蛋白表達(dá),減少凋亡細(xì)胞,改善海馬神經(jīng)元結(jié)構(gòu),在加入ERS激活劑TM干預(yù)后,造模大鼠的ERS相關(guān)凋亡情況、海馬神經(jīng)元破壞較模型組更明顯,認(rèn)知障礙更為突出,但加入Tan I IA后可以得到明顯改善,說(shuō)明Tan I IA可能通過(guò)抑制ERS相關(guān)凋亡、抗氧化應(yīng)激發(fā)揮神經(jīng)保護(hù)作用。
綜上所述,在本研究中,通過(guò)Morris水迷宮訓(xùn)練發(fā)現(xiàn)模型組大鼠學(xué)習(xí)記憶能力較對(duì)照組明顯下降,使用TM干預(yù)后下降更為明顯,在加入Tan I IA干預(yù)后模型大鼠在搜索平臺(tái)試驗(yàn)和穿越平臺(tái)次數(shù)試驗(yàn)中表現(xiàn)都明顯改善。造模12周以后模型組大鼠ERS相關(guān)凋亡水平顯著上升,GRP78、CHOP、Caspase-12蛋白表達(dá)水平和凋亡細(xì)胞百分比增加,MDA水平增加,SOD水平降低,細(xì)胞結(jié)構(gòu)破壞明顯,使用TM后ERS相關(guān)凋亡水平,氧化應(yīng)激水平進(jìn)一步上升,細(xì)胞結(jié)構(gòu)破壞較模型組更明顯,而Tan I IA干預(yù)后ERS凋亡水平顯著下降,抗氧化應(yīng)激能力顯著提高,細(xì)胞結(jié)構(gòu)得到明顯改善。說(shuō)明在CRF相關(guān)的認(rèn)知障礙中Tan I IA可能可以通過(guò)抑制ERS相關(guān)凋亡、抗氧化應(yīng)激來(lái)發(fā)揮神經(jīng)保護(hù)、改善認(rèn)知作用。
[1] ZHANG L, WANG F, WANG L, et al. Prevalence of chronic kidney disease in China: a cross-sectional survey[J]. Lancet,2012, 379(9818): 815-822.
[2] WANG J, LI X B, HUANG P, et al. Change of peripheral blood Treg/Thl7 in cognitive impairment with chronic renal failure patients[J]. Cell Physiol Biochem, 2018, 45(1): 281-290.
[3] MURRAY A M, TUPPER D E, KNOPMAN D S, et al. Cognitive impairment in hemodialysis patients is common[J].Neurology, 2006, 67(2): 216-223.
[4] KIM I, XU W, REED J C. Cell death and endoplasmic reticulum stress: disease relevance and therapeutic opportunities[J]. Nat Rev Drug Discov, 2008, 7(12): 1013-1030.
[5] 項(xiàng)冰倩, 高慧, 陳錫文, 等. 內(nèi)質(zhì)網(wǎng)過(guò)度應(yīng)激介導(dǎo)低氧高二氧化碳肺動(dòng)脈高壓大鼠的腦損傷[J]. 生理學(xué)報(bào), 2017,69(4): 413-421.
[6] KOVAL?íKOVá A, GYURáSZOVá M, VAVRINCOVáYAGHI D, et al. Oxidative stress in the brain caused by acute kidney injury[J]. Metab Brain Dis, 2018, 33(3): 961-967
[7] FENG J, LI S, CHEN H. Tanshinone IIA inhibits myocardial remodeling induced by pressure overload via suppressing oxidative stress and inf l ammation:Possible role of silent information regulator 1[J]. Eur J Pharmacol, 2016, 791: 632-639.
[8] ZHANG Z, LI Y, SHENG C, et al. Tanshinone IIA inhibits apoptosis in the myocardium by inducing microRNA-152-3p expression and thereby downregulating PTEN[J].Am J Transl Res, 2016, 8(7): 3124-3132.
[9] WENG Y S, WANG H F, PAI P Y, et al. Tanshinone IIA prevents Leu27 IGF-II-induced cardiomyocyte hypertrophy mediated by estrogen receptor and subsequent akt activation[J].Am J Chin Med, 2015, 43(8): 1567-1591
[10] FENG J, LI S, CHEN H. Tanshinone IIA ameliorates apoptosis of cardiomyocytes induced by endoplasmic reticulum stress[J]. Exp Biol Med (Maywood), 2016, 241(18): 2042-2048.
[11] 何治, 潘志紅, 魯文紅. 丹參酮I I A對(duì)血管性癡呆大鼠的神經(jīng)保護(hù)作用機(jī)制[J]. 中國(guó)中藥雜志, 2010, 35(14): 1883-1886.
[12] XIANG C, WANG Y, ZHANG H, et al. The role of endoplasmic reticulum stress in neurodegenerative disease[J].Apoptosis, 2017, 22(1): 1-26.
[13] HOTAMISLIGIL G S. Endoplasmic reticulum stress and atherosclerosis[J]. Nat Med, 2010, 16(4): 396-399.
[14] BáNHEGYI G, BAUMEISTER P, BENEDETTI A, et al.Endoplasmic reticulum stress[J]. Ann N Y Acad Sci, 2010,1113: 58-71.
[15] HARDY J, SELKOE D J. The amyloid hypothesis of Alzheimer’s disease: progress and problems on the road to therapeutics[J]. Science, 2002, 297(5580): 353-356.
[16] 吳彬彬, 董張雷, 連慶泉. 線粒體功能障礙與阿爾茨海默病[J]. 溫州醫(yī)科大學(xué)學(xué)報(bào), 2014, 44(7): 543-546.
[17] SIMAN R, FLOOD D G, THINAKARAN G, et al. Endoplasmic reticulum stress-induced cysteine protease activation in cortical neurons: effect of an Alzheimer’s disease-linked presenilin-1 knock-in mutation[J]. J Biol Chem,2001, 276(48): 44736-44743.
[18] LING Z Q, TIAN Q, WANG L, et al. Constant illumination induces Alzheimer-like damages with endoplasmic reticulum involvement and the protection of melatonin[J]. J Alzheimers Dis, 2009, 16(2): 287-300.
[19] RYU E J, HARDING H P, ANGELASTRO J M, et al. Endoplasmic reticulum stress and the unfolded protein response in cellular models of Parkinson’s disease[J]. J Neurosci,2002, 22(24): 10690-10698.
[20] GóMEZ-SANTOS C, BARRACHINA M, GIMéNEZXAVIER P, et al. Induction of C/EBPβ and GADD153 expression by dopamine in human neuroblastoma cells: Relationship with α-synuclein increase and cell damage[J]. Brain Res Bull, 2005, 65(1): 87-95.
[21] 魏敏, 閆志強(qiáng), 董明清, 等. 丹參酮I I A預(yù)防慢性缺氧大鼠認(rèn)知功能障礙的電生理機(jī)制[J]. 現(xiàn)代生物醫(yī)學(xué)進(jìn)展, 2012,12(11): 2057-2060.
[22] 姜珊, 陸西萍, 高華, 等. 丹參酮I I A對(duì)癲癇大鼠認(rèn)知功能障礙的治療作用[J]. 神經(jīng)解剖學(xué)雜志, 2014, 30(4): 452-456.
[23] FU J, HUANG H, LIU J, et al. Tanshinone IIA protects cardiac myocytes against oxidative stress-triggered damage and apoptosis[J]. Eur J Pharmacol, 2007, 568(1-3): 213-221.
[24] DONG H, MAO S, WEI J, et al. Tanshinone IIA protects PC12 cells from β-amyloid (25-35)-induced apoptosis via PI3K/Akt signaling pathway[J]. Mol Biol Rep, 2012, 39(6):6495-6503.
[25] JIN H J, XIE X L, YE J M, et al. Tanshinone IIA and cryptotanshinone protect against hypoxia-induced mitochondrial apoptosis in H9c2 cells[J]. PLoS One, 2013, 8(1): e51720.

