心臟手術IABP相關并發癥、危險因素及預防措施分析
劉 婷,李曉濤
動脈內球囊反搏(IABP)是一種應用反搏動原理控制動脈內球囊節律性收縮和舒張的機械裝置,使球囊在主動脈瓣開放前收縮,在心臟開始舒張時膨脹,提高舒張壓和心肌收縮力,減輕收縮時左室后負荷,從而改善大腦、外周組織及器官灌注[1]。近年來,IABP已廣泛應用于心臟外科手術的輔助治療,臨床療效顯著,但不可避免的是其相關并發癥,如缺血、血小板減少、下肢動脈閉塞等,嚴重影響患者生存率和術后康復[2]。本研究回顧性分析醫院125例應用IABP輔助治療的心臟手術患者臨床資料,旨在探討IABP輔助治療的心臟手術患者相關并發癥發生情況及其危險因素和預防措施。
1 資料與方法
1.1 病例資料 回顧性分析醫院2014年4月~2017年4月125例應用IABP輔助治療的心臟手術患者臨床資料,納入標準:(1)符合心臟病診斷標準[3];(2)經心電圖、心臟彩超等檢查確診為心臟病;(3)年齡 50~75 歲,可耐受心臟外科手術;(4)無手術禁忌證或麻醉禁忌證;(5)同意接受IABP輔助治療。排除標準:(1)急性心肌梗死合并心源性休克;(2)中、重度主動脈瓣反流;(3)存在主動脈外傷、主動脈夾層等主動脈病變;(4)妊娠期或哺乳期婦女;(5)不接受 IABP輔助治療;(6)臨床資料不全者。125例中,男性87例,女性38例;冠心病93例,瓣膜病32例;術前應用IABP 28例,術中應用IABP 41例,術后于ICU應用IABP 56例。
1.2 IABP相關并發癥診斷標準[4](1)穿刺相關并發癥:包括假性動脈瘤、下肢動脈閉塞、血腫。(2)缺血:若在置入IABP后,血壓下降、肢體動脈搏動消失,拔除IABP導管后好轉,即判定為輕度缺血;若置入IABP的肢體蒼白、皮膚溫度異常、脈搏消失,需作切開減壓,則判定為嚴重缺血。(3)墜積性肺炎:在置人IABP后3 d內,患者確診為肺炎(以胸片結果為準),拔除IABP導管后好轉。(4)IABP相關血小板減少:在置人IABP后3 d內,患者血小板低于100×109/L或減少超過1/4,于拔除IABP導管后恢復正常。(5)IABP失功:由于置入的IABP球囊破裂漏氣、充盈不良或導管內血液等問題所致的IABP失功。
1.3 資料收集 收集所有患者年齡、性別、術前心臟射血分數(EF)、術前合并癥、IABP相關并發癥、體外膜肺氧合(ECMO)使用情況等資料。
1.4 統計學方法 應用SPSS19.0統計軟件分析數據,計數數據以[n(%)]表示,采用χ2檢驗進行單因素分析,應用Logistic回歸分析方程進行多因素影響因素分析,P<0.05為差異有統計學意義。
2 結果
2.1 IABP相關并發癥發生情況 125例中,36例(28.8%)發生圍手術期IABP相關并發癥,而術前、術中、術后不同時段的IABP相關并發癥發生率比較無顯著差異(P>0.05,表1)。
2.2 圍手術期IABP相關并發癥的單因素分析

表1 圍手術期IABP相關并發癥分布[n(%)]
根據患者是否發生IABP相關并發癥,將患者分為并發癥組和無并發癥組,進行影響IABP相關并發癥的單因素分析。從表2可見,年齡、合并糖尿病、合并外周血管疾病、IABP持續時間及應用ECMO為影響IABP輔助治療的心臟手術患者發生IABP相關并發癥的危險因素(P<0.05)。

表2 圍手術期IABP相關并發癥的單因素分析
2.3 圍手術期IABP相關并發癥的多因素Logistic回歸分析 ≥65歲、合并糖尿病、合并外周血管疾病、應用ECMO、IABP持續時間≥32 h為IABP輔助治療的心臟手術患者發生IABP相關并發癥的獨立危險因素(P< 0.05,表 3)。
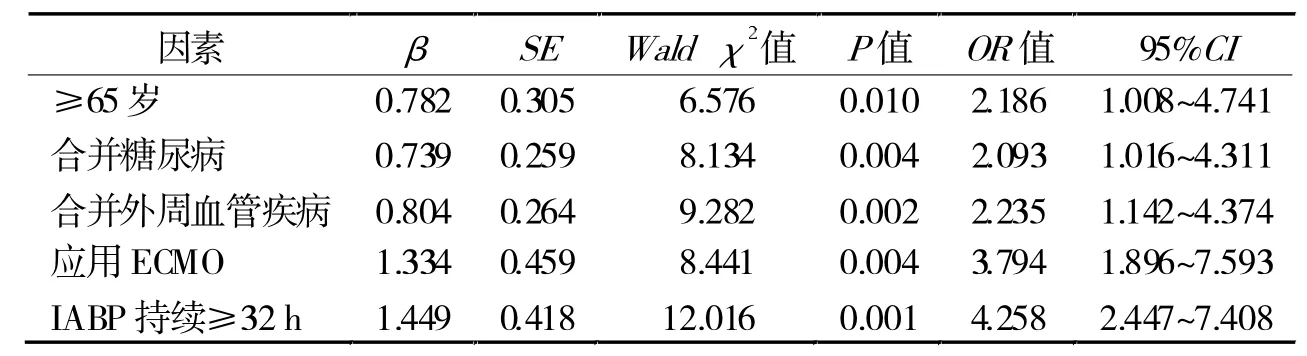
表3 圍手術期IABP相關并發癥的多因素Logistic回歸分析
3 討論
IABP是目前在心臟外科手術中應用最廣泛的輔助治療方法之一,不僅能改善冠脈血供,維持血壓,減少室壁張力和心臟后負荷,還能增加心排血量,減少心肌耗氧量,改善患者血流動力學障礙和心肌缺血的癥狀[5]。但IABP是一種有創操作,其相關并發癥發生率高達50%。雖隨著球囊導管技術的進步和經皮穿刺術的應用而有所下降,但危重癥心臟病患者在癥狀發作的48 h內仍有過多的死亡和并發癥的發生[6]。本研究結果顯示,IABP相關并發癥發生率為28.8%,尤其以穿刺相關并發癥的發生率較高;多因素Logistic回歸分析顯示,≥65歲、合并糖尿病、合并外周血管疾病、應用ECMO、IABP持續時間≥32 h為IABP輔助治療的心臟手術患者發生IABP相關并發癥的獨立危險因素。
老齡心臟病患者動脈粥樣硬化嚴重,加之動脈較細,穿刺時易出現血腫、下肢動脈閉塞等損傷,故臨床中應規范操作,動作輕柔,若發現動脈硬化,應改用更小型號的氣囊管[7]。由于患者長時間低血壓、低血容量、抗凝不充分、穿刺血管狹窄等,易導致行IABP后肢體缺血。因此,在應用IABP輔助治療前,應先檢查患者股動脈和足背動脈搏動情況,根據患者身高選擇合適的球囊管[8]。IABP球囊置入后,其表面會形成大量微血栓;球囊的充氣和放氣可刺激血小板的活化,使微血栓脫落,消耗血小板,出現IABP相關的血小板減少。所以,在IABP輔助治療期間,應密切監測患者血小板功能及數量[9]。由于穿管技術、機械損傷等致使球囊破裂,導致IABP失功,應立刻拔除導管,避免腦部氣栓的發生,必要時可行動脈切開。
本研究結果顯示,年齡≥65歲的心臟手術患者IABP相關并發癥發生率明顯高于年齡50~64患者,說明年齡是一個重要的危險因素。合并糖尿病者冠脈狹窄常為多支,并伴有周圍血管疾病,病情更復雜,IABP輔助治療往往會提高患者肢體缺血的發生率[10]。有學者認為,IABP輔助持續時間與其并發癥發生率有相關性,輔助治療時間越長,出現下肢缺血的病患越多。本研究也發現,IABP輔助持續時間≥32 h的并發癥發生率明顯高于持續時間<32 h者,IABP輔助持續時間≥32 h為IABP相關并發癥發生的獨立危險因素[11]。ECMO是一種可用于體外呼吸支持和心臟支持的改良的人工心肺機,可承擔肺功能受損患者氣體交換的任務,其血泵可替代心功能嚴重受損患者的心臟泵血功能,為危重癥患者的康復爭取寶貴時間。但IABP、ECMO都需行有創的外周血管插管,增加血管并發癥發生的風險[12]。為預防IABP相關并發癥的發生,輔助治療前應全面評估患者病情,制訂個體化手術和輔助治療方案,輔助治療后及時給予抗凝治療,積極監測各項指標,以便及時對癥治療[13]。
綜上所述,肢體缺血、穿刺損傷、血小板減少是心臟手術患者圍手術期IABP輔助治療難以避免的并發癥,≥65歲、IABP持續時間≥32 h、合并糖尿病、合并外周血管疾病、應用ECMO是IABP相關并發癥發生的獨立危險因素,臨床中應對高危患者予以嚴密監測,以減少圍手術期并發癥的發生。
[1] 經子蘭,任麗麗,趙昕,等.主動脈內球囊反搏輔助治療冠心病合并慢性腎臟疾病的PCI患者臨床療效觀察[J].解放軍醫學雜志,2015,40(4):266-270.
[2] 崔錦鋼,吳元,趙冬云,等.主動脈內球囊反搏在急性冠狀動脈綜合征治療中的臨床應用及并發癥情況分析[J].中國循環雜志,2015,30(2):107-110.
[3] 美國紐約心臟病學會標準委員會.心臟與大血管病命名法和診斷標準[M].哈爾濱:黑龍江人民出版社,1981:1-5.
[4] 杜萍,張杰,宋鐵鷹,等.心臟手術后IABP相關并發癥與危險因素的關系及分析[J].河北醫藥,2012,34(5):677-678.
[5] 崔錦鋼,吳元,趙冬云,等.主動脈內球囊反搏在急性冠狀動脈綜合征治療中的臨床應用及并發癥情況分析[J].中國循環雜志,2015,30(2):107-110.
[6] 陳少敏,王文亮,馬貴洲,等.主動脈內球囊反搏聯合前列地爾對急診PCI術后無復流急性心梗患者的療效評價[J].醫學臨床研究,2016,33(8):1619-1621.
[7] 周宏艷,張永輝,杜雨,等.心臟外科圍手術期用主動脈內球囊反搏輔助的相關并發癥及危險因素:附12年單中心數據分析[J].中華危重病急救醫學,2017,29(6):506-510.
[8] 楊海平,郝懿,陳林,等.心臟外科圍術期主動脈內球囊反搏應用及其并發癥的臨床分析[J].中國綜合臨床,2017,33(3):217-220.
[9] 池銳彬,周卉芬,葉銓秋,等.重癥加強病房床旁安置主動脈球囊反搏泵的安全性分析[J].臨床急診雜志,2017,18(5):390-392.
[10] 謝波,薛松,徐根興,等.主動脈內球囊反搏血管源性并發癥的臨床分析[J].中國循環雜志,2016,31(1):91-91.
[11] 潘宏偉,鄭昭芬,張宇,等.急診IABP循環支持脫機時間對AMI并泵衰竭患者心功能的影響[J].臨床誤診誤治,2016,29(6):40-43.
[12] 劉海霞.體外膜肺氧合聯合主動脈內球囊反搏輔助治療心臟術后嚴重低心排綜合征[J].中國基層醫藥,2015,22(14):2132-2134.
[13] 胡紹娟,曲雪芹.聯合應用ECMO、IABP、CRRT成功救治危重心臟外科患者的臨床護理[J].護士進修雜志,2017,32(18):1687-1688.

