PTC及結節性甲狀腺腫病人血清中TSH和尿碘水平的相關性
(青島大學附屬醫院,山東 青島 266003 1 內分泌與代謝病科; 2 甲狀腺實驗室)
甲狀腺是人體最大的內分泌腺體,主要的功能是合成甲狀腺激素,調節機體的代謝。促甲狀腺素(TSH)是調節甲狀腺功能的主要激素,而碘則是甲狀腺發揮生物學功能所必需的微量元素。我國自1996年開始普遍實行食鹽碘化(USI)政策,用于防治碘缺乏病(IDD)后,地方性甲狀腺腫逐漸減少,但甲狀腺乳頭狀癌(PTC)、結節性甲狀腺腫的發病率卻逐年增加[1,2]。目前普遍認為,碘攝入量與甲狀腺疾病發生率呈U形關系,即碘攝入過高或過低都會導致甲狀腺疾病患病率的增加[3]。尿碘中位數(MUI)是最常用的反映人群碘營養狀況的指標[4]。流行病學研究顯示,高尿碘(UI)人群的血清TSH水平顯著高于尿碘正常人群[5-6]。高碘狀態下,甲狀腺可通過Wolff-Chaikoff效應,抑制過氧化物酶的活性,抑制碘化反應,從而減少T3、T4的釋放,反饋性導致TSH分泌增加[7]。而TSH不僅可直接促進甲狀腺激素的合成與釋放,也可以引起甲狀腺濾泡上皮增生,同時甲狀腺濃集碘的能力也受TSH的調節[8],TSH水平越高,濃集碘的能力越強。碘和TSH可協同作用使甲狀腺濾泡上皮細胞增生和形態變化[9]。在PTC和結節性甲狀腺腫這兩種不同的甲狀腺組織形態中,體內碘水平和TSH水平是否有所差別,仍未得到驗證。因此本研究分別對PTC、結節性甲狀腺腫中尿碘和血清中TSH水平及其相關性進行分析,旨在為臨床診斷、合理用碘提供相關依據。
1 對象與方法
1.1 研究對象
收集2016年8月—2017年3月在我院甲狀腺外科確診為PTC的病人514例(PTC組),男193例,女321例;年齡(46±13)歲。確診為結節性甲狀腺腫病人468例(結甲組),男163例,女305例;年齡(47±12)歲。兩組間性別和年齡比較差異無顯著性(P>0.05)。排除標準:①復發癌等非首次接受甲狀腺手術;②術前曾嚴格控碘或接受131I治療;③既往合并甲狀腺功能異常,目前接受優甲樂、賽治等影響甲狀腺功能的藥物治療;④半年內有胺碘酮或碘對比劑等含碘藥物服用史;⑤妊娠及產后1年的病人;⑥心、肝、腎等功能不全的病人;⑦有腫瘤家族史或既往史的病人。所有納入病例均經我院倫理委員會審批,簽署知情同意書。
1.2 檢測指標
1.2.1尿碘定量檢測 兩組病人均于6:00~8:00收集空腹尿液10 mL,檢測前3 d禁食碘含量過高食品。使用尿碘定量檢測試劑盒(武漢眾生生化技術有限公司)進行尿碘檢測,使用Cobas6000全自動生化分析儀(羅氏公司,德國)測定試液的吸光度值,吸光度值與碘含量呈定量關系,采用標準曲線法計算尿碘濃度。
1.2.2血清TSH、三碘甲狀原氨酸(T3)、甲狀腺素(T4)、甲狀腺過氧化物酶(TPOAb)及甲狀腺球蛋白抗體(TGAb)檢測 所有受檢者均采集空腹靜脈血3 mL,用Advia Centaur XP全自動化學發光免疫分析儀(西門子公司,美國)及其配套試劑盒進行以上指標的檢測,步驟按照試劑盒說明書進行。
1.3 統計學方法

2 結 果
2.1 兩組病人尿碘和血清TSH水平等比較
兩組病人尿碘及血清TSH水平、T4、TPOAb、TGAb水平比較差異具有顯著意義(Z=-12.243~-5.045,P<0.05)。見表1。
將研究人群按照不同尿碘值(<100、100~200、201~300、>300 μg/L)進行分層,并分別統計了兩組病人在不同尿碘值的分布情況。PTC組各人群所占比例分別為7%、40%、27%、26%,而結甲組分別為2%、55%、30%、3%,兩組尿碘分布差異無顯著意義(P>0.05)。尿碘值高于200 μg/L時,PTC病人的TSH水平明顯高于結甲病人(Z=-3.373、-2.495,P<0.05)。見表2。

表1 兩組病人尿碘和血清TSH水平比較

表2 尿碘分層后兩組病人血清TSH水平比較(c/mU·L-1)
2.2 尿碘與血清TSH水平相關性研究
校正混雜因素后,對PTC組與結甲組的尿碘及TSH水平進行曲線擬合并做閾值分析(圖1,表3),尿碘值與TSH水平之間大致呈U形曲線關系。在PTC組,TSH水平隨尿碘濃度變化存在兩個轉折點,210、672 μg/L。當PTC病人尿碘值小于210 μg/L,隨著尿碘水平增高,TSH的水平隨之下降(β=-0.008,P<0.05);尿碘值在210~672 μg/L時,TSH水平隨尿碘值的增高而增高(β=0.003,P<0.05);但當尿碘值>672 μg/L時,尿碘對TSH水平的影響則不顯著(β=-0.004,P>0.05)。而在結甲組,尿碘值僅僅存在一個轉折點,397 μg/L,即當尿碘值小于397 μg/L時,TSH水平隨著尿碘值的增大而減小(β=-0.009,P<0.05),后隨著尿碘值的升高而升高(β=0.004,P<0.05)。
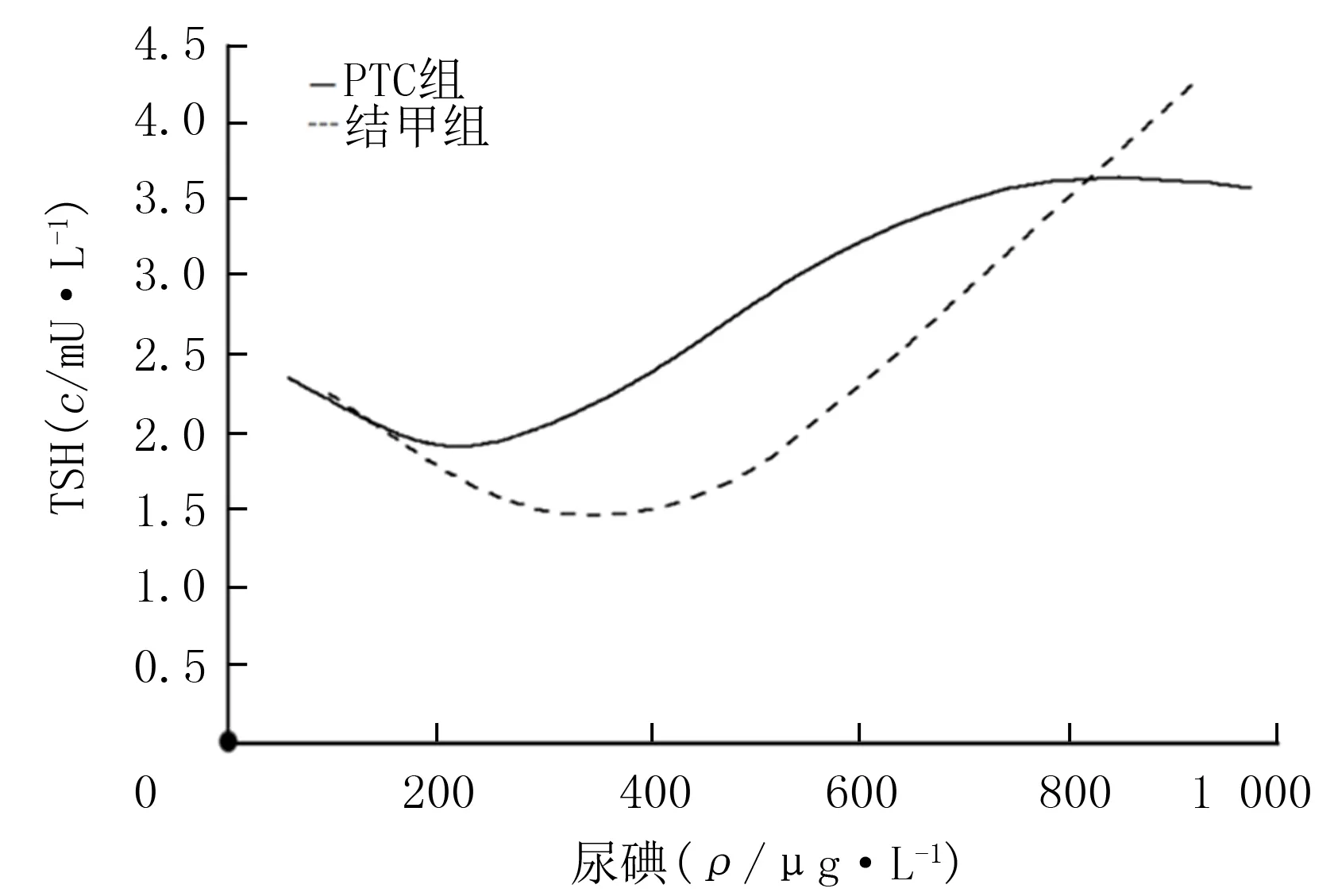
圖1 尿碘與血清TSH水平的相關性擬合曲線
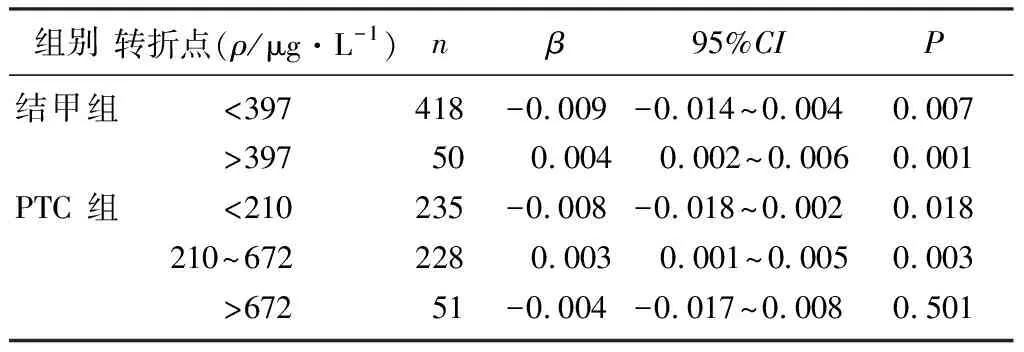
組別轉折點(ρ/μg·L-1)nβ95%CIP結甲組<397418-0.009-0.014~0.0040.007>39750 0.004 0.002~0.0060.001PTC組<210235-0.008 -0.018~0.0020.018210~672 228 0.003 0.001~0.0050.003>67251-0.004-0.017~0.0080.501
3 討 論
本研究結果顯示,PTC組的尿碘及TSH水平均高于結甲組。在分析這兩組的尿碘和TSH的相關性時,發現當尿碘<210 μg/L時,尿碘對TSH水平的影響在兩組中的表現是相似的,即TSH水平隨尿碘水平的增高而降低。因為甲狀腺內碘濃度低會導致甲狀腺合成T3、T4的能力下降,從而反饋性引起TSH分泌增多,隨著碘的富集,T3、T4濃度增高,從而反饋性抑制TSH的分泌[7]。但尿碘高于210 μg/L時,PTC病人的TSH水平隨尿碘水平的增高呈明顯增高的趨勢;而在結甲組,當尿碘值>397 μg/L,隨著尿碘值的增大TSH水平呈明顯增高趨勢。可見在PTC病人中,TSH水平對尿碘濃度的變化更加敏感。同時,本研究還顯示,在PTC病人中,當尿碘水平高于672 μg/L時,TSH水平隨尿碘變化不再顯著,分析其原因,一方面由于PTC細胞攝碘能力下降,尤其是BRAF(V600E)突變的PTC病人[10],因此在高碘狀態下可出現尿碘水平與TSH水平分離的現象。另一方面由于極高尿碘水平(尿碘值>500 μg/L)的病人納入例數過少,不排除結果存在誤差的可能。因此在PTC和結甲病人中,在高碘狀態(尿碘值>500 μg/L)下,TSH隨尿碘濃度的變化趨勢,仍需進一步擴大樣本量進行深入研究。
有研究結果顯示,給予正常人群飽和碘化鉀溶液(SSKI)后,受試者血清TSH的水平隨著給予的SSKI增加而增高,停止給予SSKI后,血清TSH恢復正常水平[11]。多數人在攝入高碘后,甲狀腺可通過自身調節形成耐受,并不會對甲狀腺的功能與形態產生較大影響,僅表現為血清T3、T4水平分別下降25%、15%,TSH上升2 mU/L以及甲狀腺體積稍微增大,但所有變化都在正常范圍內[11]。但長期低碘或高碘的狀態下,必然會對甲狀腺的功能和形態產生影響[12]。血清高TSH水平是促進甲狀腺組織增生增大的一個重要因素[13],在一些研究中發現血清TSH水平是判斷甲狀腺結節良惡性的一個重要指標[14],同時也是預測甲狀腺乳頭狀微小癌風險的指標[15]。
LI等[16]的研究結果顯示,高碘攝入的兒童群體血清TSH也明顯高于對照組。動物實驗研究顯示,給予大鼠高碘飲食后,甲狀腺可有明顯的濾泡增生,呈現TSH刺激征象[17]。這些研究表明高碘可通過刺激TSH水平的增高而促進甲狀腺上皮細胞的增生,導致細胞形態發生變化。流行病學研究表明,隨著加碘食鹽的普及,PTC的發病率也逐年增加[18-19]。研究顯示,PTC病人的尿碘值明顯高于結甲組和正常對照組,且全民補碘以來,PTC病人和結甲病人的尿碘中位數均已超過WHO推薦的碘適宜量[20]。碘營養過剩這一社會問題對甲狀腺疾病的影響越來越突出,但其相關機制仍未得到進一步闡明。
本研究進一步證實了PTC病人的尿碘明顯高于結甲病人這一觀點,并且發現在PTC病人中,血清TSH水平更高,且PTC病人血清TSH水平對尿碘水平的變化更為敏感。當PTC病人尿碘水平高于210 μg/L時,結甲病人尿碘水平高于397 μg/L時,應注意碘濃度所造成的TSH刺激征象。但不同病理狀態下碘對TSH的作用機制以及碘與TSH水平在不同病理狀態下的聯合作用機制仍需今后的研究進一步闡釋。
[參考文獻]
[1] 關海霞,滕衛平,單忠艷,等. 不同碘攝入量地區甲狀腺癌的流行病學研究[J]. 中華醫學雜志, 2001,81(8):457-458.
[2] 陸國超,李春雨,吳遠冰. 食鹽碘化對甲狀腺癌發病的影響[J]. 河北醫學, 2008,14(4):450-451.
[3] RASMUSSEN L B, OVESEN L, BULOW I, et al. Dietary iodine intake and urinary iodine excretion in a Danish population: effect of geography, supplements and food choice[J]. Br J Nutr, 2002,87(1):61-69.
[4] ZIMMERMANN M B, ANDERSSON M. Assessment of iodine nutrition in populations: Past, present, and future[J]. Nutr Rev, 2012,70(10):553-570.
[5] JEON M J, KIM W G, KWON H, et al. Excessive iodine intake and thyrotropin reference interval: Data from the Korean National Health and Nutrition Examination Survey[J]. Thyroid, 2017,27(7):967-972.
[6] 王微波,金迎,滕衛平,等. 不同碘攝入量地區正常人群血清TSH水平的流行病學對比研究[J]. 中華內分泌代謝雜志, 2002,18(5):355-356.
[7] ZBIGNIEW S. Role of iodine in metabolism[J]. Recent Pat Endocr Metab Immune Drug Discov, 2017,10(2):123-126.
[8] KLEINAU G, BIEBERMANN H. Constitutive activities in the thyrotropin receptor: Regulation and significance[J]. Adv Pharmacol, 2014,70(1):81-119.
[9] KOUKKOU E G, ROUPAS N D, MARKOU K B. Effect of excess iodine intake on thyroid on human health[J]. Minerva Med, 2017,108(2):136-146.
[10] FRASER S, GO C, ANISS A, et al. BRAF(V600E) Mutation is associated with decreased disease-free survival in papillary thyroid cancer[J]. World J Surg, 2016,40(7):1618-1624.
[11] RAMIREZ SOTO M C. Effects of potassium iodide in concentrations of TSH, tT3 and tT4 in serum of subjects with sporotrichosis[J]. Mycoses, 2014,57(8):460-465.
[12] ARRIZABALAGA J J, JALON M, ESPADA M, et al. Iodine nutrition status and prevalence of abnormal TSH levels in schoolchildren aged 6-7 years in the autonomous community of the Basque Country[J]. Endocrinol Diabetes Nutr, 2018,65(5):247-254.
[13] YUE W, WANG S, YU S, et al. Ultrasound-guided percutaneous microwave ablation of solitary T1N0M0 papillary thyroid microcarcinoma: Initial experience[J]. Int J Hyperthermia, 2014,30(2):150-157.
[14] 史良鳳. 術前血清TSH水平與甲狀腺結節良惡性關系的研究[D]. 沈陽:中國醫科大學, 2009.
[15] 張翊,李強,吳致委,等. TSH 水平與甲狀腺乳頭狀微小癌之間的關系探討[J]. 中華普外科手術學雜志(電子版), 2016(5):596-598.
[16] LI M, LIU D R, QU C Y, et al. Endemic goitre in central China caused by excessive iodine intake[J]. Lancet, 1987,2(8553):257-259.
[17] BURGI H. Iodine excess[J]. Best Pract Res Clin Endocrinol Metab, 2010,24(1):107-115.
[18] ZHU W, LIU X, HU X, et al. Investigation on the iodine nutritional status and the prevalence of thyroid carcinoma in Zhoushan Archipelago residents[J]. J Hygiene Res, 2012,41(1):79-82.
[19] KITAHARA C M, SOSA J A. The changing incidence of thyroid cancer[J]. Nat Rev Endocrinol, 2016,12(11):646-653.
[20] WANG F, WANG Y, WANG L, et al. Strong association of high urinary iodine with thyroid nodule and papillary thyroid cancer[J]. Tumour Biol, 2014,35(11):11375-11379.

