基于高覆蓋(磷酸化)蛋白質組對人胚胎干細胞干性維持調控網絡的解析
趙文娟,臧佳音,劉俊華,陳躍磊,丁小燕,楊冬,賀福初
1.軍事科學院 軍事醫學研究院 生命組學研究所,國家蛋白質科學中心·北京,北京蛋白質組研究中心,蛋白質組學國家重點實驗室,北京 102206;2.中國科學院 上海生命科學研究院 生物化學與細胞生物學研究所干細胞庫,上海 200031
胚胎干細胞(embryonicstemcells,ESC)作為一種多能干細胞,可以分化成多種譜系細胞[1]。通過轉錄組學、表觀遺傳學和功能研究,對ESC多能性和自我更新的分子機制已得到相對充分的認識[1-3],其中信號轉導和轉錄調控發揮著重要作用。已知信號轉導和轉錄調控與蛋白水平和翻譯后修飾水平直接相關,因此利用蛋白質組學(尤其是翻譯后修飾組學)數據進一步探索其機制具有重要的理論意義和潛在的應用價值。
蛋白質磷酸化修飾負責調控蛋白質功能、亞細胞定位和相互作用以及蛋白質穩定性,通過調控信號轉導[4]、基因表達[5]以及蛋白激酶驅動的信號網絡[6],影響細胞周期[7]、細胞增殖、分化、凋亡等重要生物學過程。ESC(磷酸化)蛋白質組的鑒定,對于全面認識ESC多能性和自我更新相關的核心調控網絡至關重要。然而,以前的研究由于技術水平的限制,并沒有得到較全的ESC(磷酸化)蛋白質組[8-11]。隨著磷酸化肽段富集技術及質譜技術的快速發展,蛋白質磷酸化修飾的質譜鑒定已向高精度、高靈敏度、快速掃描的方向不斷進步。在本研究中,基于目前最高水平的磷酸化肽段富集和高精度質譜鑒定技術,我們得到目前較大的H9細胞(磷酸化)蛋白質組數據集,并對多能性維持相關的調控網絡進行了解析。
1 材料與方法
1.1 材料
H9細胞由中國科學院上海生命科學研究院生物化學與細胞生物學研究所干細胞庫提供。尿素購自Millipore公司;乳酸、碘乙酰胺、乙腈、三氟醋酸購自Sigma公司;二氧化鈦購自GLScienc?es公司;胰蛋白酶購自Promega公司;蛋白酶和磷酸酶抑制劑Cocktail購自ThermoScientific公司;mTeSR1購自Stem Cell公司;基底膜基質膠(Matrigel)BD、30kD超濾管購自Millipore公司;細胞誘導因子活化素(activin)A及WNT3A購自R&D公司;RNA提取試劑盒購自QIAGEN公司;反轉錄PCR試劑盒購自ThermoScientific公司;SYBRGreenQ-PCR試劑購自Toyobo公司。
CO2細胞培養箱、離心機、高分辨率質譜儀(Orbitrap Fusion LumosTribrid)(ThermoFisher Scientific公司);高效液相色譜儀(AgelaTechnolo?gies公司);真空干燥機(Eppendorf公司)。
1.2 細胞培養及其分化潛能檢測
1.2.1 細胞培養 首先將H9ESC復蘇到無飼養層的培養板上,即培養在去除基質生長因子Matrigel包被的6孔培養板上,采用mTeSR1培養基,于37℃、5%CO2細胞培養箱中培養5d,之后傳代,繼續培養4d,待生長至80%匯合度時收集細胞。
1.2.2 細胞分化潛能檢測 傳代之后的細胞采用基礎培養基[DMEM/F12加入15%KnockOut血清替代物(KnockOutserumreplacement,KSR),添加1%非必需氨基酸(nonessentialamino acids,NEAA)、1mmol/LGlutaMAX和55mmol/L β-巰基乙醇]進行培養,隨后加入誘導因子100ng/mL活化素(activin)A和 50ng/mLWNT3A,培養至96h,每天更換培養基;期間每隔24h收集一次細胞。
1.3 免疫熒光檢測
將細胞種于24孔板的小玻片上,確保細胞貼附及延展,待細胞生長2~3d后,用1×PBS清洗細胞,4%多聚甲醛溶液室溫孵育固定細胞;用1×PBS清洗細胞,PBS-T室溫孵育5min;PBS-B室溫孵育1h封閉細胞,隨后進行一抗、二抗孵育;用Hoechst染色液進行細胞核染色處理,室溫孵育15min,用1×PBS清洗;滴加抗熒光淬滅封片液于載玻片上,蓋上貼有細胞的蓋玻片,盡量避免氣泡,使細胞接觸封片液,封片;用共聚焦熒光顯微鏡觀察。
1.4 實時定量PCR
RNA提取及反轉錄過程按照試劑使用說明操作。實時定量PCR程序為預變性95℃ 15 min;變性95℃ 15s,退火58℃ 20s(40次循環);72℃ 30s(40次循環)。每個樣本和基因均設置3個重復。
1.5 細胞收集
用DMEM/F12培養基清洗細胞,加入1mg/mL解離試劑,37℃放置7min;去除解離試劑,加入含蛋白酶和磷酸酶抑制劑的冰冷PBS吹打收集細胞,4℃、2000r/min離心5min,去除上清,保留沉淀。
1.6 蛋白提取及還原烷基化
細胞沉淀中加入含1×蛋白酶、磷酸酶抑制劑的8mol/L尿素進行細胞裂解,冰上放置30min,隨后冰上超聲波破碎,4℃、16000r/min離心5 min,棄沉淀和表層油脂,取上清液,用Brandford法測定蛋白濃度。取1.5mg蛋白加入DTT(終濃度為 10mmol/L),56℃水浴 30min,降至室溫加入1mol/L碘乙酰胺(現配現用),避光30min,再次加入1mol/LDTT,避光靜置15min,16000r/min離心10min,留取上清備用。
1.7 FASP酶解及肽段抽提
將蛋白上清液轉移到2個30kD超濾管進行蛋白裝填,14000r/min離心15min;加入8mol/L尿素,渦旋振蕩,14000r/min離心15min,棄廢液;加入50mmol/L碳酸氫銨,渦旋振蕩5~10 s,14000r/min離心 15min,棄廢液,除去殘留尿素;更換新的套管,加入50mmol/L碳酸氫銨、1 μg/μL胰酶(質量比為1/50),振蕩混勻,37℃消化12h;補充添加1 μg/μL的胰酶,振蕩混勻,37℃消化 4~6h,14000r/min離心 10min,收集肽段溶液;取1/10肽段溶液于新的離心管中用于全蛋白sRP-HPLC鑒定,剩余液體用0.1%甲酸酸化處理,之后所有肽段冷凍抽干,-80℃保存。
1.8 TiO2富集磷酸化肽段
凍干的肽段溶解在含1mol/L乳酸的70%乙腈、5%三氟醋酸溶液中,然后在旋轉儀上讓肽段在TiO2上完成吸附,依次用30%乙腈、0.5%三氟醋酸溶液,80%乙腈、0.5%三氟醋酸溶液洗滌3次,最后用15%氨水,0%、2%、5%、8%、10%、40%乙腈分別進行梯度洗脫各1次,合并為3個餾分并酸化,除鹽凍干,進行質譜鑒定[12]。
1.9 sRP-HPLC全蛋白酶切肽段分餾
用pH10的水(HPLC級)溶解肽段樣本,按洗脫緩沖液梯度從低到高依次洗脫,即6%、9%、12%、15%、18%、21%、25%、30%、35%乙腈,洗脫之后將6%與25%、9%與30%、12%與35%的洗脫液合并成6個餾分,之后所有肽段冷凍抽干進行質譜鑒定。
1.10 質譜鑒定及搜庫質控
1.10.1 質譜鑒定 將抽干的磷酸化肽段用10%甲酸重溶(全肽段用0.1%甲酸重溶),14000r/min離心10min,取上清進行質譜檢測。色譜分析柱填料為1.9μmC18粉末,C18反相柱內徑150 μm,長 15cm(Michrom Bioresources)。液相為EASY-nano-LC1200 與 OrbitrapFusionLumosTri?brid(ThermoFisherScientific)。流動相A為0.1%甲酸溶于水,流動相B為80%乙腈加0.1%甲酸,600nL/min流速,梯度 75min(0~16min,3%~10%B;16~51min,10% ~22%B;51~66min,22% ~30%B;66~67min,30%~95%B;67~75 min,95%B)。采用 OrbitrapFusionLumos質譜儀分析,在正離子模式下運行,離子傳輸管溫度為320°C,正離子噴霧電壓為2.0kV。一級和二級采集質量范圍分別是300~1400m/z,分辨率為120000,循環時間3s。在正常化的碰撞能量下進行HCD碎裂為35%。MS2自動增益控制(AGC)目標設置為 5e3,最大注射時間(MIT)為35ms,動態排除設置為18s。
1.10.2 搜庫和質控 用MaxQuant軟件(1.6.1.0版本)[13]對串聯質譜譜圖進行檢索和質控。數據庫為Swiss-Prot-Human(2017年11月更新),主要參數設置如下:一級質譜容差為20ppm,二級質譜容差為0.5Da,固定修飾為半胱氨酸烷基化(carbamidomethyl,C),可變修飾為 N 端乙酰化(acetylproteinN-term)、蛋氨酸(methionine)氧化(oxidation)及絲氨酸、蘇氨酸和酪氨酸的磷酸化修飾[phospho(STY)],允許的最大漏切數設置為2,肽段最小長度為7。采用正反混合庫搜庫策略,其中肽段假陽性率標準為FDR<0.01;采用無標定量法對蛋白進行定量分析。參照國際通用標準[14],將磷酸化位點 locationprobability≥0.75 定義為高可信度修飾位點(即class1磷酸化位點)。
1.11 生物信息學分析
1.11.1 功能富集分析 下載每個基因的GO(GeneOntology)的 BiologicalProcess注釋信息。利用基于超幾何分布模型的富集缺失分析方法,計算所關心的基因類別參與的生物學過程的富集/缺失P值,并基于Benjamini-Hochberg方法進行多重假設檢驗的校正。將富集缺失P值取對數,根據富集或缺失確定正負,富集為正,缺失為負。對得到的結果根據大小劃分等級,之后采用R語言中的“pheatmap”程序包進行熱圖繪制。
1.11.2 激酶及轉錄因子調控網絡分析 采用iGPS2.0[15]進行激酶預測分析;所得差異蛋白用信號網絡分析(IngenuityPathwayAnalysis,IPA)軟件進行轉錄因子與靶基因調控關系分析;運用Cytoscape繪制激酶與底物相互作用網絡圖。
2 結果
2.1 H9細胞狀態及其分化潛能鑒定
為了確定本實驗所采用的細胞處于干性狀態,且具有良好的分化潛能,我們首先利用免疫熒光和實時定量PCR實驗對多能性和中內胚層分化的標志分子狀態和分化潛能進行了檢測。結果發現,本研究所用的H9細胞中,多能性標志分子OCT4顯著高表達,而中內胚層分化的標志分子EOMES、內胚層分化標志分子SOX17處于不表達狀態。活化素A與WNT3A共同誘導24h后,多能性標志分子OCT4表達下降(圖1A),中內胚層標志分子EOMES表達,這說明分化24h形成中內胚層;繼續誘導分化至96h,OCT4及EOMES的表達量繼續降低,此時內胚層標志分子SOX17高表達(圖1A)。在轉錄水平通過實時定量PCR證實,隨著誘導分化的進行,OCT4在96h表達顯著降低(P<0.0001)(圖1B);中內胚層的標志分子EOMES在分化24h表達量升高200倍(P<0.01),96h該基因表達量持續升高(圖1C);對于內胚層的標志分子SOX17在分化24h有少量表達,96h時表達升高約80倍(圖1D)。綜上所述,本研究所用的H9細胞處于未分化的多能性狀態,且具備分化潛能。
2.2 H9細胞(磷酸化)蛋白質組鑒定結果
為了獲得高覆蓋的(磷酸化)蛋白質組,我們采用FASP酶切及TAFT(一種新的磷酸化肽段富集策略)[12]對H9細胞進行了3個重復的(磷酸化)蛋白質組鑒定(圖2)。
用Spearman對3次蛋白質組重復實驗結果進行相關性分析,結果顯示相關系數R2>0.9,P<2.2e-308(圖3A),說明3次生物學重復之間的相關性較好。對鑒定到的所有肽段的質量容差進行評估,結果顯示肽段信號值波動范圍符合正態分布,質量誤差范圍為(-5,5)之間(圖3B)。不同重復的蛋白Venn圖分析顯示,3次重復中均鑒定到的蛋白是6986種,其中磷酸化蛋白907種(圖3C、D)。

圖1 H9細胞多能性及分化的標志分子檢測
磷酸化蛋白質組3次重復實驗Spearman相關系數R2>0.8,P<2.2e-308(圖 4A)。對肽段的質量容差評估顯示肽段信號值波動范圍符合正態分布,質量誤差范圍為(-5,5)之間(圖4B)。Venn圖分析發現3次重復中均鑒定到的蛋白2628種,磷酸化蛋白2539種(圖4C、D)。3次重復實驗的磷酸化肽段富集效率均在95%以上(圖4E)。不同殘基上發生磷酸化修飾的百分比表明,絲氨酸(S)殘基上發生磷酸化修飾所占比例最大,為85.7%(圖4F),其次是蘇氨酸,由于酪氨酸的磷酸化修飾需要特殊的鑒定方式,因此在酪氨酸殘基的磷酸化修飾位點所占比例最少,僅為1.1%。
通過對磷酸化蛋白質組和非磷酸化蛋白質組的綜合分析,在hESC中共鑒定和定量8674種特異的蛋白質,包括3898種特異的磷酸化蛋白質和13676種特異的磷酸化肽段以及14584個磷酸化位點,其中11870個高可信度(class1,即lo?cationprobability≥0.75)磷酸化位點,該實驗在每個單個樣品中鑒定了超過7900種特定的蛋白質(圖5A)。為了進一步評估hESC的(磷酸化)蛋白質組鑒定的覆蓋范圍,與Swiss-Prot數據庫(2017年11月更新)和Singec等[16]發表的現有結果進行了全面比較。與數據庫中已知的磷酸化蛋白和磷酸化位點相比,本研究新鑒定了511種磷酸化蛋白(圖5B)和6272個磷酸化位點(圖5C),這些均未包括在Swiss-Prot數據庫中。在數據庫中下載Singec研究的原始數據,并采用本研究使用的軟件和參數進行重新搜庫和質控。與Singec等發表的H9(磷酸化)蛋白質組數據集相比,我們鑒定了更多的(磷酸化)蛋白質。本研究鑒定到的(磷酸化)蛋白,磷酸肽段以及class1磷酸化位點的數量比Singec等發表的數據多1.3~3.3倍。其中僅在我們的研究中鑒定到的蛋白質數目為2743種(包括2247個磷酸化蛋白)(圖5D、E),11 314磷酸化肽段和10025個Ⅰ型磷酸化位點(圖5F、G)。因此,本研究獲得高度覆蓋的H9hESC(磷酸化)蛋白質組數據集,為干細胞干性維持機制研究提供了有價值的數據資源。

圖2 H9細胞(磷酸化)蛋白質組學流程圖
2.3 H9細胞中干性標志分子的鑒定情況
從蛋白質組學的角度檢測未分化H9細胞中多能性標志分子的表達情況,結果如表1。多能性分子 OCT4(POU5F1)、SOX2、NANOG、DPPA4、UTF1等在蛋白水平均有表達,但各胚層分化的標志分子并未檢測到,如中內胚層的EOMES[17]、T[18],中胚層的標志分子GATA4[19]、HAND1[20],內胚層的標志分子SOX17[21]、FOXA2[22]以及外胚層的標志分子PAX6[23]等。從蛋白鑒定結果來看,本研究所用的H9細胞確實處于未分化狀態。同時發現這些標志胚胎干細胞多能性的分子如DPPA4、SOX2及UTF1均發生了磷酸化修飾。DPPA4能夠在pT215和pS221發生磷酸化修飾,UTF1能夠在pS18、pS42和pS54發生磷酸化修飾。此外,在多能性分子中共鑒定到84個class1磷酸化修飾位點,其中38個未收錄在Swiss-Prot數據庫中。已有報道在hESC中表觀遺傳調節因子DNMT3A和DNMT3B表達豐度較高且能夠發生磷酸化[9,16],與3種多能性核心轉錄因子OCT4、SOX2和NANOG之間存在密切的相互作用[24]。總之,本研究預測到發生磷酸化修飾的多能性因子的潛在調控激酶,對H9中自我更新和多能性維持的轉錄因子及其靶基因之間的調控關系有了新的認識。

圖3 H9細胞全蛋白質組數據質控

圖4 H9細胞磷酸化蛋白質組數據質控
2.4 H9細胞中Ⅰ型磷酸化位點基序及激酶預測
利用本研究中鑒定到的高覆蓋的(磷酸化)蛋白質組數據集,使用MotifX對H9細胞中主要的線性激酶基序(Motif)及激酶(Kinase)進行了預測。以Swiss-Prot數據庫為背景,H9中鑒定到的11870個class1磷酸化位點中的9983個能夠富集到50個線性激酶基序,包括41個pS(occur?ance=85,P<10-6)序列基序和 9 個 pT(occurance=14,P<10-6)序列基序(圖6A,表2)。此外,還鑒定到14個未報道的線性激酶基序,如KXXXXXSP、SXXS、RXSP等(圖6B)。用iGPS2.0進一步分析這些線性激酶基序中受調控的激酶,結果發現41個pS序列基序和6個pT序列基序能夠被人激酶組中的251種激酶所調控,其中激酶在胚胎干細胞蛋白質組表達147個,包括屬于CDK、MAPK和STKR 激酶家族的 CDKs、Erks、BMPR2和 TGFbR1等(圖6A)。由脯氨酸/精氨酸或脯氨酸/賴氨酸(堿性氨基酸)介導的基序與包括CDKs、GSKs、MAPK等的CMGC組相對應;相反,由天冬氨酸或谷氨酸(酸性氨基酸)介導的基序對應于AUR和CK2激酶家族(圖6A)。
2.5 H9細胞中自我更新和多能性維持的核心調控網絡

圖5 H9細胞(磷酸化)蛋白質組鑒定結果(A)與數據庫(B、C)和已發表研究結果(D~G)的對比
為了進一步探究ESC自我更新和多能性維持的核心調控網絡,重點關注了已知與自我更新和多能性相關的13個調節因子,通過對激酶-底物關系和轉錄因子-靶基因調控網絡的分析,重構了這些調節因子的核心調控網絡。在該調控網絡中,TRIM28是具有最高連接度(40條邊)的蛋白,表明它具有多種功能。已有研究發現TRIM28作為Myc/Zfx的共調節因子,需要在未分化的ESC中維持基因的轉錄抑制狀態[25]。分析發現9種潛在的激酶可能參與調控hESC中TRIM28的磷酸化 ,包 括 STK25、PLK1、PKN1、PKM、MAPK7、CSNK1E、CCT2、ATRIP和ABL1。已有研究報道在hESC中表觀遺傳調節因子DNMT3A和DNMT3B表達豐度較高且能夠發生磷酸化[9,16],與3種多能性核心轉錄因子OCT4、SOX2和NANOG之間存在密切的相互作用[24](圖7)。總之,通過進一步預測到了發生磷酸化修飾的多能性因子的潛在調控激酶,對H9中自我更新和多能性維持的轉錄因子及其靶基因之間的調控關系有了新的認識。
2.6 H9細胞中磷酸化修飾水平與蛋白質豐度之間具有相同或不同趨勢的蛋白質功能特征比較分析
已知磷酸化修飾水平與其相應蛋白質豐度之間的定量值具有相同或不同的趨勢,推斷這些趨勢不一致的蛋白質在hESC自我更新和多能性維持中具有不同的功能特征。首先對肽段的磷酸化修飾水平和其相應的蛋白質豐度之間的相關性進行分析,發現兩者的定量值(磷酸化肽段Intensity值和相應蛋白質的iBAQ值)存在顯著但微弱的相關性(spearman相關系數=0.27,P=7.28e-178,圖8A),這說明磷酸化修飾水平確實與相應蛋白總體豐度水平存在較強的不一致性,深入分析二者的不一致性及其功能特征具有重要意義。根據磷酸化肽段Intensity值的百分位數(pR_Pho)和對應的蛋白質總量(pR_Pro)的iBAQ值百分位數的分布范圍,將“磷酸化肽段-蛋白質對”分成3類。第1類被定義為Pho>Pro:pR_PhopR_Pro>40%;第 2 類被定義為 Pho<Pro:pR_PropR_Pho>40%;第 3類被定義為 Pho≈Pro:|pR_PhopR_Pro|<=40%(圖8A)。對這3類“磷酸化肽段-蛋白質對”進行交疊分析,這些蛋白可以劃分為7類(圖8B)。對5個主要類別的蛋白質進一步進行功能分析。已有研究表明大多數生物學過程大致可分為“物質流”范疇和“信息流”范疇[26],“物質流”范疇的蛋白質在物質轉換和運輸中起作用,“信息流”范疇的蛋白質在信息調控和轉導中發揮作用。在hESC中,發現蛋白豐度低但磷酸化修飾水平高的蛋白質(Pho>Pro)在生物學功能上顯著傾向于參與蛋白質翻譯后修飾和代謝過程調控等“信息流”生物學過程(圖8C),在通路方面則顯著富集突觸小泡周期,軸突導向和Hip?po信號通路(圖8D)。而高豐度但低磷酸化修飾水平的蛋白質(Pho<Pro)則傾向于參與翻譯或運輸等生物學過程(“物質流”范疇)(圖8C),在通路方面則主要富集了脂肪酸降解、蛋白酶體和RNA轉運等通路(圖 8D)。“Pho≈Pro”類蛋白質則更傾向于參與“信息流”范疇的生物學過程,包括蛋白質翻譯后修飾、免疫反應和細胞通訊,以及信號轉導、Rap1/鈣信號通路和內吞作用通路(圖8C、D)。

表1 H9細胞干性標志分子的鑒定

表1 H9細胞干性標志分子的鑒定(續)
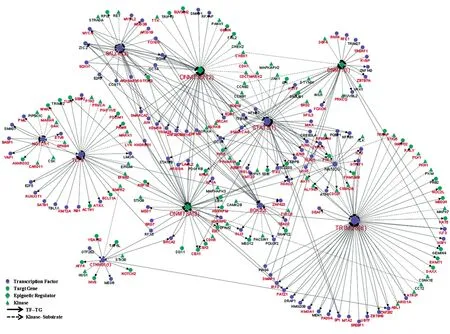
圖7 hESC已知多能性因子激酶與底物及轉錄因子與靶基因的調控網絡分析
表2列出了3種類別中涉及到的多能性相關蛋白質的功能和信號通路,這些結果表明,蛋白豐度和特定磷酸化水平顯著不同的蛋白質具有不同的生物學功能類型。值得注意的是,與干性維護相關的已知監管機構分布在3個不同類別中。例如,胚胎干細胞多能性轉錄調控網絡SALL4/OCT4成員SALL3[20]和人胚胎干細胞多能性基本調節因子 FOXO1屬于“Pho>Pro”類別,表明這2種轉錄因子在特定殘基上發生更高的磷酸化修飾以滿足其調節功能。LIN28A[25-26]和TRIM28[27]作為ESC中控制自我更新的調節因子,屬于“Pho<Pro”類別。LIN28A是一種翻譯增強子,可將特定的mRNA驅動到核糖體上并提高蛋白質合成的效率,這是“物質流范疇”的過程。TRIM28(也被稱為KAP-1)是一種轉錄中介因子,作為各種轉錄因子,特別是含有KRAB的鋅指蛋白和核小體重塑復合物的支架。由于TRIM28的多功能性,它傾向于高表達。另一方面,由于它只是一個腳手架,因此并不需要很高的磷酸化修飾水平。轉錄因子SOX2是多能性核心調控網絡[5,28-29]的成員,CTNNB1是經典Wnt信號通路的關鍵下游成分[30],屬于“Pho≈Pro”類。這些因子的蛋白質豐度和磷酸化水平往往相對較高。這種現象表明其蛋白量和磷酸化水平的對其發揮功能具有同等的重要性。不同干性分子在這3類中均有分布,這表明胚胎干細胞在維持自我更新和多能性過程中對于不同的蛋白豐度及其修飾水平具有不同的需求。
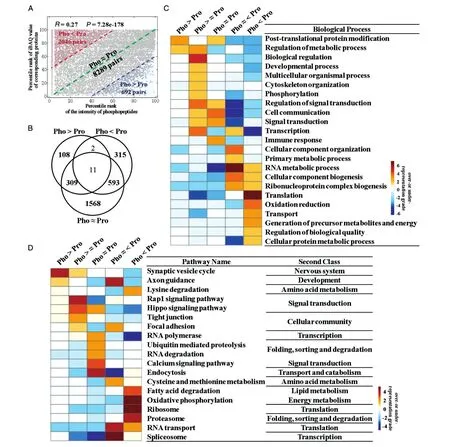
圖8 H9細胞中相同或不同磷酸化修飾水平與相應蛋白豐度之間的功能特征及信號通路比較分析
3 討論
我們采用最新的磷酸肽富集和高精度質譜鑒定技術,得到了目前覆蓋度較高的H9細胞(磷酸化)蛋白質組學數據。同已有的胚胎干細胞蛋白質組和磷酸化蛋白質組數據相比,本研究鑒定到更多磷酸化蛋白及高可信磷酸化位點,為胚胎干細胞的(磷酸化)蛋白質組學研究提供了資源。基于此數據集的深入分析,得到了hESC中富集的磷酸化修飾基序及相應的激酶,發現了與hESC自我更新和多能性相關調控因子的新的磷酸化修飾位點及其相應激酶,結合其對靶基因的調控信息,構建了ESC干性維持相關的核心調控網絡。同時還發現磷酸化修飾水平和蛋白總量水平不一致提示其不同的功能特征。本研究發現的重要蛋白質新的磷酸化修飾的具體功能還有待深入探究。本研究提供的數據資源和分析思路為深入解析胚胎干細胞多能性和自我更新的機制具有重要意義,結合其他組學數據再進行深入的整合分析,有望更加全面地認識胚胎干細胞多能性維持的分子機制,為更好地利用胚胎干細胞進行生物醫學基礎和應用研究打下基礎。

表2 舉例3種分類列別中多能性轉錄因子的基本信息

