模擬空間環境下低剪切力對肺炎克雷伯氏菌Ⅲ型菌毛表達調控機制的初步研究
李文亮,王海立,高肖芳,楊瑞馥,倪斌,韓延平
1.江蘇大學 醫學院,江蘇 鎮江 212013;2.軍事科學院 軍事醫學研究院 微生物流行病研究所,北京 100071;3.軍委裝備發展部 原亞運村門診部,北京 100012
隨著航天科技的迅猛發展,人類活動進入地外空間的同時,微生物也伴隨各種航天器及人體自身進入太空,空間微生物學研究隨之興起。美國和俄羅斯等國家已經開展了一系列空間微生物的研究,而我國在該領域尚處于起步階段。但隨著我國航天飛行時間的不斷延長,在相對封閉狹小的航天器內,航天員的感染風險逐漸升高[1],于是空間微生物學的研究越來越受到國家的重視。有研究表明,地外空間中特殊的環境使得微生物在進入太空后會發生一系列生理改變,包括一些致病因子及毒力、生物膜等。地外空間中的哪些因素會導致此種改變?地外空間存在真空、微重力、宇宙輻射、極端溫度等極端生存條件,但是借助于航天器的保護,航天活動中微生物的生理活動主要受微重力影響。目前,多項研究結果表明微重力條件下細菌生物被膜的形成能力增強。最初,McLean等[2]發現銅綠假單胞菌在微重力條件下可以形成生物被膜,Crabbé等[3]也觀察到模擬微重力環境中銅綠假單胞菌形成的生物被膜樣結構。隨后,越來越多的細菌被發現可以形成生物被膜,其中包括肺炎克雷伯菌。
航天員體內及航天器內部環境中曾檢出多種致病菌及機會性致病菌,包括大腸桿菌、銅綠假單胞菌、肺炎克雷伯菌、流感嗜血桿菌、金黃色葡萄球菌、鏈球菌等[4]。本研究中的肺炎克雷伯菌ATCCBAA-1705株是腸桿菌科克雷伯菌屬的一種革蘭陰性桿菌,在自然界中廣泛存在,屬于機會性致病菌,且耐藥嚴重,為多重耐藥菌[5-7]。肺炎克雷伯菌1705株經搭載神舟十號飛船后,原本短桿狀、散在分布的菌體中出現鏈狀排列的現象。本實驗室使用美國NASA研制的旋轉培養系統模擬微重力(simulatedmicrogravity,SMG)[8-9]也發現了這種現象,并分離出不同的亞群菌株,即短桿狀的M1亞群和鏈狀排列的M2亞群[10]。在研究生物膜形成特性的過程中,發現了2個有意思的現象。第一個現象是在SMG(低剪切力)條件下,分離到的亞群M1、M2在搖床培養時其生物膜形成能力存在差異[10];第二個現象是在SMG環境中連續傳代培養后,肺炎克雷伯菌亞群菌株Ⅲ型菌毛表達能力增強[11-12],這引起了我們的關注。通過文獻調研發現,肺炎克雷伯菌生物膜的形成與其Ⅲ型菌毛密切相關[13],而SMG具有懸浮、低剪切力的特點[8-9,14],于是我們推測,不同剪切力可能使得Ⅲ型菌毛表達出現差異。
本研究中除了使用SMG系統,還用不同轉速的搖床共同組成了不同的剪切力梯度,即0(靜置)、SMG、50、100、200r/min共5種不同的剪切力,剪切力依次增高。通過不同剪切力條件下的培養及實驗,觀察Ⅲ型菌毛的表達差異,并對這種差異背后可能的分子機制進行研究。
1 材料與方法
1.1 材料
肺炎克雷伯菌ATCCBAA-1705株M1亞群(簡稱肺炎克雷伯菌,本試驗室分離保存);酵母ATCC26603(本實驗室保存);LB營養肉湯(Oxoid公司);氨芐青霉素(MPBiomedicals公司);甘露糖(國藥集團化學試劑有限公司);NH4Ac;HAc(北京欣經科生物技術有限公司);PureLink RNAMini試劑盒、DNA-free試劑盒、SuperscriptⅢ逆轉錄酶(Invitrogen公司);SYBRGreenRealt?mePCRMasterMix(Toyobo公司);熒光定量PCR儀及配套的PCR連體管(Roche公司);旋轉細胞培養系統(RCCS)及高截面比容器(HARV)(Syn?thecon公司);恒溫振蕩培養箱(北京六一儀器廠);Nanodrop核酸濃度測定儀、SpeedVac抽干儀(ThermoFisherscientific公司);透射電鏡(日立公司);超高效液相三重四極桿質譜聯用儀(島津公司)。
1.2 細菌培養
取肺炎克雷伯菌甘油種25μL接種于含5 mLLB液體培養基的大試管中,并加入5μL氨芐青霉素(100mg/mL),于37℃搖床中活化過夜,按 1∶200接種到液體培養基中,在 SMG、0、50、100、200r/min這5組不同剪切力條件下培養至相同生長周期。
1.3 生長曲線
取肺炎克雷伯菌甘油種25μL接種于含5 mLLB液體培養基的大試管中,并加入5μL氨芐青霉素(100mg/mL),于37℃搖床中活化過夜;取12個錐形瓶,各裝入18mLLB培養基,編號0-1、0-2、0-3、50-1、50-2、50-3、100-1、100-2、100-3、200-1、200-2、200-3;取 3個 HARV 培養皿,注滿LB培養基,編號M-1、M-2、M-3;準備EP管,每管加入25μL甲醛,標號0-1-2h、0-1-4h、0-1-6h、0-1-8h等,其余各組按相同方式進行標號。將活化的肺炎克雷伯菌按1∶200接種于錐形瓶中,37℃培養,每1~2h取菌液250 μL加入含甲醛的EP管中(甲醛終濃度約為10%),立即混勻,測定菌液D600nm值并記錄。
1.4 甘露糖抑制的凝集試驗
甘露糖抑制的酵母凝集試驗是針對肺炎克雷伯菌M1亞群Ⅲ型菌毛設計的特異性試驗[15]。用PBS將培養至相同生長周期的各組肺炎克雷伯菌洗滌3次后重懸,將各組調節到相同的D600nm值,每組分別取菌液100μL滴加于6孔板板蓋上,再先后向2組菌液中加入50μL5%的D-甘露糖溶液及50μL1%酵母細胞,用槍頭混勻;將此6孔板板蓋置于定軌振蕩器上低速搖動,3~5 min后觀察各組的凝集情況。對菌液進行倍比稀釋后,采用相同方法進行試驗,觀察凝集情況,確定凝集效價。
1.5 透射電鏡觀察
用PBS將培養至相同生長周期的各組肺炎克雷伯菌洗滌3次后重懸,與6%的戊二醛溶液1∶1混合;取混合后的菌液10μL滴在銅網上,后續用鉬銨酸、乙銨酸1∶1混合液進行負染,染色3.5 min后放置過夜,待銅網完全干燥后用透射電鏡觀察樣品。
1.6 qRT-PCR
將 SMG、0、50、100、200r/min共 5組肺炎克雷伯菌培養至相同生長周期,用RNA提取試劑盒分別提取各組的總RNA,在消化掉各組總RNA中殘留的基因組DNA后進行逆轉錄反應,得到相應的cDNA。
設計引物長度為18~24bp,產物長度為100~150bp。選取肺炎克雷伯菌16SrRNA為內參基因,對mrk基因及GGDEF基因進行qRT-PCR實驗及結果分析,比較不同剪切力環境下肺炎克雷伯菌M1亞群目的基因的表達差異。引物見表1。
1.7 轉錄組測序
將各組肺炎克雷伯菌培養至相同生長周期,用RNA提取試劑盒分別提取SMG、50、200r/min這3組的總RNA,通過北京諾禾致源科技有限公司的HiSeq平臺進行三代測序,測序深度為100×。將3組兩兩組合后進行差異分析,即SMG vs200r/min,50r/minvs200r/min,SMGvs50 r/min,并設定2組間差異表達閾值為比值大于2倍或小于0.5倍。在整體上對差異表達基因進行KEGG分析,確定其所屬代謝通路,在局部對Ⅲ型菌毛相關的mrk基因及c-di-GMP表達相關的GGDEF基因表達情況進行分析。

表1 引物及序列
1.8 c-di-GMP提取檢測
用PBS將培養至相同生長周期的5組肺炎克雷伯菌各洗滌3次后重懸,并將各組調節到相同的D600nm值。在各組中加入由甲醇∶乙腈∶水(2∶2∶1)配置的裂解液,冰浴15min后立即放入95℃的水浴鍋中孵育10min,室溫放置10min冷卻,4℃下最大轉速離心10min,取上清。余下的菌體沉淀中加入200μL裂解液,重復上述提取過程2次,將收取的上清合并,用SpeedVac抽干儀抽干。
在測定c-di-GMP之前,加入200μLEluent A(10mmol/LNH4Ac+0.1%HAc),振蕩至充分溶解,4℃下最大轉速離心10min,取上清,用0.22 μm超濾膜過濾,采用超高效液相三重四極桿質譜聯用儀檢測。
2 結果
2.1 生長曲線
通過觀察生長曲線可知,SMG、0r/min組24 h左右到達對數后期,50r/min組18h左右到達對數后期,100、200r/min組14h左右到達對數后期。本試驗選取對數后期的菌為研究對象,即100、200r/min組的肺炎克雷伯菌培養14h,50r/min組培養 18h,SMG、0r/min組培養 24h。生長曲線如圖1。
2.2 Ⅲ型菌毛相關的表型試驗
甘露糖抑制的酵母凝集試驗中,低剪切力的SMG、0、50r/min組凝集量多,而高剪切力的100、200r/min組凝集量相對少。200r/min組的凝集量比100r/min組少,且在5組中凝集量最少(圖2)。隨后,SMG、0、50、100、200r/min各組經 1∶5梯度稀釋后分別進行凝集試驗,以觀察到凝集的最大稀釋率為其凝集效價,各組凝集效價以5為底取對數后的平均值依次為6.67、5.67、5.67、4、2.67,數據經ANOVA分析后具有統計學意義(P<0.05)(圖 3)。
電鏡觀察發現,低剪切力SMG、0、50r/min條件下培養的肺炎克雷伯菌可觀察到的Ⅲ型菌毛多,而高剪切力100、200r/min組菌毛少(圖4)。
甘露糖抑制的酵母凝集試驗和電鏡觀察兩個表型試驗均表明,隨著剪切力的增加,Ⅲ型菌毛的表達減弱。
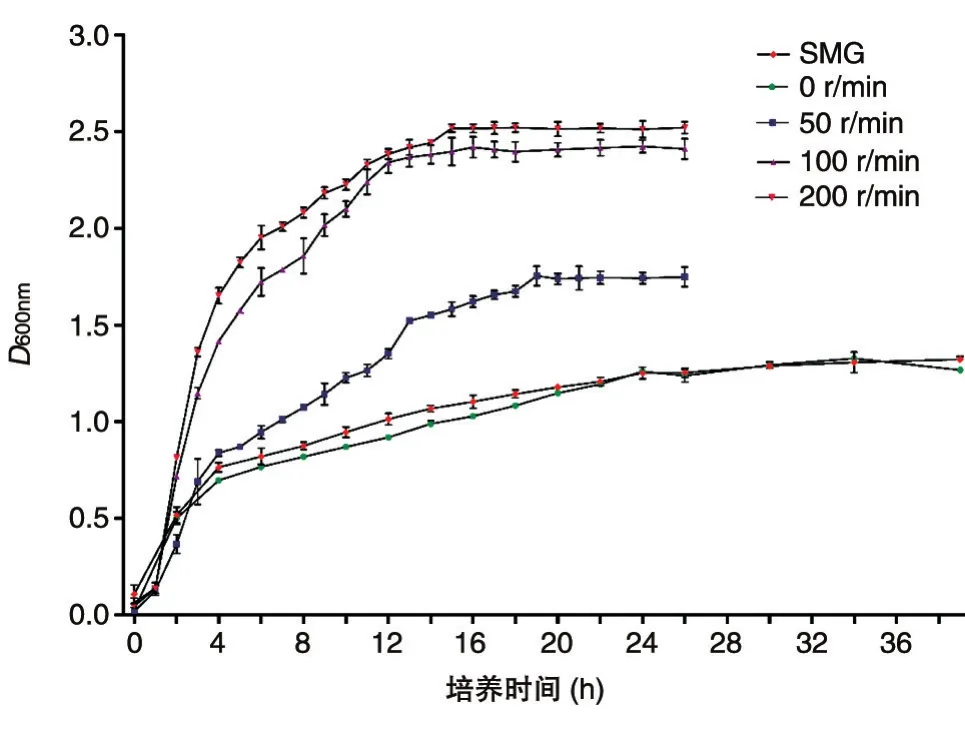
圖1 肺炎克雷伯菌M1亞群在不同剪切力下的生長狀況

圖2 甘露糖抑制的酵母凝集試驗
2.3 Ⅲ型菌毛相關表型實驗的驗證
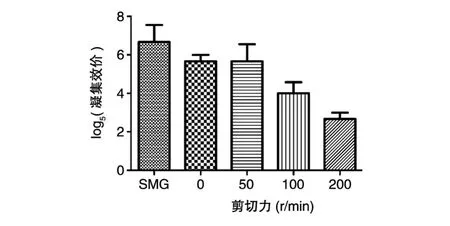
圖3 不同剪切力組肺炎克雷伯菌M1亞群菌株凝集效價
針對Ⅲ型菌毛的結構基因和相關調控基因,我們設計了熒光定量PCR及轉錄組測序分析。從qRT-PCR結果可以看出,與高剪切力的200r/min對比,低剪切力的SMG、0、50、100r/min組的mrkA、mrkD及mrkH表達明顯增強,且低剪切力的SMG、0、50r/min組表達值明顯強于高剪切力的100和200r/min組;SMG、50、100r/min組的mrkJ表達相對減弱;方差分析均滿足P<0.05,差異具有統計學意義(圖5)。從轉錄組測序結果分析,與高剪切力200r/min組相對比,50r/min、SMG組的mrkA、mrkB、mrkC、mrkD、mrkE、mrkF、mrkH、mrkI、mrkJ表達均升高,而SMG組與50r/min組相比,mrk基因的表達并無差異(表2)。
2.4 Ⅲ型菌毛表達與剪切力之間可能的分子機制探究

圖4 不同剪切力組肺炎克雷伯菌M1亞群菌株電鏡觀察

圖5 Ⅲ型菌毛相關基因qRT-PCR試驗
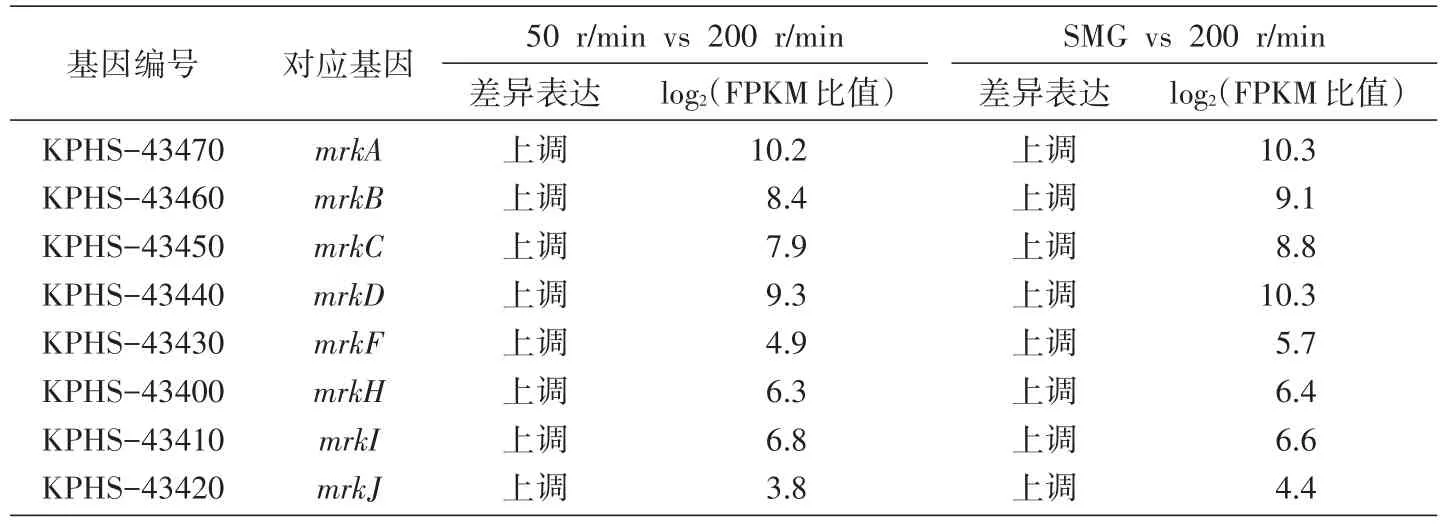
表2 Ⅲ型菌毛相關基因轉錄組測序分析
2.4.1 第二信使c-di-GMP表達水平檢測 SMG、50、200r/min組c-di-GMP的平均表達水平分別為 27.15、56.3 和 84.1ng/mL。經 One-wayanaly?sisofvariance分析,P<0.0001,隨著剪切力的升高,c-di-GMP的表達水平逐步升高(圖6)。
2.4.2 c-di-GMP相關GGDEF基因表達 在基因組完成圖中找到18個與c-di-GMP表達相關的基因,由于編碼含GGDEF基序的蛋白,故稱為GGDEF基因。在得到轉錄組測序結果后,將此18個基因與之相對照,發現了17個可以匹配的基因,其中8個基因的表達隨著剪切力的降低而顯著 上 調 ,即 KPHS-06770、KPHS-17760、KPHS-27460、KPHS-29590、KPHS-38170、KPHS-39010、KPHS-39950 和 KPHS-47910(表 3)。

圖6 c-di-GMP檢測結果
在上述分析基礎上,根據17個GGDEF基因設計了qRT-PCR試驗。與轉錄組測序分析中發現的8個表達差異較大的基因相對比發現,隨著剪切力的降低,其中7個基因在qRT-PCR試驗中也 顯 著 上 調 ,即 KPHS-06770、KPHS-17760、KPHS-29590、KPHS-38170、KPHS-39010、KPHS-39950和 KPHS-47910(圖 7)。
3 討論
為研究不同剪切力環境對肺炎克雷伯菌Ⅲ型菌毛表達的影響,我們以肺炎克雷伯菌ATCC BAA-1705株M1亞群為研究對象,在0、SMG、50、100、200r/min共5種不同剪切力條件下進行了甘露糖抑制的酵母凝集試驗和電鏡觀察表型試驗。在甘露糖抑制的酵母凝集試驗中,低剪切力的SMG、0、50r/min組凝集量多,而高剪切力的100、200r/min組凝集量相對少。在電鏡觀察實驗中,低剪切力SMG、0、50r/min條件下培養的肺炎克雷伯菌可觀察到的Ⅲ型菌毛多,而高剪切力100、200r/min組少。通過以上2個表型試驗可以發現,隨著剪切力的增高,肺炎克雷伯菌M1亞群Ⅲ型菌毛的表達降低,提示低剪切力可能促進肺炎克雷伯菌Ⅲ型菌毛的表達。
針對肺炎克雷伯菌M1亞群Ⅲ型菌毛結構基因及相關調控基因,設計了qRT-PCR和轉錄組測序分析。mrkA、mrkB、mrkC、mrkD、mrkE和mrkF為肺炎克雷伯菌Ⅲ型菌毛的結構基因,mrkH和mrkI為其正向調控基因,mrkJ為其負向調控基因[13]。從qRT-PCR結果可以看出,與高剪切力的200r/min對比,低剪切力的SMG、0、50、100r/min組的mrkA、mrkD及mrkH表達明顯增強,且有隨著剪切力增高,Ⅲ型菌毛相關基因表達減弱的趨勢。在轉錄組測序結果分析中,與高剪切力200r/min組相對比,低剪切力的SMG和50r/min組的mrkA、mrkB、mrkC、mrkD、mrkE、mrkF、mrkH、mrkI、mrkJ表達均升高,從正向驗證了低剪切力促進Ⅲ型菌毛表達的結論。SMG與50r/min組相對比,由于剪切力差異小,mrk基因的表達并無差異,此事實從反向驗證了低剪切力促進Ⅲ型菌毛表達的結論。雖然隨著剪切力的降低,負向調控基因mrkJ的表達也上調,但正向調節基因mrkH的上調更顯著,且結構基因均表達上調,所以,qRT-PCR試驗和轉錄組測序2種方法得到的結果具有較好的一致性,彼此共同驗證了低剪切力促進Ⅲ型菌毛表達的結論。
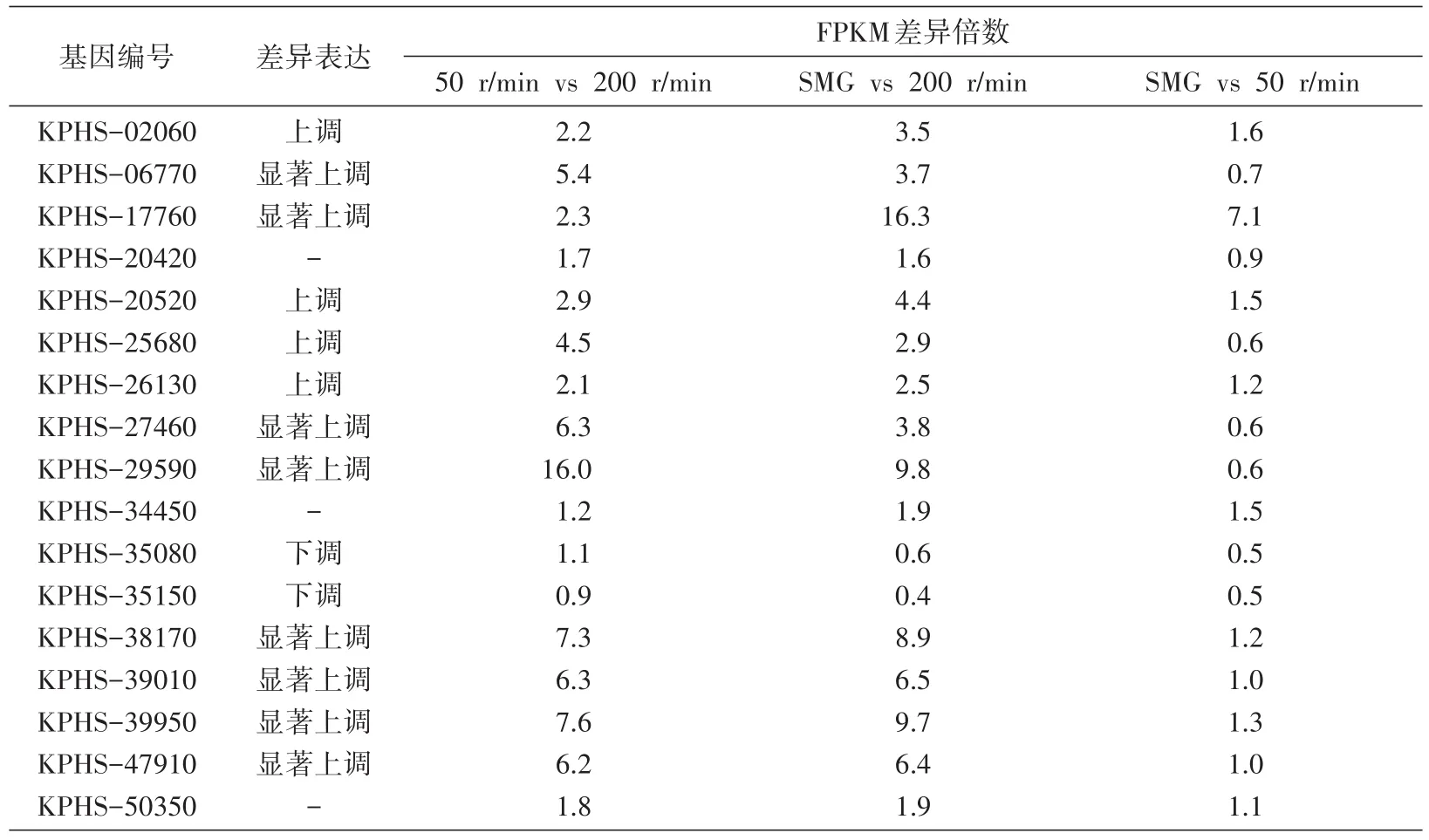
表3 17個GGDEF基因轉錄組測序結果分析
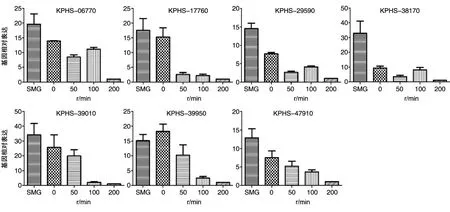
圖7 7個顯著上調GGDEF基因的qRT-PCR試驗
低剪切力可以促進Ⅲ型菌毛的表達,Ⅲ型菌毛的表達與胞內第二信使c-di-GMP的表達水平正相關[13],于是我們推測低剪切力組c-di-GMP的表達水平高。但是檢測結果表明,SMG、50、200 r/min組c-di-GMP的平均表達水平分別為27.15、56.3和84.1ng/mL,隨著剪切力的升高,c-di-GMP的表達水平逐步升高。這與預期觀點不符。文獻調研發現,c-di-GMP作為一種廣泛的第二信使,其整體表達水平受很多因素影響。c-di-GMP的表達水平對表型的控制分為整體控制和局部控制,有的表型受整體c-di-GMP濃度水平的控制,而有的表型則僅受局部c-di-GMP濃度水平的控制[16]。
通過進一步分析,我們在肺炎克雷伯菌1705株的基因組完成圖中找到了17個c-di-GMP表達相關基因,稱為GGDEF基因[16-17]。在得到轉錄組結果后,將此17個基因與轉錄組測序結果相比對,發現了8個差異表達較顯著的基因。隨后,根據此17個GGDEF基因設計了qRT-PCR試驗,與轉錄組測序分析中發現的8個表達差異較大的基因相對比,發現其中7個基因在qRT-PCR試驗中也顯著上調。于是我們推測有可能是這7個基因中的一個或多個基因表達上調,造成局部的c-di-GMP表達水平增高,從而促進肺炎克雷伯菌M1亞群Ⅲ型菌毛的表達。作為肺炎克雷伯菌的重要致病因子之一[18],Ⅲ型菌毛在空間低剪切力的條件下表達增加,這提示在航天環境中肺炎克雷伯菌的致病能力可能發生改變,從而潛在威脅航天員的健康。
參考文獻

