辣椒疫霉菌誘導辣椒酵母雙雜交cDNA文庫的構建及鑒定
王玉姣,陳姍姍,孫柏華,艾聰聰,王中洋,張修國
?
辣椒疫霉菌誘導辣椒酵母雙雜交cDNA文庫的構建及鑒定
王玉姣,陳姍姍,孫柏華,艾聰聰,王中洋,張修國*
山東農業大學植物保護學院;山東省蔬菜病蟲生物學省級重點實驗室, 山東 泰安 271018
辣椒疫霉菌()引起的辣椒疫病是在世界范圍內廣泛分布的毀滅性病害之一,對我國辣椒生產造成嚴重的經濟損失。為深入研究辣椒疫霉的致病機制,尋找辣椒疫霉在辣椒體內的互作蛋白,利用SMART同源重組交換技術,在酵母菌株Y187中構建了被辣椒疫霉侵染不同時期辣椒的cDNA文庫。文庫質量評定結果顯示cDNA文庫的滴度為1.13×106CFU/mL,文庫的庫容量為1.7×107CFU,文庫的重組率為96%,插入片段平均長度在1Kbp左右。該文庫的構建為研究辣椒疫霉的致病機制、辣椒的抗病機制及尋找藥物靶標位點奠定基礎。
辣椒疫霉菌; 辣椒; 酵母雙雜交; cDNA文庫
辣椒疫霉菌()引起的辣椒疫病是毀滅性土傳病害,短期內暴發成災[1],游動孢子主要侵染葉、果實和莖,引起軟腐、倒伏,可減產50%以上,對蔬菜產業造成嚴重的經濟損失。疫霉菌是一類營半活體營養的病原卵菌(Oomycetes)[2],能夠在侵染過程中外泌效應因子到植物細胞中破壞植物的防衛反應促進自身侵染定殖[3]。效應因子是一類具有操控寄主先天免疫反應,加強病原菌在寄主內感染的蛋白質分子[4]。隨著植物病原菌的深入研究,探索效應因子與寄主互作分子機制已經成為植物病理學家們研究的重要內容[4-6]。目前,越來越多的植物病原菌效應因子互作機制得到闡釋,寄主中的互作靶標可以是核酸[7],也可以是單一的蛋白質或蛋白質復合物[8]。然而,至今還未見到對辣椒疫霉效應因子致病機制的相關報道。
酵母雙雜系統是篩選互作蛋白最常用的方法[9],是利用酵母轉錄因子GAL4的特性來進行蛋白質相互作用分析的系統[10,11]。GAL4 DNA-BD(DNA結合域)與bait(誘餌)融合表達,GAL4 AD(轉錄激活域)與prey(獵物文庫)融合表達。Bait與prey之間的相互作用可以使GAL4重新具有轉錄活性,從而可以激活下游報告基因的表達。利用選擇培養基進行篩選即可獲得具有報告基因活性的克隆,從而分析蛋白質之間的相互作用[12]。
篩選辣椒疫霉效應因子的宿主靶標蛋白,研究該蛋白在病菌侵染過程中如何調控植物的防衛反應,可采用構建辣椒cDNA文庫篩選互作蛋白而實現。本研究采用SMART(Switching Mechanism at 5’End of the RNA Transcript)cDNA合成技術,通過同源重組方法構建了被辣椒疫霉侵染0 h、12 h、24 h、48 h、60 h及72 h的辣椒cDNA文庫,為篩選辣椒疫霉效應因子互作蛋白,深入研究效應因子與宿主互作分子機制奠定基礎。
1 材料與方法
1.1 材料來源
辣椒疫霉菌株SD33由本實驗室分離鑒定,辣椒為本實驗室種植的自交系06221,Make Your Own“Mate & PlateTM”Library System User Manual、cDNA文庫構建試劑盒及SD/-Leu營養選擇性培養基均購自Clontech公司,DH5α感受態細胞購自北京全式金生物技術有限公司。
1.2 文庫鑒定引物
根據pGADT7-Rec序列設計1對擴增文庫插入片段的鑒定引物。引物序列為:F:5′-TAATACGACTCACTATAGGGCGAGCGCCGCCATG-3′,R:5′-GTGAACTTGCGGGGTTTTTCA GTATCTACGATT-3′,引物由濟南鉑尚生物公司合成。
1.3 總RNA的提取
用液氮研磨被辣椒疫霉侵染0 h、12 h、24 h、48 h、60 h及72 h的辣椒葉片,采用Trizol法提取總RNA。用1% 的瓊脂糖凝膠電泳檢測提取的RNA質量。
1.4 cDNA文庫的構建
1.4.1 雙鏈cDNA的合成以5 μg總RNA為模版,以CDS Ⅲ(Oligo-dT)為引物,SMART MMLV Reverse Transcriptase反轉錄合成第一鏈cDNA;以第一鏈cDNA為模版,使用LD PCR(Long distance PCR)擴增合成dscDNA。利用CHROMA SPIN+TE-400 Columns分級分離純化雙鏈cDNA,在1.2%的瓊脂糖凝膠上對PCR產物進行分析。
1.4.2 Y187菌株感受態細胞的制備挑取活化的Y187單克隆菌落,在YPDA液體培養基中振蕩培養至OD600達到0.15~0.3;3800 rpm離心5 min,棄上清,加入100 mLYPDA重懸菌液并繼續培養至OD600達到0.4~0.5,3800 rpm離心5 min,棄上清,無菌水重懸菌體后再次離心棄上清;加入1.5 mL1.1×TE/LiAc溶液重懸菌體高速離心15 s,棄上清,使用600 μL1.1×TE/LiAc重懸菌體,即為感受態細胞。
1.4.3 文庫的構建和收集向500 μL Y187感受態中加入:6 μL pGADT7-Rec Cloning Vector,5 μg cDNA,3 μL SV40 Large-T PCR fragment (25 ng/μL),20 μL Herring Tests Carrier DNA,2.5 mL PEG/LiAc輕輕混勻;30 ℃孵育45 min,每15 min輕輕混勻1次;然后加入160 μL DMSO,42 ℃孵育20 min,每10 min混勻1次;3800 rpm離心5 min棄上清,加入3 mL YPD Plus重懸菌體,30 ℃振蕩培養90 min;相同條件再次離心收集菌體,用15 mL 0.9% NaCl重懸菌體。將菌液涂布在15 cm SD/-Leu選擇培養基上。每個板涂布150 μL菌液,30 ℃倒置培養3~4 d。文庫收集:每個平板使用3 mL凍存液刮洗,將所有菌液混勻于無菌錐形瓶。將文庫分裝10管于1.5 mL離心管每管1 mL,剩余菌液分裝于50 mL離心管,-80 ℃貯存。
1.4.4 文庫的質量鑒定取500 μL共轉化菌液按101到104稀釋,分別涂布在SD/-Leu 15 cm固體培養基上,每個梯度涂布3個平板,30 ℃,倒置培養3~4 d。對生長的單菌落計數,計算文庫轉化效率和文庫容量,文庫滴度=平板上菌落數×稀釋倍數/涂板體積。于SD/-Leu平板上隨機挑取50個克隆進行PCR鑒定,確定文庫的陽性率及插入片段大小的分布。
2 結果與分析
2.1 總 RNA的提取
提取被辣椒疫霉侵染不同時期的辣椒葉片總RNA,使用1%瓊脂糖凝膠檢測總RNA質量,如圖1所示,28S和18S rRNA條帶清晰,表明RNA完整性較好;經測定分析,A260/A280為1.98,濃度約為1.5 μg/μL,這表明RNA提取質量較好可用于下一步實驗。
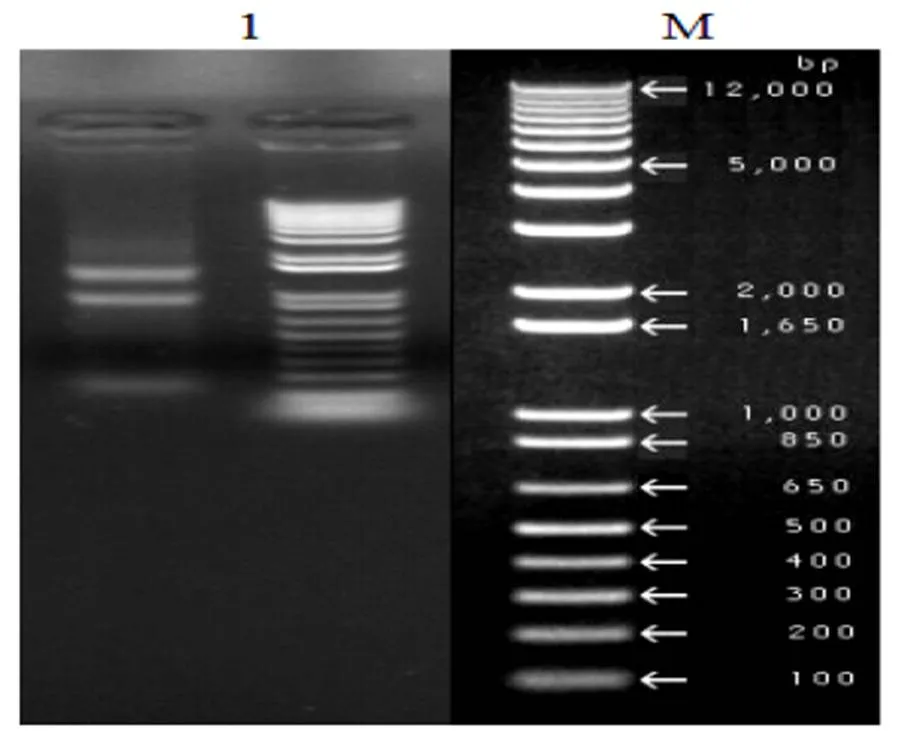
1:辣椒總RNA; M:DNA Marker DL12000
Fig.1 Detection of pepper total RNA by electrophoresis
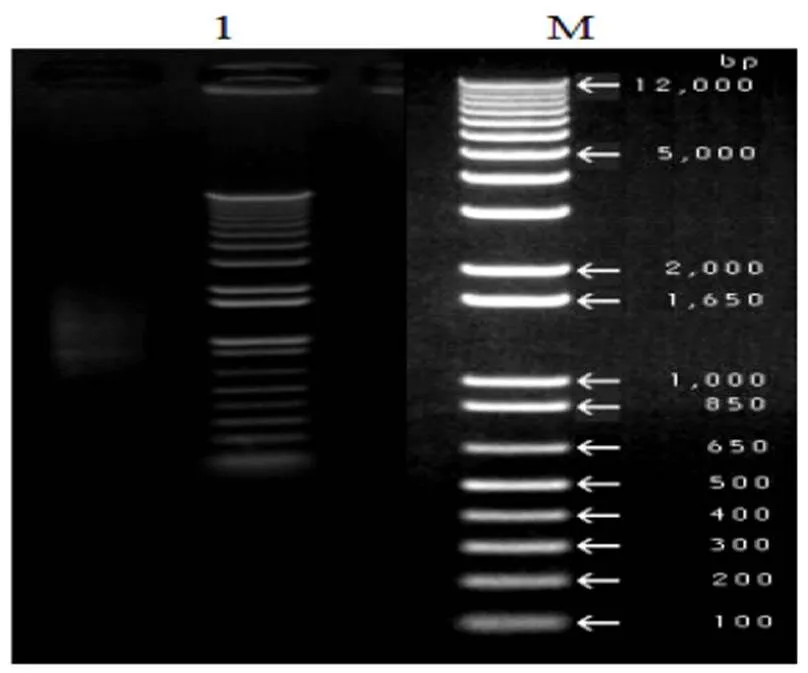
1: dscDNA; M:DNA Marker DL12000
2.2 雙鏈cDNA文庫的瓊脂糖凝膠電泳
以總RNA為模板,CDS Ⅲ為引物反轉錄合成第一鏈cDNA;以第一鏈cDNA為模板,使用LD PCR擴增合成 dscDNA,合成的dscDNA經1.2%瓊脂糖凝膠電泳檢測,如圖2所示,大小集中分布在600~2000 bp范圍內,且該區域有彌散狀條帶出現,表明雙鏈cDNA在該區域的分布較為完整,豐度較好。
2.3 酵母雙雜交cDNA文庫的構建和評價
Mate & Plate文庫構建是在酵母中進行的,借助生物體自身的同源重組功能將cDNA克隆到pGADT7-Rec中。首先,使用SMART cDNA合成技術合成含有與pGADT7-Rec載體末端同源的cDNA,然后,將cDNA和pGADT7-Rec轉入Y187中,然后在SD/–Leu固體培養基上培養3~5 d。最后將所有克隆收集并分裝成1 mL的文庫用于雙雜交篩選。
統計稀釋10、102倍、103倍和104倍后長出的單克隆數目,求平均值后計算文庫滴度,文庫滴度=每板平均克隆數/涂布體積×稀釋倍數(表1);總庫容量Total CFU (cfu) =平均滴度(cfu/mL)×cDNA library總體積(mL)。該文庫平均滴度為1.13×106CFU/mL,共計15 mL的轉化后原始菌液,則總庫容量為:1.13×15×106CFU=1.7×107CFU。從SD/-Leu平板上隨機挑25個克隆進行搖菌提質粒后進行PCR檢測,部分結果如圖3所示,顯示插入片段的大小集中在600~2000 bp之間,陽性菌落數為24個,重組率為96%。

表 1 文庫滴度

M: DNA Marker DL2000; 1-24: 插入片段PCR產物
3 討論
大量的研究表明,辣椒疫霉能夠在侵染過程中外泌效應因子進入植物細胞中破壞植物的防衛反應促進自身侵染定殖[13,14],效應因子通過與宿主靶標蛋白互作,調控植物的信號通路及代謝活動從而實現自己的功能。因此,為了更好的控制由辣椒疫霉引起的辣椒疫病,我們需要對效應分子的靶標蛋白以及效應分子的致病機制進行更加深入的了解。
對基因功能的研究離不開對基因所編碼蛋白的研究,蛋白質是基因功能的執行者和體現者,生命活動中大多數蛋白質需與其他蛋白結合才能發揮作用。目前,酵母雙雜交是研究蛋白質互作最廣泛的技術[10],具有篩選效率較高、可以檢測到一些微弱的蛋白質互作以及在酵母細胞內驗證互作而無需純化蛋白質等優點,成為當前互作蛋白篩選的主要方法[8]。
本研究利用SMART技術合成dscDNA建立酵母雙雜交文庫,無需對樣本總RNA中mRNA分離純化,有效避免了純化過程中mRNA的降解;重組cDNA片段集中在600-2000 bp之間,具有較好的多態性,滿足后續要求;利用同源重組方法,將外源dscDNA定向與pGADT7-Rec載體重組,避免了繁瑣的酶切連接等步驟和解決了低效率連接和克隆問題,從而保證了cDNA文庫的完整性。本研究以多達7個時間點的經辣椒疫霉誘導的辣椒葉片作為建庫材料,保證了文庫包含的抗病相關基因數量的最大化。本研究所在課題組前期已構建部分效應因子的誘餌載體,可使用本文庫進行效應因子互作蛋白篩選工作。雖然cDNA文庫中辣椒基因在各種信號轉導和代謝通路已有注釋,但其在辣椒體內的實際功能還有待發掘。因此,本研究構建的經辣椒疫霉SD33誘導的辣椒酵母雙雜交cDNA文庫,不僅有助于辣椒基因功能注釋,還將推動抗病基因的發掘和抗病機制的解析。
4 結論
本研究利用SMART技術構建了經辣椒疫霉SD33誘導的辣椒酵母雙雜交cDNA文庫。提取的總RNA條帶清晰,未發生降解,并且沒有蛋白質和其他小分子物質的污染;文庫容量為1.7×107,滴度為1.13×106cfu/mL,重組cDNA片段大小集中在600~2000 bp之間,重組率96%。該文庫質量較高,滿足下步互作蛋白篩選及致病機制分析。
[1] 楊楠,張麗,丁鵬,等.辣椒疫霉效應分子RxLR121504功能特性的研究[J].菌物學報,2017,36(9):1233-1242
[2] Ah Fong AM, Judelson HS. New role for Cdc14 phosphatase: localization to basal bodies in the oomyceteand its evolutionary coinheritance with eukaryotic flagella[J]. PLoS ONE, 2011,6:e16725
[3] Yu Du, Mohamed HM, Paul RJB,.RXLR effector AVR1 interacts with exocyst component Sec5 to manipulate plant immunity [J]. Plant Physiology, 2015, 1975-1990.
[4] Goritschnig S, Krasileva KV, Dahlbeck D,. Computational prediction and molecular characterization of an oomycete effector and the cognateresistance gene[J].PLoS Genet, 2012,8(2):el002502
[5] King SR, McLellan H, Boevink PC,RxLR effector PexRD2 interacts with host MAPKKKε to suppress plant immune signaling [J]. Plant Cell2014,26(3):1345-59
[6] 李金玥.植物病原菌效應因子的毒性功能研究進展[J].科教導刊,2016(4):25-27
[7] Diane GO, Susan B, Joe W,. Host protein BSL1 associates withRxLR effector Avr2 and theimmune receptor R2 to mediate disease resistance [J]. Plant Cell, 2012, 24:3420-3434
[8] Auerbach D, Stagljar I. Yeast two-hybrid protein-protein interaction networks [M]//Proteomics and protein-protein interactions:biology, chemistry, bioinformatics, and drug design. Singapore:Springer Science & Business Media, Inc, 2005:19-31
[9] 楊君,張艷,王偉巧,等.黃萎病菌誘導海島棉酵母雙雜交cDNA文庫構建及評價[J].生物技術通報,2014,29(12):105-110
[10] Bram S, Hélène T, Jan T,. Diversity in Genetic In Vivo Methods for Protein-Protein Interaction Studies: from the Yeast Two-Hybrid System to the Mammalian Split-Luciferase System Microbiol[J]. Mol. Biol. Rev. 2012,76:2331-382
[11] 趙慧,王遂,姜靜,等.酵母雙雜交篩選與小黑楊PsnWRKY70相互作用的蛋白質[J].北京林業大學學報,2016,38(2):44-51
[12] Oender K, Niedermayr P, Hintner H,. Relative quantitation of protein-protein interaction strength within the yeast two-hybrid system via fluorescence beta-galactosidase activity detection in a high-throughput and low-cost manner[J]. Assay and Drug Development Technologies, 2006,4(6):709-719
[13] Erbs G, Newman MA. The role of lipopolysaccharide and peptidoglycan, two glycosylated bacterial microbe-associated molecular patterns (MAMPs), in plant innate immunity[J].MolecuLar Plant Pathology, 2012,13(1):95-104
[14] Dou D, Kale SD, Wang X,. RXLR-mediated entry ofeffector Avr1b into soybean cell does not require pathogen-encoded machinery [J]. Plant Cell, 2008,20:1930-1947
Construction and Characterization of Yeast Two-Hybrid cDNA Library Derived fromInoculated with
WANG Yu-jiao,CHEN Shan-shan, SUN Bai-hua, AI Cong-cong, WANG Zhong-yang, ZHANG Xiu-guo*
271018,
is the casual agent ofPepper blight, which is one of the most destructive diseases that harms pepper industry around the world.Therefore, to study the pathogenic mechanism and screen proteins for, yeast two-hybrid cDNA libraries of pepper infected bywere constructed in yeast strain Y187 using homologous recombination-mediated SMART technology. The qualities of the cDNA libraries were evaluated as the followings: the titers were 1.13×106CFU/mL, the capacity of cDNA library was 1.7×107CFU/mL, the recombinant rate was 96%, and the protein average length encoded by the inserted cDNA is about 1Kbp. The construction of this library lays the foundation for studying the pathogenic mechanism of, the disease resistance mechanism of pepper and the search for drug target sites.
;; yeast two-hybrid; cDNA libraries
S436.418.1+2
A
1000-2324(2018)03-0379-04
2017-09-23
2017-10-23
國家大宗蔬菜產業技術體系(CARS-25-03B)
王玉姣(1990-),女,在讀碩士研究生,研究方向:植物病原卵菌分子遺傳學. E-mail:18354285903@163.com
Author for correspondence. E-mail:zhxg@sdau.edu.cn

