允許性高碳酸血癥通氣策略在嬰兒肺囊腺瘤術單肺通氣中的應用效果
李永樂,彭玲莉,袁超,漆冬梅,方琴,黃偉堅,胡祖榮,劉晶
(廣東省婦幼保健院,廣州510010)
允許性高碳酸血癥(PHC)是指患者接受機械通氣時,在氧合滿意的前提下,使用較小的潮氣量(Vt),允許患者血內CO2在一定范圍內的升高,從而避免機械相關的通氣損傷(VALI)。PHC作為一種保護性的通氣策略在急性呼吸衰竭(ARDS)中被廣泛應用[1,2]。嬰兒由于其肺容量小等生理發育特點,在實行單肺通氣(OLV)時與ARDS有諸多相似的地方,故有學者提出應把嬰兒OLV視為“特殊形式”的ARDS[3]。在我們過去的研究[4,5]中發現,在嬰兒OLV時采用傳統通氣策略,Vt往往過大,導致肺順應性較低,肺通氣換氣效率較低,而采用PHC通氣策略不但可進一步改善嬰兒的組織氧合,而且能起到更好的肺保護作用。本研究擬從肺部炎癥角度出發,初步探索PHC對嬰兒肺保護作用的可能機制,為臨床更合理地權衡使用PHC策略提供科學依據。
1 資料與方法
1.1 臨床資料 選擇廣東省婦幼保健院2016年5月~2017年5月擇期行胸腔鏡手術的肺囊腺瘤患兒64例,年齡49~351 d、體質量4.1~12.1 kg。入選標準:診斷肺囊腺瘤需行肺囊腺瘤切除術,ASA分級Ⅰ~Ⅱ級,無其他相關肺部疾病,且術前一般檢查無明顯異常。排除標準:血氧飽和度(SpO2)無法維持在90%以上或出現難以維持尖峰氣道壓(Ppeak)低于30 cmH2O;OLV時間小于1 h或手術時間超過3 h;術中出血量超過血容量20%;術中因手術需要轉開胸手術。本研究經廣東省婦幼保健院醫學倫理協會批準并與患兒家屬簽署知情同意書。采用隨機數字表法分成傳統通氣策略組(C組,n=32)和PHC通氣策略組(H組,n=32)。最終共59例患兒入選本研究。其中,C組更改手術方式患兒1例,術中Ppeak無法維持低于30 cmH2O患兒2例;H組OLV時無法維持SpO2>90%以上患兒1例,OLV時間短于1 h患兒1例。C組男15例、女14例;H組男16例、女14例。兩組基線資料有可比性。
1.2 手術方法 患兒入手術室后常規監護一般生命體征,行全身麻醉,快速靜脈誘導,充分給氧去氮后氣管內插管實行雙肺通氣,隨后行動脈穿刺置管。采用壓力控制通氣模式。通過調節Ppeak和呼吸頻率(RR)確定不同的Vt和每分鐘最大通氣量(MVV),以調整患兒呼吸末二氧化碳分壓(EtCO2)。術前使兩組EtCO2維持在正常水平(30~40 mmHg),吸入氧濃度(FiO2)為100%,以利于OLV時術側肺部萎陷。采用纖支鏡引導下支氣管氣管插管術至健側肺部以實施OLV。改變體位后,通過聽診和纖支鏡檢查再次確認導管位置。隨后于術側胸腔進行人工氣胸,維持壓力在5~8 mmHg,并行胸腔鏡下肺囊腺瘤切除術。術中使C組EtCO2維持在正常水平(30~40 mmHg),H組EtCO2維持在較高水平(50~70 mmHg)。除此以外,患兒術中均采取下列呼吸參數:吸呼比1∶1.5;新鮮期流量2 L/min;呼氣末正壓4~6 cmH2O;FiO2,初始設為50%,并視術中氧合情況調整。術中采用靜吸復合麻醉,持續吸入1.5%~3%七氟醚,并根據術中情況間斷給予順阿曲庫銨0.1 mg/kg,舒芬太尼0.3 μg/kg以維持麻醉深度。手術完成后,先將氣管導管移回主氣管實施雙肺通氣,隨后再將患兒送至麻醉復蘇室行麻醉復蘇。
1.3 觀察指標及其檢測方法 于患兒氣管插管后10 min(T1),人工氣胸后30 min(T2)和60 min(T3),以及術后30 min(T4)四個時間點觀察通氣情況[Ppeak、Vt、RR、MVV],行動脈血氣分析[pH值、PaO2、PaCO2、乳酸、氧合指數(OI)]。此外,術前和術后在通氣側肺行支氣管灌洗,并收集支氣管灌洗液(BALF)。利用公式計算OI,OI=PaO2/FiO2。采用ELISA法檢測BALF中IL-6和IL-8的表達水平。術后第2天行X線檢查,觀察并發癥發生情況。
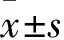
2 結果
2.1 兩組患兒圍術期情況及并發癥情況比較 C組OLV時間、手術時間、拔管時間、術后復蘇室(PACU)停留時間、失血量、尿量分別為(98.4±11.4)、(126.1±10.3)、(33.6±5.7)、(111.2±12.2)min,(1.2±0.20)mL/kg,(1.6±0.5)mL/(kg·h);H組分別為(94.4±9.5)、(121.2±13.8)、(35.7±6.4)、(116.0±11.8)min,(1.1±0.17)mL/kg,(1.5±0.4)mL/(kg·h)。兩組各指標比較,P均>0.05。術后第2天X線檢查示,C組出現胸腔積液2例,肺不張1例;H組出現胸腔積液1例,肺不張1例。兩組術后肺部并發癥發生率比較,P>0.05。
2.2 兩組通氣參數和動脈血氣分析結果比較 與T1相比,兩組患兒于T2和T3時PaO2和OI降低、Ppeak升高(P均<0.05),H組于T2和T3時Vt、MVV、pH值、乳酸水平較T1時降低,而PaCO2升高(P均<0.05)。與C組相比,H組于T2和T3時Ppeak、Vt、MVV、pH值以及乳酸水平均降低,PaCO2升高(P均<0.05)。見表1、2。
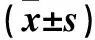
表1 兩組不同時間點通氣參數比較
注:與C組比較,#P<0.05;與同組T1比較,△P<0.05。
2.3 兩組BALF中IL-6和IL-8表達水平比較 C組術前、術后IL-6分別為(9.16±5.92)、(63.65±36.28)pg/mL,IL-8分別為(110.52±42.40)、(423.71±210.17)pg/mL,H組術前、術后IL-6分別為(11.42±6.75)和(45.62±24.99)pg/mL,IL-8分別為(122.78±51.86)和(320.60±156.32)pg/mL。兩組術前IL-6和IL-8表達水平比較,P均>0.05,兩組術后IL-6和IL-8較術前增高(P均<0.05)。與C組相比,H組IL-6和IL-8表達水平低(P均<0.05)。
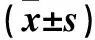
表2 兩組不同時間血氣分析指標比較
注:與C組比較,#P<0.05;與同組T1比較,△P<0.05。
3 討論
目前,PHC作為一種保護性的通氣策略在ARDS、哮喘、慢性阻塞性肺疾病、甚至危重早產兒等患者的機械通氣治療中均可起到積極作用[6]。合適的高碳酸血癥不但可以減輕肺內通氣血流比例的失衡,還可以引起肺表面物質分泌增多,改善肺的順應性,從而促進機體氧合。此外,根據Bohr效應,pH值降低和CO2升高可使氧解離曲線右移,氧釋放增多,加之高碳酸血癥引起微血管擴張,組織灌流量增加,組織氧供得到有效改善。由此,我們認為PHC策略在嬰兒OLV中應用更為合適。在本研究中,各組患兒的年齡、體質量、OLV時間、手術時間、麻醉時間等一般情況差異無統計學意義,且均為擇期胸腔鏡下肺葉切除術,具有較好的可比性。在氧合方面,盡管在H組中,PHC使OLV時的MMV更低,兩組PaO2和OI差異無統計學意義,而H組血乳酸水平低于C組,提示PHC策略在較低的通氣量下,即可維持不低于傳統通氣策略的氧合水平。考慮血乳酸水平可反映組織的缺氧程度,結果進一步提示PHC策略在改善組織氧合上或許更有優勢,與文獻[7,8]一致。
IL-6和IL-8為機體炎性反應中的促炎性因子,可視為肺部急性損傷的標志物[9]。炎癥水平的高低在肺部疾病發生、發展以及轉歸中均起著極其重要的作用[10,11]。本研究結果顯示,術前兩組IL-6和IL-8水平差異無統計學意義,而術后IL-6和IL-8水平較術前均增高,說明兩組可能均存在VALI。此外,H組術后IL-6和IL-8水平較C組低,提示PHC可在一定程度上減輕肺部炎癥反應。其可能機制如下:首先,機械通氣時較大Vt引起的物理牽拉可激活細胞MAPK通路中的p44/42蛋白,使其磷酸化并最終引起促炎性因子的釋放[12]。而PHC策略采用較小的Vt,可一定程度上減輕物理牽拉,避免p44/42蛋白的磷酸化,從而減少促炎性因子的釋放。其次,PHC策略引起的高CO2水平可參與調節細胞內一系列的信號傳導通路。Contreras等[13]發現CO2可預防細胞質內IκB-α蛋白的降解,抑制p65蛋白的核轉位,從而減輕物理牽拉引起的炎癥反應。此外,近期的研究發現CO2可直接抑制NF-κB相關信號傳導通路的激活,使IL-6和TNF-α等炎性因子釋放減少的同時,提高IL-10等抗炎因子的表達水平,起到抗炎癥反應的作用[14,15]。綜上,PHC策略可一定程度上降低肺部炎癥反應的水平,從而避免過度炎性反應導致的肺部損傷。
術后第2天X線顯示兩組患兒術后肺部并發癥發生率差異無統計學意義,說明兩種通氣策略安全性相當,PHC策略的肺保護優勢在本研究中并無充分體現。我們認為與研究設計相關。考慮過高Ppeak是引起機VALI的主要危險因素,不少研究建議機械通氣時盡量控制Ppeak低于35 cmH2O[16]。因此,本研究設定通氣時Ppeak應低于30 cmH2O,以保證患兒的醫療安全。然而,臨床上采用傳統通氣策略時往往較難保證每例患兒OLV時Ppeak均低于30 cmH2O。其次,除通氣容量外,機械通氣的時間長短亦是VALI發生的相關因素之一。本研究中OLV時間較短,我們推測較短的OLV對患兒健康的肺部損傷程度有限,且該程度的損傷大多可在術后自行恢復。由此,我們認為PHC策略在嬰兒需接受較長時間OLV的胸腔鏡手術中可能會有更大的優勢,而其具體范圍仍有待進一步研究。
綜上所述,PHC策略不但可以更好改善嬰兒OLV時的氧供氧合,還可以通過調控肺部炎癥反應水平,起到一定程度的肺保護作用。
參考文獻:
[1] Amato MB, Barbas CS, Medeiros DM, et al. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome[J]. N Engl J Med, 1998,338(6):347-354.
[2] Brower RG, Matthay MA, Morris A, et al. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome[J]. N Engl J Med, 2000,342(18):1301-1308.
[3] Senturk M. New concepts of the management of one-lung ventilation[J]. Curr Opin Anaesthesiol, 2006,19(1):1-4.
[4] Liu J, Liao X, Li Y, et al. Effect of low tidal volume with PEEP on respiratory function in infants undergoing one-lung ventilation[J]. Anaesthesist, 2017,9(66):667-671.
[5] 劉晶,蘇潤霞,黎昆偉,等.允許性高碳酸血癥通氣策略在嬰兒胸腔鏡肺切除術中的應用觀察[J].山東醫藥,2017,57(31):92-94.
[6] Contreras M, Masterson C, Laffey J G. Permissive hypercapnia: what to remember[J]. Curr Opin Anaesthesiol, 2015,28(1):26-37.
[7] Fleischmann E, Herbst F, Kugener A, et al. Mild hypercapnia increases subcutaneous and colonic oxygen tension in patients given 80% inspired oxygen during abdominal surgery[J]. Anesthesiology, 2006,104(5):944-949.
[8] Hager H, Reddy D, Mandadi G, et al. Hypercapnia improves tissue oxygenation in morbidly obese surgical patients[J]. Anesth Analg, 2006,103(3):677-681.
[9] Cross LJ, Matthay MA. Biomarkers in acute lung injury: insights into the pathogenesis of acute lung injury[J]. Crit Care Clin, 2011,27(2):355-377.
[10] de la Gala F, Pineiro P, Garutti I, et al. Systemic and alveolar inflammatory response in the dependent and nondependent lung in patients undergoing lung resection surgery: a prospective observational study[J]. Eur J Anaesthesiol, 2015,32(12):872-880.
[11] Frick VO, Justinger C, Rubie C, et al. Thoracotomy procedures effect cytokine levels after thoracoabdominal esophagectomy[J]. Oncol Rep, 2012,27(1):258-264.
[12] Otulakowski G, Engelberts D, Gusarova GA, et al. Hypercapnia attenuates ventilator-induced lung injury via a disintegrin and metalloprotease-17[J]. J Physiol, 2014,592(20):4507-4521.
[13] Contreras M, Ansari B, Curley G, et al. Hypercapnic acidosis attenuates ventilation-induced lung injury by a nuclear factor-kappa B-dependent mechanism[J]. Crit Care Med, 2012,40(9):2622-2630.
[14] Cummins EP, Oliver KM, Lenihan CR, et al. NF-kappaB links CO2sensing to innate immunity and inflammation in mammalian cells[J]. J Immunol, 2010,185(7):4439-4445.
[15] Wang N, Gates KL, Trejo H, et al. Elevated CO2selectively inhibits interleukin-6 and tumor necrosis factor expression and decreases phagocytosis in the macrophage[J]. FASEB J, 2010,24(7):2178-2190.
[16] Petrucci N, De Feo C. Lung protective ventilation strategy for the acute respiratory distress syndrome[J]. Cochrane Database Syst Rev, 2013(2):CD003844.

