阿托伐他汀對慢性硬膜下血腫術后復發率的影響
熊學輝 瞿丹霞 魏小川 羅杰 樊俊 黃明火
慢性硬膜下血腫(Chronic subdural hematoma,CSDH)是神經外科相對常見的疾病,外傷是CSDH最常見的原因。CSDH在老年人中常見,特別是在服用了抗凝血劑老年患者更易出現[1]。一般人群的年發病率為1~13/100000人,70歲以上的人每年約17~58/100000人。慢性硬膜下血腫位于硬腦膜和蛛網膜之間,治療方法有保守治療和手術治療兩種方式。手術治療仍然是CSDH的首選,特別出現顱內壓增高者或腦部受壓患者。手術方式常見的是鉆孔引流、內鏡治療、YL-1血腫針、開顱等,常規方式是鉆孔引流,通常鉆1或2個孔,CSDH術后的預后相對較好,然而其復發率卻不低,文獻報道的復發率為3%~34%[2]。盡管CSDH復發與各種因素有關,但不同研究結果略有矛盾,不同的治療方法其診治效果及術后并發癥文獻報道不盡相同。本研究對2011年5月-2017年4月收治的80例接受手術治療的慢性硬膜下血腫患者進行了研究,40例術后服用了阿托伐他汀,并取得了良好的療效,現報道如下。
1 資料與方法
1.1 一般資料
收集2011年5月-2017年4月本院收治的需進行手術治療的慢性硬膜下血腫患者80例,按照術后是否服用阿托伐他汀隨機分為對照組和研究組,每組各40例。對照組患者采用常規鉆孔引流術進行治療;研究組患者在常規鉆孔引流術治療的基礎上口服阿托伐他汀治療。本研究得到醫院倫理委員會的批準。所有CSDH患者術前診斷明確,具有確實放射學證據、病史或臨床癥狀、體征。2組患者一般資料,如年齡、性別、術前GCS評分、血腫、是否服用抗凝劑、血腫量、血腫部位等比較無明顯差異(P>0.05)(表1)。
表1 2組患者一般資料比較
1.2 病例入選標準
患者術前均經CT檢查確診,CT上血腫呈現為等密度、低密度或混合密度影,中線結構移位0.5~1 cm。除了急診手術者外絕大部分患者進行了顱腦MRI檢查,術前行大小便、血常規、肝腎功能、血糖、血脂、凝血機制、心電圖、胸片等檢查。
1.3 病例排除標準
有發熱、顱內或其他部位感染、穿刺附近頭皮有感染或伴有其它皮膚疾病、嚴重的全身性疾病如營養不良、免疫功能缺陷、嚴重的心肺功能不全、凝血功能障礙、長期服用抗凝藥物者、腎功能不全透析患者。
1.4 治療
所有患者術前仔細進行剃頭備皮,嚴格無菌操作,根據血腫部位選擇穿刺點;除少部分患者不能配合采用全身麻醉外,大部分患者均在局部麻醉狀態下進行鉆孔引流術;術中硬膜切口不宜過大,剛能容納引流導管即可,以避免引流過快或空氣大量進入造成氣顱;緩慢釋放陳舊性血性液體,導管接三通閥和去掉內芯的注射器,注射器內裝滿溫生理鹽水,抬高注射器,利用重力沖洗引流血腫腔,可改變導管頭端深度和方向,并利用電動手術床調節頭部的高度和左右傾斜角度,以便于徹底引流血腫腔殘留物,直到引流液清亮;沖洗結束后將導管固定于頭皮,三通閥門連接無菌引流袋,術后先關閉引流管上三通開關,待回病房將引流系統固定在與患者耳屏相同的高度后再打開三通開關,閉式引流約3~5 d;術后臥床,頭低足高位,靜滴抗生素,注意有無傷口滲液,當患者出現神經系統癥狀改善,并從頭部計算機斷層掃描確定血腫充分引流時拔除引流管;觀察組在對照組基礎上術后第1 d即開始給予阿托伐他汀(國藥準字J20120050)輔助治療,20 mg/d,持續1~6個月,血腫完全消失且神經系統表現持續穩定2~4周后停藥。所有患者術后均隨訪1年。
1.5 觀察指標
記錄所有患者的性別、年齡、格拉斯哥昏迷量表(GCS)評分、癥狀、抗血小板聚集劑或抗凝血劑使用情況、血腫位置、血腫體積、阿托伐他汀的應用并記錄其持續時間、術后并發癥及復發率。
1.6 統計學處理
2 結 果
術后臨床療效見表2,對照組總有效率為95%,研究組總有效率為97.5%,2組比較無明顯差異(P>0.05);對照組術后復發率為15%,研究組為5%,2組比較有顯著差異(P<0.05)。研究組2例復發患者中1例是在隨訪4月時CT發現,患者并無明顯臨床癥狀,再次行鉆孔引流手術,隨訪1年未見復發;另1例是在術后6月左右復發,繼續口服阿托伐他汀并聯合高壓氧治療好轉。
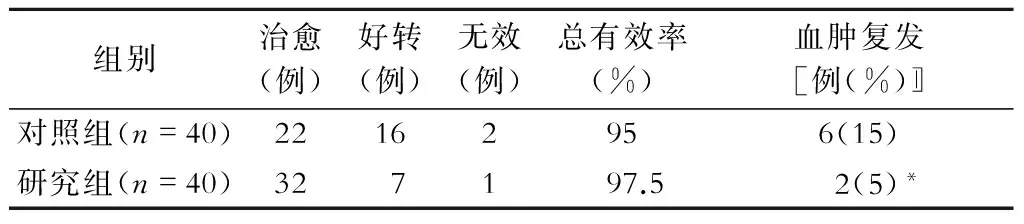
表2 2組患者臨床療效比較
注:與對照組比較,*P<0.05
3 討 論
CSDH在老年人中很常見,大部分原因由外傷引起,外傷導致橋梁靜脈破裂,血液與腦脊液混合積聚在2層硬腦膜之間形成血腫。CSDH形成機制已經得到廣泛研究,但仍未得到完全確定證實。血管生成功能障礙和局部炎癥理論一直被認為是其原因。在早期的新膜異常毛細血管和基底膜之間發現血管內皮細胞和紅細胞,提示未成熟有缺陷的新生血管存在,這是導致硬膜下腔重復出血和血腫擴張的原因。來自新膜未成熟血管可導致血液滲漏,局部炎癥阻礙泄漏的血液被局部吸收和血管生成[3]。CSDH的新膜外部發現存在的血細胞和巨噬細胞,可能有助于產生促血管生成因子如血管內皮細胞生長因子和堿性成纖維細胞生長因子[4-5]。此外,在可能影響血管生成和血管通透性的CSDH血腫新膜中還發現了不同水平的促炎癥和抗炎分子。組織學上硬腦膜外膜有毛細血管樣溝通血管,通過硬腦膜連接,外膜毛細血管滲出被認為是慢性硬膜下血腫擴大的原因。
鉆孔引流是慢性硬膜下血腫的首選治療方法。然而其結果可能不能令人滿意,這種傳統療法可導致一些相關并發癥如感染、腦損傷、顱內出血、引流不暢、血腫復發、腦脊液滲漏和癲癇發作或精神紊亂。最棘手的并發癥是血腫復發,不僅增加了醫療費用,還增加了患者痛苦。有許多病因可導致CSDH復發,有時候難以治療,如慢性酒精中毒、腦萎縮、肝臟功能障礙、使用口服抗凝劑[6]、血液透析、凝血功能障礙、分流手術術后感染等。減少術后復發主要還是靠持續優化外科技術、術中將血腫腔徹底沖洗、引流出炎癥因子,并注意操作細節,減少腦血管破裂發生率,在操作期間最大限度減少再灌注壓力波動,保持顱內壓相對穩定[7];其次還需要術后的引流通暢和精心護理,如能配合藥物治療可進一步提高療效,并可能降低硬膜下血腫復發率。以前有研究CSDH患者口服地塞米松,然而皮質類固醇可導致嚴重的副作用如組織水腫和胃潰瘍,并可能危及免疫系統,因此未能推廣。目前國內外多項研究發現低劑量的阿托伐他汀在CSDH患者中取得了不錯的療效,可減少血腫和復發,并改善神經功能[8-11]。
阿托伐他汀是一種降低膽固醇藥物,動物研究發現他汀類藥物有助于減少血漿脂質、抑制炎癥和促進血管生成、降低促炎分子水平的作用。Dong Wang等[12]在成年Wistar大鼠中誘導SDH,用3、8 mg/kg2組不同劑量的阿托伐他汀進行治療,檢測治療后大鼠的內皮祖細胞CD34+/ CD133+水平,通過磁共振成像(MRI)測量血腫的體積和認知功能的變化,用電子顯微鏡觀察血腫壁血管生成及血管內皮生長因子(VEGF)、基質金屬蛋白酶9(MMP9)和血管生成素免疫組化的表達水平,結果顯示是低劑量阿托伐他汀增加血管生成素-1和VEGF的表達水平,并減少MMP9在SDH結締組織中的表達,導致血管密度增加,增強血管成熟;接受低劑量阿托伐他汀的大鼠SDH體積明顯減少、神經功能缺損改善。此外,他們還對23例采用保守治療的CSDH患者進行了研究,口服阿托伐他汀20 mg/d,服用1~6個月,結果顯示23例患者中有22例出現癥狀改善、血腫減少,這與大鼠動物模型結果一致。在治療CSDH患者時本研究在傳統鉆孔引流術基礎上口服低劑量的阿托伐他汀,雖然臨床療效沒有明顯改善,但術后CSDH復發率卻顯著下降,這與文獻報道一致。
鑒于本臨床研究病例數過少,且影響CSDH療效和復發的因素復雜,還需要多中心大樣本的臨床數據進一步研究。但結合目前的現狀,小劑量阿托伐他汀治療CSDH安全有效,能使患者獲益,值得臨床上推廣和應用。
[1] Mewada T,Ohshima T,Yamamoto T,et al.Usefulness of embolization for iatrogenic dural arteriovenous fistula associated with recurrent chronic subdural hematoma:a case report and literature review[J].World Neurosurg,2016,92(5):584-587.
[2] Unterhofer C,Freyschlag CF,Thome C,et al.Opening the internal hematoma membrane does not alter the recurrence rate of chronic subdural hematomas:a prospective randomized trial[J].World Neurosurg,2016,92(8):31-36.
[3] Xu M,Chen P,Zhu X,et al.Effects of atorvastatin on conservative and surgical treatments of chronic subdural hematoma in patients[J].World Neurosurg,2016,91(7):23-28.
[4] Osuka K,Watanabe Y,Usuda N,et al.Activation of signal transducer and activator of transcription 3 in endothelial cells of chronic subdural hematoma outer membranes[J].World Neurosurg,2016,91(4):376-382.
[5] Tao ZQ,Lin YY,Hu MT,et al.Mechanism of subdural effusion evolves into chronic subdural hematoma:IL-8 inducing neutrophil oxidative burst[J].Med Hypotheses,2016,86(11):43-46.
[6] Szczygielski J,Sina-Maria G,Schwerdtfeger K,et al.Factors affecting outcome in treatment of chronic subdural hematoma in ICU patients:impact of anticoagulation[J].World Neurosurg,2016,49(92):426-433.
[7] Chen L,Dong L,Wang XD,et al.Bilateral chronic subdural hematoma treated by YL-1 type hematoma aspiration needle complicated by hemorrhage of the basal ganglia and brainstem[J].World Neurosurg,2017,97(1):761-764.
[8] Jiang RC,Dong W,Poon WS,et al.Effect of ATorvastatin on chronic subdural hematoma(ATOCH):a study protocol for a randomized controlled trial[J].Bio Med Central,2015,16(3):528-536.
[9] Qiu S,Zhuo W,Sun CM,et al.Effects of atorvastatin on chronic subdural hematoma:A systematic review[J].Medicine,2017,96(26):17-22.
[10] 肖爵賢,程世奇,鄒軼群,等.阿托伐他汀治療慢性硬膜下血腫的療效分析[J].臨床外科雜志,2015,23(2):159-160.
[11] 周宇,陳淳,鄧發斌,等.不同劑量阿托伐他汀對慢性硬膜下血腫的療效及安全性評價[J].中國藥房,2017,28(5):663-667.
[12] Wang D,Li T,Wei HJ,et al.Atorvastatin enhances angiogenesis to reduce subdural hematoma in a rat model[J].J Neurol Sci,2016,362(7):91-99.

