幽門螺桿菌感染對帕金森病臨床癥狀的影響
劉欣 劉娜 婁凡 李曉紅 任艷
帕金森病(Parkinson's disease,PD)是累及多器官多系統的神經變性疾病。除了動作遲緩、靜止性震顫和(或)肌強直等經典的運動癥狀外,還有越來越深入認知的非運動癥狀[1]。胃腸道受累作為PD的非運動癥狀之一,以其早發性及較高發病率而備受關注。除了胃腸道自主神經受累,胃腸道微生物與PD的發病機制、臨床癥狀的關系也積累了一些證據[2-8]。幽門螺桿菌(Helicobacter pylori,Hp)為腸內細菌,與胃十二指腸潰瘍、胃炎、胃癌等腸內疾病的發生密切相關,然而幽門螺桿菌感染與腸外疾病也存在某種密切關系[9-10]。近年來的研究發現,PD患者感染Hp后會影響PD的運動癥狀和運動并發癥[6-8,11-13],但是目前該方面的研究樣本量較小,結果也不一致,Hp感染對于PD的非運動癥狀如便秘是否有影響目前研究較少,尚無關于根除Hp治療后對PD患者便秘影響的報道。本研究主要是對PD 患者感染Hp的情況、Hp感染及根除治療后對PD患者的運動癥狀、運動并發癥的影響及對便秘的影響進行研究。
1 對象與方法
1.1 研究對象
選取2015年12月-2016年12月就診于中國醫科大學附屬第一醫院神經內科,符合中國帕金森病診斷標準并接受多巴胺能藥物治療的患者42例,其中男20例,女22例,42例PD患者中根據13C尿素呼氣試驗將PD患者分為Hp陽性組和Hp陰性組;22例是Hp陽性患者,但其中有1例根除Hp失敗,1例失訪,最終將40例PD患者納入研究,并對其進行基本資料的收集和各項量表的評估,對Hp陽性組的患者還需進行根除Hp治療后各項量表的評估。排除帕金森綜合征;明確PD家族史;近1個月內服用抗生素、質子泵抑制劑、鉍劑等對檢測幽門螺桿菌有影響的患者。本研究已獲得患者及家屬知情同意。
1.2 方法
1.2.113C尿素呼氣試驗
患者需空腹4~6 h,在醫生的指導下向含有二氧化碳吸收劑的口袋吹氣,口服1片尿素[13C]片,20 min后再次向含有二氧化碳吸收劑的口袋吹氣,由WLD600C13C呼氣分析儀對收集的氣體進行分析,DOB值在0~4為陰性,>4為陽性。
1.2.2 Hp根除治療
對Hp陽性的PD患者給予耐信(艾司奧美拉唑)40 mg/次,2次/d,口服,阿莫西林1.0 g/次,2次/d,口服,左氧氟沙星0.2 g(或克林霉素0.5 g)/次,2次/d,口服,果膠鉍200 mg/次,2次/d,口服,療程為2周,停用PPI(質子泵抑制劑)4周以上復查13C 尿素呼氣試驗,Hp陰性為根除成功,Hp陽性為根除失敗。
1.2.3 多巴胺能藥物治療
Hp陽性組的PD患者根除Hp治療前至治療后12周多巴胺能藥物治療方案不變。將抗PD藥物與左旋多巴進行等效劑量計算(LDE)。LDE計算方法[14]:LDE=左旋多巴標準片×1+左旋多巴控釋片×0.75+鹽酸普拉克索×100+(左旋多巴標準片×1+左旋多巴控釋片×0.75)×0.33(同時服用恩他卡朋片)+鹽酸司來吉蘭片×10+金剛烷胺×1。通過LDE計算方法算出PD患者的每天服用左旋多巴的總劑量。
1.2.4 療效評定
用UPDRS-Ⅲ部分評估PD患者的運動癥狀,H&Y分級評估患者癥狀嚴重程度,UPDRS-Ⅳ部分評估運動并發癥的情況,便秘Wexner量表(最低分為0,最高分為30分,分值越高程度越重)評估患者便秘情況,對于有“開關現象”的PD患者進行“開”期時間和左旋多巴藥物起效時間的評估,以上量表分別對PD患者根除Hp治療前及治療第6周和第12周后進行評估,且評分都是在PD患者“開”期時進行評估。
1.2.5 統計學處理
2 結 果
2.1 PD患者Hp感染情況
42例PD患者中有22例為Hp陽性,20例為Hp陰性,其中男20例,女22例,其PD的Hp感染率為52.38%。其中男的Hp感染率為50.00%(10例),女性Hp感染率為54.55%(12例)。
2.2 Hp陽性組和Hp陰性組基本情況比較
Hp陽性組和Hp陰性組的PD患者在年齡、病程、文化程度,UPDRS-Ⅲ評分、便秘Wexner評分等方面無明顯差異(P均>0.05),但是Hp陽性組UPDRS-Ⅳ評分的平均值高于Hp陰性組約1.55分(P=0.016)。另外,Hp陽性組每天需要的左旋多巴等效劑量高于Hp陰性組約164.85 mg(P=0.011),但2組間用藥種類并無明顯差異(P>0.05)(表1,圖1~2)。
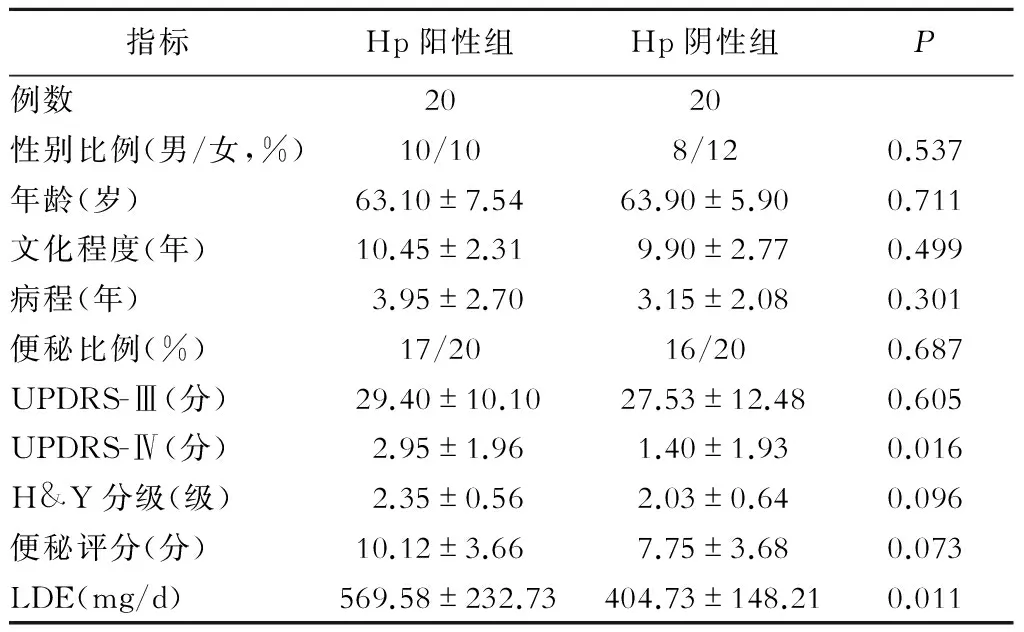
表1 帕金森病Hp陽性組和Hp陰性組基本情況比較
注:UPDRS為統一帕金森病評定量表;H&Y分級為Hoehn & Yahr 分級;LDE為左旋多巴等效劑量;便秘評分為便秘Wexner評分
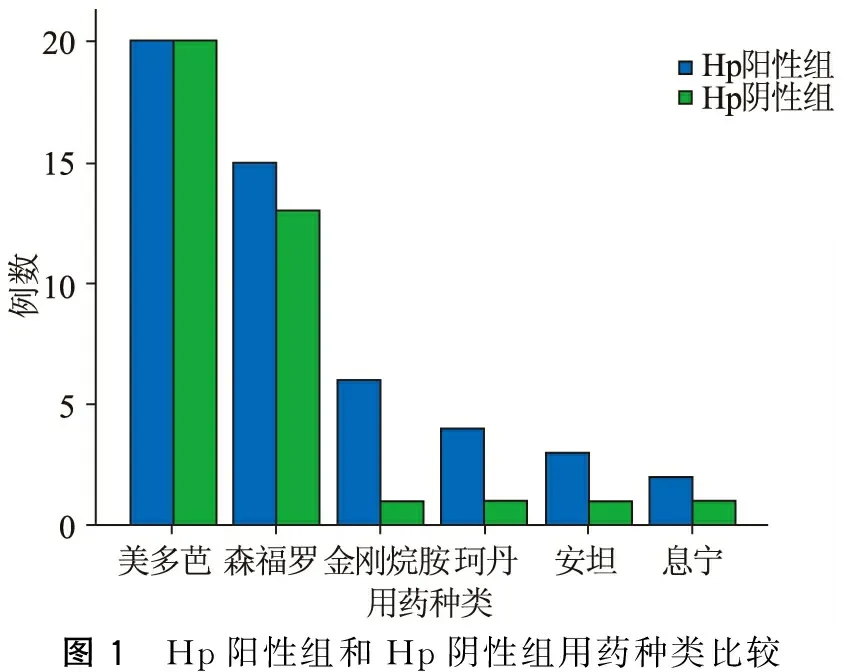
圖1 Hp陽性組和Hp陰性組用藥種類比較
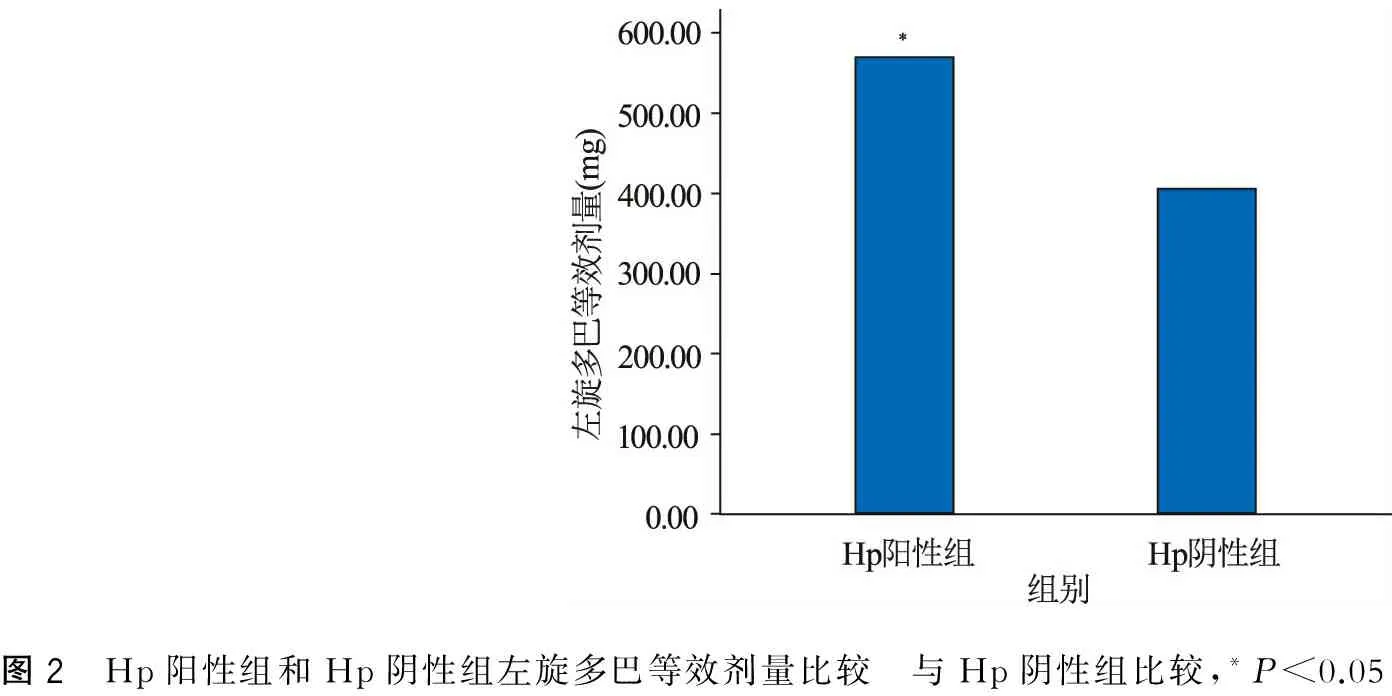
圖2 Hp陽性組和Hp陰性組左旋多巴等效劑量比較 與Hp陰性組比較,*P<0.05
2.3 對PD患者Hp陽性組根除Hp治療前后各項量表評估的比較
根除Hp治療的第6周和第12周后與治療前UPDRS-Ⅲ,UPDRS-Ⅳ,H&Y分級、便秘Wexner評分比較都存在明顯差異(P<0.05),“開”期時間延長,左旋多巴藥物起效時間縮短,且均有明顯差異(P<0.05)。治療第6周后和治療第12周后比較UPDRS-Ⅲ,UPDRS-Ⅳ,H&Y分級、“開”期時間、藥物起效時間和便秘Wexner評分無明顯差異(P>0.05)(表2)。對1名根除Hp治療失敗的PD患者發現根除前后其臨床癥狀和UPDRS-Ⅲ,UPDRS-Ⅳ,H&Y分級,便秘Wexner評分未見明顯改變。
3 討 論
幽門螺桿菌是比較常見的腸道內細菌,PD患者Hp感染率為27%~70%[15-16],PD患者Hp的感染患病率的差異可能與檢驗方法的不同有關。另外,不同地區的環境、經濟水平、醫療水平、患者健康意識及受教育水平也是影響PD患者Hp感染患病率的因素[17]。本研究PD患者的Hp感染率為52.38%,這與國內的一些研究結果接近。
本研究發現Hp陽性組比Hp陰性組的UPDRS-Ⅳ評分及左旋多巴等效劑量高,這提示Hp感染可能會加重運動并發癥,還可能增加每天左旋多巴的需要量。左旋多巴是改善帕金森病運動癥狀的主要藥物,胃腸道是左旋多巴的主要吸收部位,胃腸道的蠕動、排空、酸堿度都可能影響左旋多巴的吸收[18-19]。Hp感染會破壞胃十二指粘膜[20],使胃酸分泌減少及胃排空減慢,胃酸不足及低動力影響左旋多巴的吸收。因此,Hp感染后可能會影響左旋多巴藥物吸收,進而影響左旋多巴的血藥濃度,從而加重運動并發癥。另外,有些研究發現,PD患者感染Hp后左旋多巴的“開”期時間縮短,藥物起效時間延長,也會引起PD患者的癥狀波動[11,21]。由圖1可見感染Hp和未感染Hp的PD患者服藥抗帕金森藥物種類并無明顯差異,主要以左旋多巴和多巴胺受體激動劑為主,而Hp陽性組左旋多巴等效劑量多于Hp陰性組164.85 mg(圖2),且差異有統計學意義(P=0.011)。故推測Hp感染影響左旋多巴藥物的吸收,可能會導致左旋多巴的利用率下降,從而會增加左旋多巴劑量來改善PD的癥狀。
本研究還發現根除Hp治療成功的PD患者在治療第6周和第12周后UPDRS-Ⅲ和UPDRS-Ⅳ評分均有改善,這提示根除Hp治療可能會改善PD患者的運動癥狀和運動并發癥,這與之前的有些研究結果相同。對于根除Hp治療后能改善以上癥狀的原因可能與左旋多巴的吸收有關。有研究發現,根除Hp治療后使左旋多巴的吸收提高21%~54%[22]。本研究還發現在根除Hp治療第6周和第12周后的H&Y分級也得到改善,這提示根除Hp治療可能會改善“開”期時PD患者的嚴重程度。另外,本研究還發現有“開關現象”的PD患者根除Hp治療第6周和第12周后“開”期時間延長了2.05 h/d和2.17 h/d,每次藥物起效時間縮短了0.36 h和0.39 h,這與以往的研究結論一致,但是具體結果存在很大差異,其原因可能是本研究在評估時受主觀因素比較大,而之前的研究是通過72 h患者日記進行評估的,時間相對準確,這也是本研究的不足。
另外,本研究還發現便秘Wexner評分有一定的改善,這提示根除Hp治療后可能會改善PD患者的便秘情況,但是目前國內外尚無關于根除Hp治療與PD患者便秘的關系研究,僅有部分對其它非運動癥狀的報道[6]。帕金森病患者便秘癥狀的發病機制可能與胃腸蠕動減慢、結腸運輸延遲、盆底肌收縮不協調等因素有關[23],但是對于根除Hp治療可能會改善PD患者的便秘癥狀的機制,目前尚不清楚。本研究主要依靠量表評估,而且樣本量較少,將來仍需大樣本研究及詳細評估便秘情況的輔助檢查來進一步證實。

表2 根除Hp治療前和治療后的各項指標比較±s)
注:UPDRS為統一帕金森病評定量表;H&Y分級為Hoehn & Yahr 分級;便秘評分為便秘Wexner評分;開期時間為左旋多巴藥物的持續時間;起效時間為左旋多巴藥物的起效時間;P1為治療前與治療第6周后比較的P值,P2為治療前與治療第12周后比較的P值,P3為治療第6周后與治療第12周后比較的P值
本研究只有1例患者Hp根除治療失敗,其根除Hp前后的臨床癥狀及各項評估指標并無明顯差異。這與之前Pierantozzi的研究結果一致[20],但是有學者研究卻發現根除Hp治療失敗的患者病情會惡化,其研究認為可能是由于Hp根除失敗后釋放大量的抗原,產生自身炎癥免疫增強,從而使病情加重[7]。對于根除Hp治療失敗是否對PD有影響,目前的研究結果也只是一些個例,若想了解兩者之間的關系仍需將來大樣本的研究來證實。
[1] 李淑華,陳海波.帕金森病非運動癥狀研究進展及臨床意義[J].中華神經科雜志,2017,50(1):71-74.
[2] Dutkiewicz J,Szlufik S,Nieciecki M,et al.Small intestine dysfunction in Parkinson’s disease[J].J Neural Transm,2015,122(12):1659-1661.
[3] Mulak A,Bonaz B.Brain-gut-microbiota axis in Parkinson's disease[J].World Journal of Gastroenterology,2015,21(37):10609-10620.
[4] Dobbs SM,Dobbs RJ,Weller C,et al.Link between Helicobacter pylori infection and idiopathic parkinsonism[J].Med Hypotheses,2000,55(2):93-98.
[5] Alvarez-Arellano L,Maldonado-Bernal C.Helicobacter pylori and neurological diseases:Married by the laws of inflammation[J].World J Gastrointest Pathophysiol,2014,5(4):400-404.
[6] Hashim H,Azmin S,Razlan H,et al.Eradication of helicobacter pylori infection improves levodopa action,clinical symptoms and quality of Life in patients with parkinson's disease[J].PLoS One,2014,9(11):e112330.
[7] Dobbs SM,Dobbs RJ,Weller C,et al.Differential effect of Helicobacter pylori eradication on time-trends in brady/hypokinesia and rigidity in idiopathic parkinsonism[J].Helicobacter,2010,15(4):279-294.
[8] Dobbs SM,Charlett A,Dobbs RJ,et al.Antimicrobial surveillance in idiopathic parkinsonism:indication-specific improvement in hypokinesia following Helicobacter pylori eradication and non-specific effect of antimicrobials for other indications in worsening rigidity[J].Helicobacter,2013,18(3):187-196.
[9] Roubaud BC,Franceschi F,Salles N,et al.Extragastric diseases and Helicobacter pylori[J].Helicobacter,2013,18(Suppl 1):44-51.
[10] Goni E,Franceschi F.Helicobacter pylori and extragastric diseases[J].Helicobacter,2016,21(Suppl 1):45-48.
[11] El-Sherif M,Esmael A,Shabana H,et al.Helicobacter pylori infection in Egyptians with Parkinson′s disease:incidence and the effect on motor fluctuation and response to levodopa[J].The Egyptian Journal of Neurology,Psychiatry and Neurosurgery,2016,53(2):84-88.
[12] Bjarnason IT,Bjarnason IT,Charlett A,et al.Role of chronic infection and inflammation in the gastrointestinal tract in the etiologyand pathogenesis of idiopathic parkinsonism.Part 2:response of facets of clinical idiopathic parkinsonism to Helicobacter pylori eradication.A randomized,double-blind,placebo-controlled efficacy study[J].Helicobacter,2005,10(4):276-287.
[13] Mridula KR,Borgohain R,Chandrasekhar Reddy V,et al.Association of helicobacter pylori with parkinson's disease[J].J Clin Neurol,2017,13(2):181-186.
[14] Tomlinson CL,Stowe R,Patel S,et al.Systematic review of levodopa dose equivalency reporting in Parkinson's disease[J].Mov Disord,2010,25(15):2649-2653.
[15] Rahne KE,Tagesson C,Nyholm D.Motor fluctuations and Helicobacter pylori in Parkinson's disease[J].J Neurol,2013,260(12):2974-2980.
[16] Camci G,Oguz S.Association between Parkinson's Disease and Helicobacter Pylori[J].Journal of Clinical Neurology,2016,12(2):147-150.
[17] 種紅,蘇聞,李淑華,等.中老年人帕金森病與幽門螺桿菌感染的相關性研究[J].中華老年醫學雜志,2015,34(11):1223-1226.
[18] Lahner E,Virili C,Santaguida MG,et al.Helicobacter pylori infection and drugs malabsorption[J].World Journal of Gastroenterology,2014,20(30):10331-10337.
[19] Doi H,Sakakibara R,Sato M,et al.Plasma levodopa peak delay and impaired gastric emptying in Parkinson's disease[J].J Neurol Sci,2012,319(1/2):86-88.
[20] Pierantozzi M,Pietroiusti A,Brusa L,et al.Helicobacter pylori eradication and l-dopa absorption in patients with PD and motor fluctuations[J].Neurology,2006,66(12):1824-1829.
[21] Lee WY,Yoon WT,Shin HY,et al.Helicobacter pylori infection and motor fluctuations in patients with Parkinson's disease[J].Mov Disord,2008,23(12):1696-1700.
[22] Lahner E,Annibale B,Delle Fave G.Systematic review:Helicobacter pylori infection and impaired drug absorption[J].Aliment Pharmacol Ther,2009,29(4):379-386.
[23] 李雪蓮,陳先文,王尚培,等.帕金森病患者便秘臨床特點及相關因素分析[J].中華神經科雜志,2016,49(4):282-287.

