大黃素甲醚調節miR-370誘導肝癌細胞凋亡的實驗研究
李燕 潘小平 王海霞 仝東蒙 王琛 朱麗達
肝細胞癌(hepatocellular carcinoma,HCC)是最常見的侵襲性惡性腫瘤之一。因肝內轉移和復發,在癌癥導致的死亡原因中,男性排名第二,女性排名第六[1-2]。最近十年,發展中國家的HCC發病率和死亡率一直在增加[3]。據統計,我國2011年新增HCC患者355 595例,死亡322 416例[4]。由于目前常規治療效果不理想,尋找新藥已成為改善肝癌患者預后的迫切要求。MicroRNAs(miRNAs)是一類長約21~25個核苷酸的內源性非編碼單鏈小RNAs,在多個生理活動中發揮重要作用,可以通過轉錄前調節靶基因mRNA的表達來影響細胞的增殖、凋亡和分化等[5]。越來越多的證據表明,異常調節miRNAs與不同的人類惡性腫瘤的發展和預后有關[6]。如miR-148b的異常低表達與HCC的不良結果有關[7]。miR-522水平升高預示著HCC患者的預后較差[8]。在HCC細胞中,miR-370通過抑制遷移和侵襲發揮其抑制轉移的潛能[9]。有最新研究報道在體外增加miR-370表達會促進肝癌細胞的死亡[10]。然而,miR-370對HCC細胞生物學行為的影響機制尚不完全清楚。大黃素甲醚是藥用植物大黃中的一種活性成分,已被用作瀉藥、保肝、消炎和抗菌藥[11-12]。最近也有大黃素甲醚誘導細胞凋亡[13-14]、阻斷細胞周期增殖[13]和抑制癌細胞轉移[15]的報道。然而,大黃素甲醚在HCC中的作用機制尚未見報道。本研究旨在觀察大黃素甲醚調節miR-370誘導HCC細胞的凋亡情況,并探討其作用機制。
材料與方法
一、細胞系
人肝癌細胞SMMC7721和HepG2購自美國標準菌庫,肝細胞系L-02購自上海生命科學研究院細胞資源中心。所有細胞系在37℃含5%CO2的加濕培養箱中,在含有4 mg/L谷氨酰胺、3.7 g/L碳酸氫鈉、4.5 g/L葡萄糖和10%胎牛血清的RPMI-1640培養基中培養。
二、實時定量PCR(qRT-PCR)
利用TRIzol試劑從培養的細胞中提取總RNA,通過高容量cDNA試劑盒獲得cDNA,采用TaqMan PCR試劑盒和ABI 7500系統進行qRT-PCR。使用實時Taqman探針檢測miR-370 mRNA在組織中的表達,miR-370在細胞和組織中的表達被規范化為U6。Sp1和DNA甲基轉移酶1(DNMT1)的特異性引物分別購自生合生物科技有限公司和北京義翹神州生物技術有限公司。Sp1和DNMT1的mRNA表達被GADPH標準化,PCR結果分析采用ΔCt比較法。
三、CCK-8檢測細胞活力
將密度為1×105/mL的SMMC7721和HepG2細胞在培養皿中培養24 h或48 h。分別用0、2.5、5、10 μmol/L的大黃素甲醚處理,然后向培養液中加入CCK-8溶液,再培養1 h。通過檢測450 nm波長下的吸光度來計算活細胞數目。
四、流式細胞儀分析細胞凋亡情況
使用FITC-膜聯蛋白V細胞凋亡試劑盒通過流式細胞儀檢測細胞凋亡情況。將密度為1×106/mL的SMMC7721和HepG2細胞,用膜聯蛋白-V-FITC和丙酸(PI)在黑暗中染色15 min,然后用流式細胞儀分析癌細胞凋亡情況。
五、Western blot分析
用RIPA緩沖液裂解從組織中分離出蛋白質,通過含有蛋白酶抑制劑的裂解緩沖液從細胞中提取蛋白質。用BCA蛋白測定試劑盒測定蛋白質濃度。提取的總蛋白通過SDS-PAGE電泳轉移到聚偏二氟乙烯膜上,用特異性抗體檢測,并用BandScan軟件進行強度定量分析。
六、miR-370抑制或過表達
慢病毒構建的 miR-370 mimic、miR-370和miR-370抑制劑購自Qiagen公司。細胞接種到96孔板中,孵育過夜;然后轉染miR-370 mimic、miR-con或miR-370抑制劑;通過qPCR分析轉染效率。
七、Sp1和DNMT1過表達
使用陽離子脂質體3000的試劑分別轉染Sp1和DNMT1過表達質粒。轉染48 h后,用Western blot檢測相應的蛋白表達水平,以此驗證大黃素甲醚是否通過DNMT1調節miR-370的水平。
八、在HCC細胞中轉染Sp1和DNMT1的siRNA
Sp1和DNMT1的siRNA寡核苷酸分別購自上海西寶生物科技有限公司和美國圣克魯斯生物技術公司。siRNA序列和一個作為對照的干擾序列,分別獨立插入質粒載體pGCsi-H1中。轉染時,將對數生長階段的細胞接種于6孔板中,并將轉染細胞再孵育48 h,經Western blot檢測和分析驗證。
九、統計學分析
所有統計學分析均使用GraphPad Prism 6軟件。數據描述為均數±標準差(x±s)格式,統計學比較采用單因素方差分析。P<0.05為差異有統計學意義。
結 果
一、大黃素甲醚降低HCC細胞的活力
5 μmol/L 和 10 μmol/L 的大黃素甲醚處理SMMC7721和HepG2細胞24 h和48 h均可造成細胞活力的降低,且隨著濃度的增加降低的更明顯。48 h存活細胞的數量顯著低于24 h(圖1)。大黃素甲醚能增加SMMC7721和HepG2細胞的凋亡比例,見圖2。
二、HCC細胞中通過上調miR-370造成大黃素甲醚誘導型細胞凋亡
miR-370水平隨大黃素甲醚的濃度依賴性地增加,見圖3A。miR-370 mimic明顯增強了miR-370的表達,而miR-370抑制劑明顯降低了miR-370的表達,見圖3B。轉染了miR-370 mimic的HCC細胞類似陽性對照,顯示上調miR-370與凋亡細胞數目明顯增加有關(圖3C)。且miR-370抑制劑在兩組細胞系中均能明顯降低大黃素甲醚誘導型細胞凋亡。
三、大黃素甲醚通過AMPK/Sp1/DNMT1信號調節miR-370的表達

圖1 大黃素甲醚對肝細胞癌細胞活力的影響
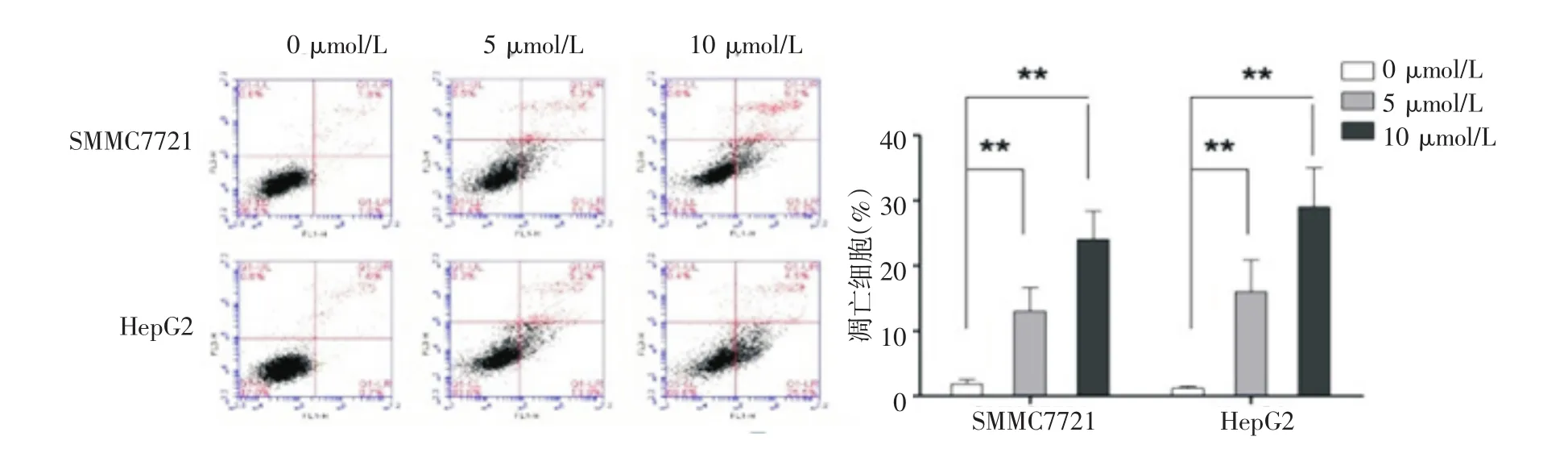
圖2 大黃素甲醚對肝細胞癌細胞凋亡的影響(**P<0.01)
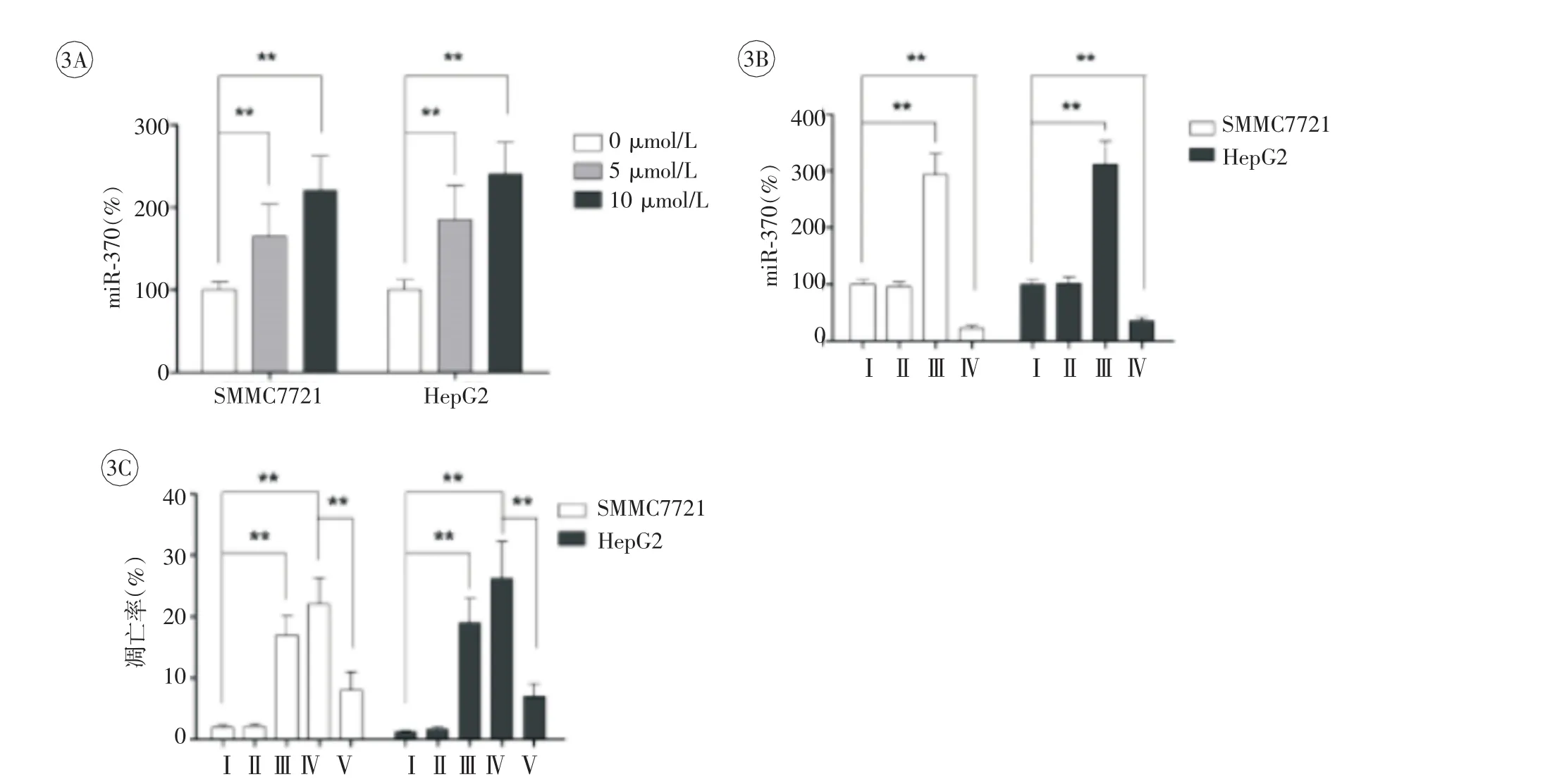
圖3 HCC細胞中MiR-370介導的大黃素甲醚細胞凋亡誘導效應
大黃素甲醚處理可導致SMMC7721和HepG2細胞中DNMT1在mRNA和蛋白水平上的降低(圖4A)。大黃素甲醚能抑制Sp1的表達,表明大黃素甲醚可能通過抑制Sp1的表達調節DNMT1水平(圖4B)。此外,大黃素甲醚通過活化AMPK抑制Sp1的表達(圖4C、4D),AMPK/Sp1信號能通過大黃素甲醚的作用下調DNMT1水平(圖4E)。為了證實AMPK/Sp1/DNMT1參與到大黃素甲醚對miR-370的調節中,DNMT1和Sp1的表達使用靶shRNA或過表達質粒和AMPK抑制劑化合物C和AMPK活化劑AICAR。本研究結果清晰地表明大黃素甲醚通過AMPK/Sp1/DNMT1信號調節miR-370水平(圖4F)。大黃素甲醚通過AMPK/Sp1/DNMT1信號上調miR-370,進而誘導細胞凋亡(圖4G)。

圖4 大黃素甲醚通過AMPK/Sp1/DNMT1信號調節miR-370的水平
討 論
大黃素甲醚是從藥用植物大黃和海洋衍生小孢子菌屬真菌中提取的一種天然蒽醌類衍生物,首次報道是其對結腸癌和白血病發揮細胞毒性作用[16]。從此,大黃素甲醚對人類乳腺癌、子宮頸癌、結腸癌和鼻咽癌的誘導細胞凋亡效應被發現[13-14]。而且,包括EMMPRIN[14]、6-磷酸葡萄糖酸鹽脫氫酶和Sp1[17]的幾個分子靶點也已被證實。
miR-370在許多人類惡性腫瘤中異常表達,因此有人提出關于miR-370在人類惡性腫瘤發生和發展過程中作用的相反結果:miR-370可以作為一個癌基因或腫瘤抑制基因。例如,在實體腫瘤和血液惡性腫瘤中檢測到miR-370的異常低表達[18-19],表明miR-370是腫瘤抑制基因。膽管上皮癌細胞的體外實驗也表明用miR-370 mimic轉染能抑制細胞生長[20]。此外,研究發現miR-370的更新能使癌細胞對化療重新敏感[21]。相反地,某些研究成果發現miR-370在癌細胞中扮演著致癌miRNA的角色。如miR-370在霍奇金腫瘤G401細胞系中的離體過表達與腫瘤增殖率的增加有關,這表明miR-370具有致瘤作用[22]。此外,miR-370通過直接調節FOXO1促進人類前列腺癌和胃癌細胞的生長[23-24]。還有研究發現miR-370高表達與乳腺癌患者低治愈率之間的關系[25]。
在HCC細胞中,miR-370通過抑制遷移和侵襲顯示出其抑制腫瘤細胞轉移的潛力[9]。Sun等[10]最新的研究報道表明體外增加miR-370的表達,可以促進肝癌細胞的死亡。Pan等[26]研究報道miR-370水平可以作為臨床評價肝細胞癌患者預后的獨立指標。本研究顯示miR-370介導HCC細胞中大黃素甲醚的凋亡誘導作用,進一步支持了miR-370作為HCC腫瘤抑制因子的作用,與以前研究相一致。因為癌癥表觀遺傳的改變導致某些促進甲基化作用的腫瘤抑制基因的沉默,因此表觀遺傳學的不穩定性在癌癥的發生和發展中起主要作用[27]。除蛋白質外,表觀遺傳調控也在miRNAs的調控中起關鍵作用[28]。這種現象使DNMT轉移到DNA中前5個碳原子上的催化酶,成為miRNAs的關鍵調控因子[29]。
在DNMT家族中,DNMT1被研究的最多,報道中發現其參與腫瘤的發生和發展[30]。在HCC的細胞中,DNMT1的異常表達增加可以促進HCC的惡性發展,并且與HCC患者的復發和低治愈率有關[31]。據報道DNMT1介導了乙型肝炎病毒x蛋白(HBx)誘導的p16-INK4A基因啟動子的超甲基化[32]。本研究結果顯示HCC中DNMT1作為一個上游信號分子調控miR-370的表達,表明DNMT1可能通過調節miRNAs影響HCC細胞的生物活性,并支持DNMT1作為一個潛在的HCC治療靶點。
Sp1是已被證實的哺乳動物細胞中轉錄因子之一,通過調節多種基因的表達在細胞進程中發揮調控作用。由于Sp1與幾種基因啟動子的富含GC的基序結合并誘導癌細胞的生長,它已被認為是癌癥治療中有希望的靶點[33]。最近研究發現DNMT1基因啟動子中存在富含GC基序,表明DNMT1可能是Sp1的下游靶點[34],并且發現一些天然化合物通過Sp1調節DNMT1的表達[35]。本研究結果也顯示大黃素甲醚通過抑制Sp1來調節DNMT1的表達,與以往研究結果一致。
參考文獻
[1]Vilarinho S,Taddei T.Therapeutic strategies for hepatocellular carcinoma:new advances and challenges[J].Curr Treat Options Gastroenterol,2015,13(2): 219-234.
[2]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[3]Song P,Feng X,Zhang K,et al.Perspectives on using des-gammacarboxyprothrombin(DCP)as a serum biomarker:facilitating early detection of hepatocellular carcinoma in China[J].Hepatobiliary Surg Nutr,2013,2(4):227-231.
[4]Zuo TT,Zheng RS,Zhang SW,et al.Incidence and mortality of liver cancer in China in 2011[J].Chin J Cancer,2015,34(11):508-513.
[5]Hébrant A,Floor S,Saiselet M,et al.miRNA expression in anaplastic thyroid carcinomas[J].PLoS One,2014,9(8): e103871.
[6]Ong SG,Lee WH,Kodo K,et al.MicroRNA-mediated regulation of differentiation and trans-differentiation in stem cells[J].Adv Drug Deliv Rev,2015,88 3-15.
[7]ZiariK, Zarea M, GityM, etal.Retraction Note to:Downregulation of miR-148b as biomarker for early detection of hepatocellular carcinoma and may serve as a prognostic marker[J].Tumour Biol,2016,Nov 5.[Epub ahead of print]
[8]Shi YH,Qi BB,Liu XB,et al.Upregulation of miR-522 is associated with poor outcome of hepatocellular carcinoma[J].Eur Rev Med Pharmacol Sci,2016,20(15): 3194-3198.
[9]Xu WP,Yi M,Li QQ,et al.Perturbation of MicroRNA-370/Lin-28 homolog A/nuclear factor kappa B regulatory circuit contributes to the development of hepatocellular carcinoma [J].Hepatology,2013,58(6): 1977-1991.
[10]Sun G,Hou YB,Jia HY,et al.MiR-370 promotes cell death of liver cancer cells by Akt/FoxO3a signalling pathway[J].Eur Rev Med Pharmacol Sci,2016,20(10): 2011-2019.
[11]Agarwal SK,Singh SS,Verma S,et al.Antifungal activity of anthraquinone derivatives from Rheum emodi[J].J Ethnopharmacol,2000,72(1-2): 43-46.
[12]Tamokou Jde D,Tala MF,Wabo HK,et al.Antimicrobial activities of methanol extract and compounds from stem bark of Vismia rubescens[J].J Ethnopharmacol,2009,124(3):571-575.
[13]Hong JY,Chung HJ,Bae SY,et al.Induction of cell cycle arrest and apoptosis by physcion,an anthraquinone isolated from rhubarb(rhizomes of rheum tanguticum),in MDA-MB-231 human breast cancer cells[J].J Cancer Prev,2014,19(4): 273-278.
[14]Chen X,Gao H,Han Y,et al.Physcion induces mitochondriadriven apoptosis in colorectal cancer cells via downregulating EMMPRIN[J].Eur J Pharmacol,2015,764:124-133.
[15]Han YT,Chen XH,Gao H,et al.Physcion inhibits the metastatic potential of human colorectal cancer SW620 cells in vitro by suppressing the transcription factor SOX2[J].Acta Pharmacol Sin.,2015,37(2): 264-275.
[16]Ge HM, Song YC, Shan CY, et al.New and cytotoxic anthraquinones from Pleospora sp.IFB-E006,an endophytic fungus in Imperata cylindrical[J].Planta Med,2005,71(11):1063-1065.
[17]Lin R,Elf S,Shan C,et al.6-Phosphogluconate dehydrogenase links oxidative PPP,lipogenesis and tumour growth by inhibiting LKB1-AMPK signalling[J].Nat Cell Biol,2015,17 (11): 1484-1496.
[18]Yungang W,Xiaoyu L,Pang T,et al.miR-370 targeted FoxM1 functions as a tumor suppressor in laryngeal squamous cell carcinoma (LSCC)[J].Biomed Pharmacother,2014,68(2):149-154.
[19]Zhang X,Zeng J,Zhou M,et al.The tumor suppressive role of miRNA-370 by targeting FoxM1 in acute myeloid leukemia[J].Mol Cancer,2012,11:56.
[20]An F,Yamanaka S,Allen S,et al.Silencing of miR-370 in human cholangiocarcinoma by allelic loss and interleukin-6 induced maternal to paternal epigenotype switch[J].PLoS One,2012,7(10):e45606.
[21]Chen XP,Chen YG,Lan JY,et al.MicroRNA-370 suppresses proliferation and promotes endometrioid ovarian cancer chemosensitivity to cDDP by negatively regulating ENG[J].Cancer Lett,2014,353(2): 201-210.
[22]Cao X,Liu D,Yan X,et al.Stat3 inhibits WTX expression through up-regulation of microRNA-370 in Wilms tumor[J].FEBS Lett,2013,587(6):639-644.
[23]Wu Z,Sun H,Zeng W,et al.Upregulation of MircoRNA-370 Inducesproliferation in humanprostatecancercells by downregulating the transcriptionfactor FOXO1[J].PLoS One,2012,7(9): e45825.
[24]Fan C,Liu S,Zhao Y,et al.Upregulation of miR-370 contributes to the progression of gastric carcinoma via suppression of FOXO1[J].Biomedecine&pharmacotherapie,2013,67(6): 521-526.
[25]Sim J,Ahn H,Abdul R,et al.High MicroRNA-370 Expression Correlates with Tumor Progression and Poor Prognosis in Breast Cancer[J].J Breast Cancer,2015,18(4): 323-328.
[26]Pan XP,Huang LH,Wang X.MiR-370 functions as prognostic marker in patients with hepatocellular carcinoma[J].Eur Rev Med Pharmacol Sci,2017,21:3581-3585.
[27]Baylin SB,Ohm JE.Epigenetic gene silencing in cancer-a mechanism for early oncogenic pathway addiction [J].Nat Rev Cancer,2006,6(2):107-116.
[28]Jones PA,Liang G.Rethinking how DNA methylation patterns are maintained[J].Nat Rev Genet,2009,10(11): 805-811.
[29]Brenner C,Fuks F.DNA methyltransferases: facts,clues,mysteries[J].Curr Top Microbiol Immunol,2006,301:45-66.
[30]Yan L,Yang X,Davidson NE.Role of DNA methylation and histone acetylation in steroid receptor expression in breast cancer[J].J Mammary Gland Biol Neoplasia,2001,6(2): 183-192.
[31]Saito Y,Kanai Y,Nakagawa T,et al.Increased protein expression of DNA methyltransferase(DNMT)1 is significantly correlated with the malignant potential and poor prognosis of human hepatocellular carcinomas[J].Int J Cancer,2003,105(4): 527-532.
[32]Zhu YZ,Zhu R,Shi LG,et al.Hepatitis B virus X protein promotes hypermethylation of p16(INK4A) promoter through upregulation of DNA methyltransferases in hepatocarcinogenesis [J].Exp Mol Pathol,2010,89(3): 268-275.
[33]Li J,Zou WX,Chang KS.Inhibition of Sp1 functions by its sequestration into PML nuclear bodies[J].PLoS One,2014,9(4):e94450.
[34]Sontag RL,Weber TJ.Ectopic ERK expression induces phenotypic conversion ofC10 cellsand altersDNA methyltransferase expression[J].BMC Res Notes,2012,5:217.
[35]Zhao S,Wu J,Zheng F,et al.β-elemene inhibited expression of DNA methyltransferase 1 through activation of ERK1/2 and AMPKα signalling pathways in human lung cancer cells:the role of Sp1[J].J Cell Mol Med,2015,19(3): 630-641.

