3D iGuide穿刺技術在DynaCT引導射頻消融治療大肝癌中的應用
袁宏軍 劉鳳永 李鑫 管陽 王茂強
CBCT是近年來開始應用的一種集合了數字減影血管造影機(digital subtraction angiography,DSA)上C型臂旋轉以及平板探測器同步采集的功能于一體,通過工作站重建可獲得靶器官三維圖像的CT圖像技術[1]。主要應用于腫瘤放射治療的靶區勾畫、腫瘤的血管內介入治療、非血管性介入治療等方面[2]。目前國內外文獻對其均沒有統一名稱,CBCT文獻名稱又稱為C臂錐體束CT、C臂CT、平板容積CT、C-arm CT、Cone Beam CT,而且不同廠家的稱呼也不同,如:西門子公司的DynaCT、飛利浦公司的XperCT和GE公司的InnovaCT等[3-4]。3D iGuide穿刺技術是以DynaCT斷層圖像為基礎,可以實現在syngo Workplace工作站上的3D容積及DynaCT圖像上設計進針的方向、路徑,并自動給出具有所設計路徑角度的定位激光,引導進針,同時在Artis實時顯示器上顯示進針的路徑,以實現在DSA上進行穿刺的技術[5]。本研究探討將DynaCT的3D iGuide穿刺技術應用于引導射頻針穿刺肝臟腫瘤,不同于以往直接透視穿刺,其具有實時監控、新的定位和導引路徑及快速的三維重建技術等優勢[5-7],使iGuide路徑引導穿刺更加準確、安全,為射頻消融(RFA)治療肝癌提供新的引導方法。
資料與方法
一、一般資料
選取2016年9—12月在解放軍總醫院介入放射科住院治療的孤立性大肝癌患者19例,其中男15例,女4例,年齡45~73歲,所有患者均經影像學或病理學檢查確診為肝細胞肝癌(HCC),已經接受過一次或多次經導管肝動脈化療栓塞術(TACE)治療。本研究得到了醫院倫理委員會的批準,所有患者志愿接受DynaCT引導下RFA治療。納入標準:(1)影像學或病理學確診的不可切除的孤立性肝癌,腫瘤最大徑≥5 cm;(2)所有計劃行RFA的腫瘤病灶均距膽囊、腸管、膽管、重要大血管等毗鄰臟器的距離≥1 cm;(3)患者肝功能Child-Pugh分級均為A和B級或巴塞羅那(BCLC)分期為B期和C期,且生活質量Kamofsky評分>70分;(4)患者接受過一次或多次TACE治療。排除標準:(1)患者合并其他嚴重疾病不能耐受介入手術,如嚴重凝血功能障礙,凝血酶原活動度少于40%、血小板計數低于30×109/L;(2)碘過敏及不能行股動脈穿刺患者;(3)患者肝內存在動靜脈瘺形成、膽道侵犯、門脈癌栓及肝外轉移癌灶;(4)預計生存期小于3個月的患者;(5)肺功能較差,經呼吸訓練后仍不能屏氣8 s的患者。
二、設備
西門子公司Artis zee型數字減影平板血管造影機 (Artis zee BA Twin;Siemens AG,Germany),Syngo Workplace工作站(syngo X-workplace with syngo DynaCT;Siemens AG,Germany)。 射頻治療儀是美國1500型RITA射頻系統(Model 1500;RITA Medical System,Mountain View,CA,USA),射頻頻率為460 kHz;射頻針為RITA多極射頻消融電極針,外套管直徑為14 G,內含9個可呈傘狀張開的鉤形集束電極,最大張開直徑為5 cm。
三、DynaCT引導下Syngo iGuide穿刺技術
1.DynaCT圖像采集:選擇8sDR掃描程序,調整C臂角度及治療床位置,校準正位、側位,使DynaCT掃描視野容納患者腹部及病灶部位。掃描參數為:C臂旋轉角度為200°,采集圖像速度為50幀/s,每幅增量0.5°,產生X線劑量為0.36μGy/幀,總用時8s,總投照掃描幀數396幀。C臂旋轉掃描采集病灶部位圖像過程中囑患者屏氣。圖像采集后自動上傳送到Syngo Workplace工作站,自動生成重建的3D容積圖像以及軸位、矢狀位、冠狀位的MPR圖像。
2.iGuide三維穿刺定位技術(圖1):第一步:在工作站inspace界面打開DynaCT圖像,調整窗寬窗位,觀察病灶是否完整清晰的顯示。選擇iGuide功能,用十字線分別定位在矢狀位、冠狀位和軸位上的病灶層面上。選擇穿刺點(靶心),再確定體表進針點(體表位置),用iGuide軟件根據兩點的位置自動定義進針路徑(圖2),并顯示進針深度。第二步:在軟件上選擇牛眼位,按下并前推機架操縱桿,C臂機架將自動打到牛眼位,再移動床面使靶點與體表進針點重疊(圖3A),隨后開啟激光定位燈,將激光十字對陣射頻針尾并調整進針位置(圖3B),使用機架操縱桿使C臂在3個不同角度的進針路徑位切換轉動,透視確認穿刺針是否沿預先確定的路徑送至靶點(圖3C)。第三步:透視下沿預設路徑進針,直到針尖到達靶心,重新掃描DynaCT并確認穿刺成功。
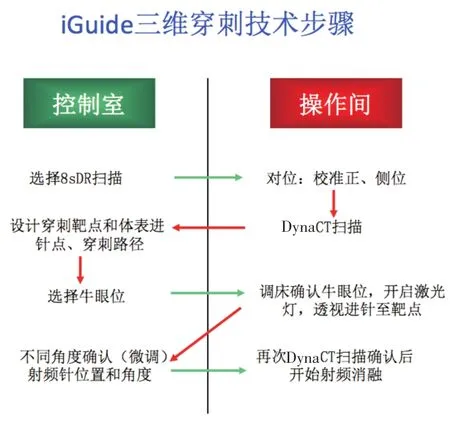
圖1 iGuide三維穿刺技術步驟
3.射頻消融:射頻針穿刺成功后,緩緩打開射頻針,使其變成多極傘狀。透視觀察并確認打開的電極針在預設靶點(圖4)。接通1500型RITA射頻消融腫瘤治療系統,選擇治療功率為150~200 W,射頻消融時間為15~20 min,溫度為105℃。因肝癌瘤體較大,一個部位消融結束后,需調整針道繼續消融,直至消融范圍覆蓋病灶邊緣及其所有三維空間,調整針道下一次消融時,需重新行DynaCT掃描并設計路徑。消融結束退針時,以70~90℃溫度行針道凝固,以降低針道出血、腫瘤針道種植轉移的風險。按壓穿刺點2~5 min,以無菌輔料加壓包扎。
4.術后隨訪:術后1個月復查腹部CT或增強MRI,記錄肝臟腫瘤病灶壞死程度、范圍和局部復發情況(圖5);觀察并及時處理術后并發癥。隨訪患者近期的生存狀態;根據患者術后影像及化驗檢查結果,評估腫瘤壞死范圍和新發病灶情況,再決定下一步治療方案。
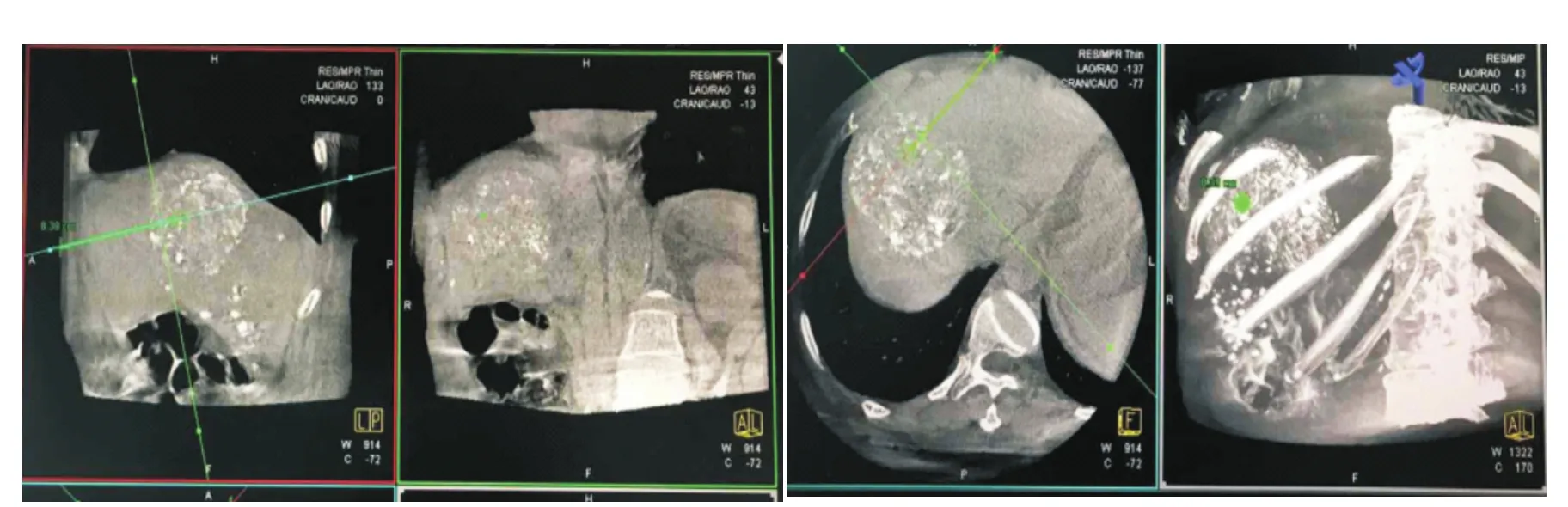
圖2 在工作站設計靶點、體表進針點和穿刺路徑

圖3 3D iGuide穿刺技術在DynaCT引導射頻消融中的應用
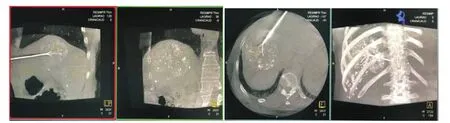
圖4 穿刺成功后,再次行DynaCT掃描確認射頻針在位,打開射頻針
5.療效評價:采用美國肝病學會(AASLD)頒布的針對肝癌療效評估的改良實體瘤療效評價標準(m-RECIST)[9]進行評估,完全緩解(CR):復查增強CT或MRI平掃+動態增強示所有目標病灶動脈期增強顯影均消失;部分緩解(PR):目標病灶動脈期增強顯影的直徑總和縮小≥30%;疾病穩定(SD):病灶縮小程度未達PR或者增加未達PD;疾病進展(PD):目標病灶動脈期增強顯影的直徑總和增加≥20%或出現新發病灶。有效=CR+PR。
四、統計學方法
采用SPSS24.0統計軟件進行數據分析,計量資料如操作時間和有效劑量用均數±標準差(x±s)表示。
結 果
一、技術成功率及療效
技術成功定義為成功穿刺入預設腫瘤靶位,所有RFA術均由同一位經驗豐富的介入醫生及其助手操作完成。19例患者均可耐受DynaCT引導下的RFA,技術成功率為100%,且術后3個月內所有患者均存活。DynaCT引導下RFA平均操作時間為(45.3±4.8)min,患者所接受X線輻射的平均劑量為(15.4±5.1)mSv。術后1個月影像學復查評估治療效果:CR17例、PR2例。
二、術中、術后并發癥
術中并發癥主要表現為穿刺部位局部疼痛,尤其以近肝包膜處痛感顯著,處理方法為局部注射麻藥(如利多卡因等);制動肢體酸痛、麻木,術畢可自行緩解。術后19例患者均出現不同程度的肝區不適或疼痛,15例患者出現發熱,體溫37.5~39.8℃,5例患者出現鏡下血尿,18例患者術后血常規及肝功能指標一過性升高,經鎮痛、退熱、水化、護肝、降酶、堿化尿液治療后1周內基本恢復正常;19例患者均未發現氣胸、膽囊壞死、膽汁瘺、肝膿腫及大出血等嚴重并發癥。
討 論
近年來RFA成為除TACE治療外最常用的非手術治療肝癌的方法,尤其在小肝癌治療方面療效確切,可媲美外科手術、肝移植等根治性治療[8],但對于直徑較大或瘤體不規則的肝癌,難以保證腫瘤邊緣均達到壞死,易發生腫瘤殘留和復發轉移[9-10]。隨著RFA儀器、影像引導設備創新和改進以及臨床經驗的積累,RFA逐漸應用于肝癌的治療,尤其是CBCT技術的問世,為肝癌的治療提供了新的而且有效的治療方式。RFA的影像引導系統很多,主要為B超和CT;雖然國外有報道MR引導下RFA,但由于電磁材料的限制,國內開展較少,臨床應用有限。B超因其操作簡便、無放射線、費用低和能實時引導等優勢,是目前引導RFA的主要方式[11];然而B超引導RFA治療肝癌,尤其是大肝癌,仍具有一定的不足:肝癌因瘤體較大,往往需要多次多針多部位消融,RFA時因組織內水分氣化而出現氣泡,對超聲圖像造成干擾,影響腫瘤邊界的判斷;部分嚴重肝硬化患者,常規超聲難以清晰顯示腫瘤邊界;且二維超聲僅提供腫瘤某一切面的形態信息,對于腫瘤較大、形態不規則患者,常規二維超聲無法獲得病灶的立體形態信息,因而不能精確引導電極布[12-13]。CT透視引導下RFA相對于超聲引導定位準確,圖像清晰,對于特殊部位的病灶(例如膈頂、鄰近腸管),具有獨特優勢,但CT引導下穿刺也存在如下缺點:(1)操作過程中需反復多次掃描,以確認射頻針位置,治療過程耗時較長,對患者有輻射;(2)穿刺過程中是盲穿,不能實時觀察,當腫瘤鄰近大血管或大膽管時,有損傷重要血管、膽管、膽囊的可能[13-15]。
DynaCT是西門子公司Artis zee型數字減影平板血管造影機附帶的一種CBCT功能。3D iGuide穿刺技術是以DynaCT斷層圖像為基礎,可以實現在syngo Workplace工作站上的3D容積及DynaCT圖像上計劃進針的方向、路徑,同時在Artis實時顯示器上顯示進針的路徑,引導進針過程,以實現在血管機上進行穿刺的技術[16]。本研究使用該技術進行19例穿刺,術中、術后均未出現嚴重并發癥,證明其安全性值得肯定,且技術成功率為100%,證明該技術可行。筆者認為將3D iGuide穿刺技術成功應用于RFA治療肝癌,具有以下優勢:(1)利用碘油標記,在透視下可以準確顯示靶病灶,病灶顯示更直觀,易于引導射頻針進入靶病灶;(2)通過實時透視顯示可避開肺、心臟、大血管、膽囊等特殊部位;(3)3D iGuide穿刺技術預先設計路徑和穿刺靶點,且激光燈已經給出體表穿刺點和穿刺角度,可以快速、準確進針;(4)本研究中患者術中接受的X線輻射平均劑量為(15.4±5.1)mSv,而 CT指導干預的 X 線輻射平均劑量為15 mSv/次(CT掃描次數跟介入醫生經驗及病灶特點有關)[17],3D iGuide穿刺技術總的輻射量與CT引導穿刺中的一次掃描劑量相當;在以后的研究中還可以嘗試調整視野及準直來減少輻射劑量,以更好的保護患者和介入醫生;(5)該新技術最重要的優點是基于DynaCT重建的斷層圖像,在可以準確穿刺進入預設路徑的同時,能夠實時監視射頻針的位置和進展,而且能立即校正與預設路徑的偏差,更精準地穿刺,能帶來更好的消融效果。
3D iGuide穿刺技術應用經驗:DyanCT成像和實時透視受患者呼吸運動影響較大,為減少呼吸運動偽影的影響,本研究使用局部麻醉,而未對患者使用全麻;局麻下雖然患者術中需耐受更多痛苦,但患者擁有意識,可以在醫生穿刺時聽從囑咐進行屏氣,同時術中應常規給予利多卡因,以減輕患者痛感。另外,應選擇合適長度的射頻針,過長型號的射頻針對C臂旋轉空間要求大,可能會干擾C臂旋轉掃描,阻礙治療的進行。
綜上所述,3D iGuide穿刺技術在DynaCT引導射頻消融治療大肝癌中安全、有效且操作簡便,具有極強的可行性,為RFA治療大肝癌提供新的引導方法,值得臨床推廣。
參考文獻
[1]Jaffray DA,Siewerdsen JH.Cone-beam computed tomography with a flat-panel imager:initial performance characterization[J].Med Phys,2000,27(6):1311-1323.doi:10.1118/1.599009.
[2]Horner K,O'Malley L,Taylor K,et al.Guidelines for clinical use of CBCT:a review [J].Dentomaxillofac Radiol,2015,44(1):20140225.doi:10.1259/dmfr.20140225.
[3]El-Sayed H,Ramlawi B.The current status of endovascular repair of thoracic aortic aneurysms(TEVAR)[J].Methodist Debakey Cardiovasc J,2011,7(3):15-19.
[4]郝偉遠,虞希祥.C臂CT在肝癌診斷與介入治療中的應用現狀[J].實用放射學雜志,2011,27(5):788-791.doi:10.3969/j.issn.1002-1671.2011.05.037.
[5]Kato K,Abe H,Ika M,et al.C-arm cone beam computed tomography guidance for radiofrequency ablation in hepatocellular carcinoma[J].Oncology,2017,92 (3):142-152.doi:10.1159/000453665.
[6]Morimoto M,Numata K,Kondo M,et al.C-arm cone beam CT for hepatic tumor ablation under real-time 3D imaging[J].AJR Am J Roentgenol,2010,194(5):W452-454.doi:10.2214/AJR.09.3514.
[7]Jiao DC,Han XW,Wu G,et al.3D CACT-assisted radiofrequency ablation following transarterial chemoembolization for hepatocellular carcinoma:early experience[J].Asian Pac J Cancer Prev, 2015,16 (17):7897-7903.doi:10.7314/APJCP.2015.16.17.7897.
[8]Tateishi R,Shiina S,Teratani T,et al.Percutaneous radiofrequency ablation for hepatocellular carcinoma.An analysis of 1000 cases[J].Cancer,2005,103(6):1201-1209.doi:10.1002/cncr.20892.
[9]Widmann G,Schullian P,Bale R.Radiofrequency ablation of hepatocellular carcinoma[J].Wien Med Wochenschr,2013,163(5-6): 132-136.
[10]楊楓,張抒,劉展,等.多電極射頻消融治療大肝癌的近期療效評價 [J]. 中華消化外科雜志,2002,1(5):362-364.doi:10.3760/cma.j.issn.1673-9752.2002.05.021.
[11]Lin SM.Ultrasonography-guided radiofrequency ablation in hepatocellular carcinoma:current status and future perspectives[J].J Med Ultrasound,2013,21 (1):9-15.doi:10.1016/j.jmu.2013.01.010
[12]武金玉,林淑芝,吳薇,等.超聲引導射頻消融治療鄰近肝表面的原發性肝癌 [J]. 中華腫瘤雜志,2015,37(12):933-937.doi:10.3760/cma.j.issn.0253-3766.2015.12.012.
[13]Lee LH,Hwang JI,Cheng YC,et al.Comparable outcomes of ultrasound versus computed tomography in the guidance of radiofrequency ablation for hepatocellular carcinoma[J].PLoS One,2017,12(1):e0169655.doi:10.1371/journal.pone.0169655.
[14]Yang W,Chen MH.Treatment strategy and efficacy of imagingguided radiofrequency ablation in large hepatocellular carcinoma[J].Journal of Microwave Surgery,2009,27:27-32.doi:10.3380/jmicrowavesurg.27.27.
[15]Livraghi T,Goldberg S N,Lazzaroni S,et al.Hepatocellular carcinoma:radio-frequency ablation of medium and large lesions[J].Radiology,2000,214 (3):761-768.doi:10.1148/radiology.214.3.r00mr02761.
[16]Heran NS,Song JK,Namba K,et al.The utility of DynaCT in neuroendovascular procedures[J].AJNR Am J Neuroradiol,2006,27(2): 330-332.
[17]陳文會,江旭,楊繼金,等.CT引導介入操作中患者有效輻射劑量的研究 [J].介入放射學雜志,2012,21(7):570-573.doi:10.3969/j.issn.1008-794X.2012.07.010.

