不同治療方案對晚期肝細胞性肝癌預后的影響及因素分析
王磊 咸玉濤 楊正強 施海彬
肝細胞肝癌(HCC)的致死率位列全球惡性腫瘤第二位,發病率位列第六位[1-2]。根據巴塞羅那分期系統,患者出現門靜脈癌栓或者出現肝外轉移即處于晚期。在中國,大部分患者在被診斷出HCC時已經處于晚期[3]。晚期HCC患者的預后相對較差且治療困難。目前巴塞羅那系統僅推薦索拉菲尼作為晚期HCC的標準治療[4]。然而由于費用較高、不良反應較多等原因,索拉菲尼并未被臨床廣泛使用。近年來,多份研究表明肝動脈化療栓塞術(TACE)、立體定向放射治療(SBRT)等治療晚期HCC安全且有效[5-9]。隨著治療方式的改進與發展,晚期HCC的療效也逐步改善。
本文旨在分析晚期HCC的預后影響因素以及對比治療方案,以期為臨床工作中晚期HCC預后的評估以及治療方案的選擇提供參考。
對象與方法
一、研究對象
選取2014年1—12月在南京醫科大學第一附屬醫院收治的237例晚期HCC患者,HCC的診斷參照中國抗癌協會肝癌專業委員會制定的《原發性肝癌的臨床診斷與分期標準》[10]。診斷及分類標準參照美國腫瘤研究聯合會(AJCC)和國際抗癌聯盟(UICC)共同制定的第七版腫瘤分期系統[11]。按如下標準納入研究對象:(1)從未接受過肝癌相關治療;(2) 合并門靜脈癌栓或者肝外轉移;(3)Child-Pugh分級為A級或者B級;(4)美國東部腫瘤協作組活動狀態評分(ECOG)0~2分;(5)不合并其他原發性惡性腫瘤。門靜脈癌栓通過增強CT或者MR診斷,門靜脈癌栓分類如下:I型,癌栓累及門靜脈二級分支及以下;II型,癌栓累及門靜脈左支和/或右支;III型,癌栓累及門靜脈主干及以上。肝外轉移通過CT、MR、PET/CT以及ECT診斷,分為淋巴結轉移和遠處轉移。最終133例患者符合入選標準,男105例,女28例,平均年齡(58±12)歲。其中,90例僅合并門靜脈癌栓,22例僅合并肝外轉移,21例同時合并門靜脈癌栓和肝外轉移。患者的基線特征見表1。按治療治療方案不同分為3組:(1)保守治療58例;(2)單純TACE治療58例;(3) 聯合治療17例,其中TACE聯合索拉菲尼治療12例,TACE聯合SBRT治療5例。
二、治療方式
TACE即股動脈穿刺插管并超選至腫瘤供血動脈,栓塞化療藥物與超液化碘油制成的乳劑5~15 ml(栓塞劑量視病灶情況及血管豐富程度而定),必要時加用明膠海綿強化栓塞。SBRT即采用立體定向放射治療系統,在圖像引導下進行放療。保守治療包括對癥治療、支持治療、中藥調理等。索拉菲尼治療即每次口服400 mg索拉菲尼,每天2次,并根據患者反應情況減量或延遲使用。
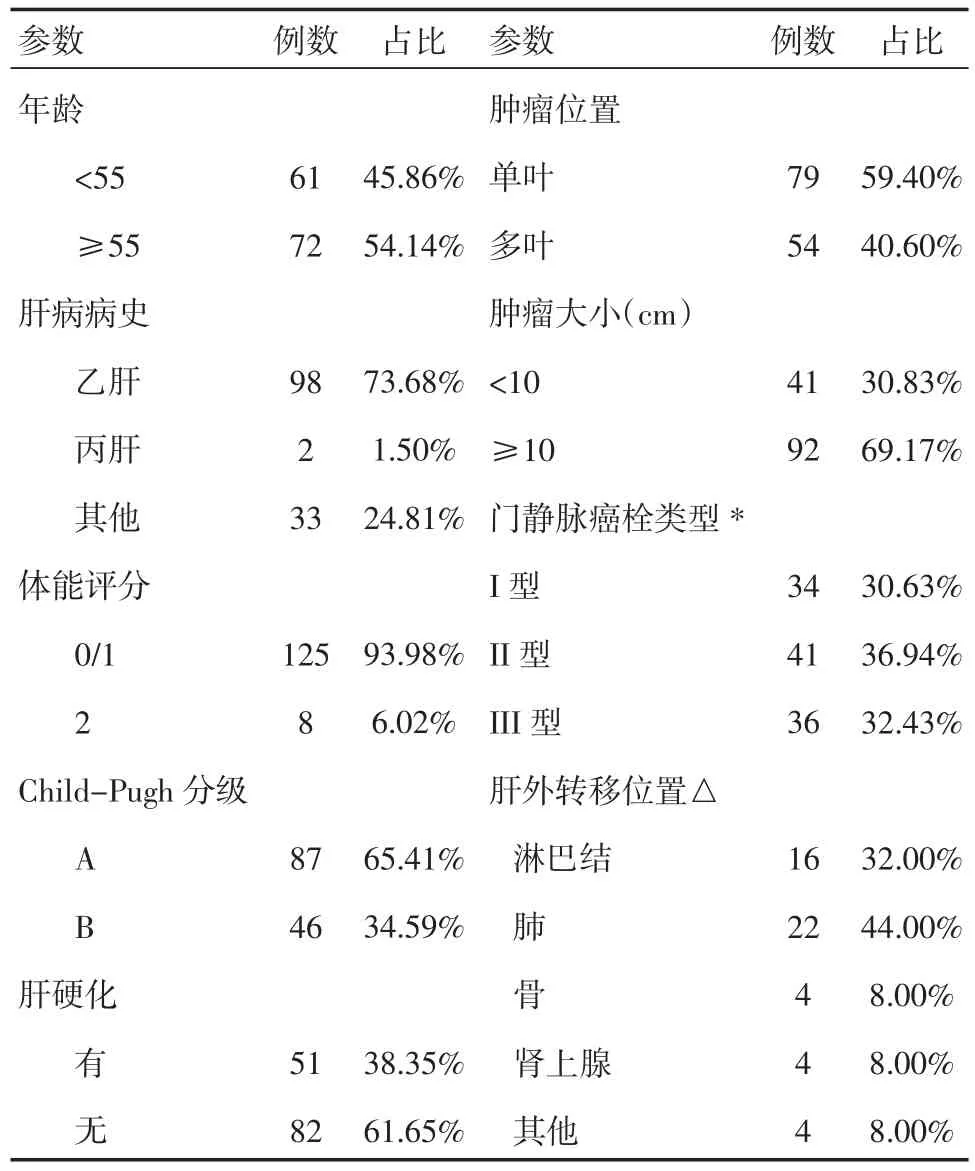
表1 133例晚期肝細胞性肝癌患者的基線特征
三、觀察指標及隨訪
詳細采集所有患者的臨床資料、實驗室數據、影像資料等,包括患者性別、年齡、基礎肝病、ECOG評分、肝功能、Child-Pugh評分、肝內腫瘤特征、門脈癌栓類型、肝外轉移位置以及治療方式。
所有患者均密切隨訪,包括患者后續治療方式以及生存狀況。總體隨訪時間為2014年1月至2016年6月,患者生存時間統一計算為入選時間至死亡或者隨訪結束時間(即2016年6月30日)。
四、統計學方法
應用SPSS 22.0軟件進行統計分析,計數資料采用卡方檢驗,用Cox單因素以及多因素回歸分析生存期的影響因素,將單因素中P<0.1的因素納入多因素分析。用Kaplan-Meier法繪制生存曲線,Log-rank時序檢驗比較患者生存期差異。以P<0.05為差異有統計學意義。
結 果
一、133例晚期肝細胞性肝癌患者的生存情況
至隨訪結束時,24例患者存活,95例患者死亡,14例患者失訪。中位生存期為7.6個月,半年、1年、2年的生存率分別為57%、30%、12%。
二、133例晚期肝細胞性肝癌患者預后的影響因素分析
單因素Cox回歸分析顯示,腹水量、Child-Pugh分級、門靜脈癌栓類型、肝外轉移類型、谷草轉氨酶水平、白蛋白水平、總膽紅素水平、淋巴細胞計數、凝血酶原時間、甲胎蛋白(AFP)水平等10項指標與預后有關。多因素Cox分析顯示Child-Pugh分級為B級、門靜脈癌栓類型為Ⅲ型、肝外轉移類型為遠處轉移以及AFP水平高是影響晚期HCC預后的獨立危險因素,見表2。
三、不同治療方式患者的生存情況比較
從治療方案來分析:3組患者生存期有明顯差異,聯合治療明顯優于單純TACE治療(P=0.005),單純TACE治療明顯優于保守治療(P<0.001),圖1A。
從4種治療方式分析:TACE聯合索拉菲尼與TACE聯合SBRT差異無統計學意義(P=0.316),但均優于單純TACE和保守治療(P<0.01),且單純TACE治療明顯優于保守治療(P<0.001),見圖1B。
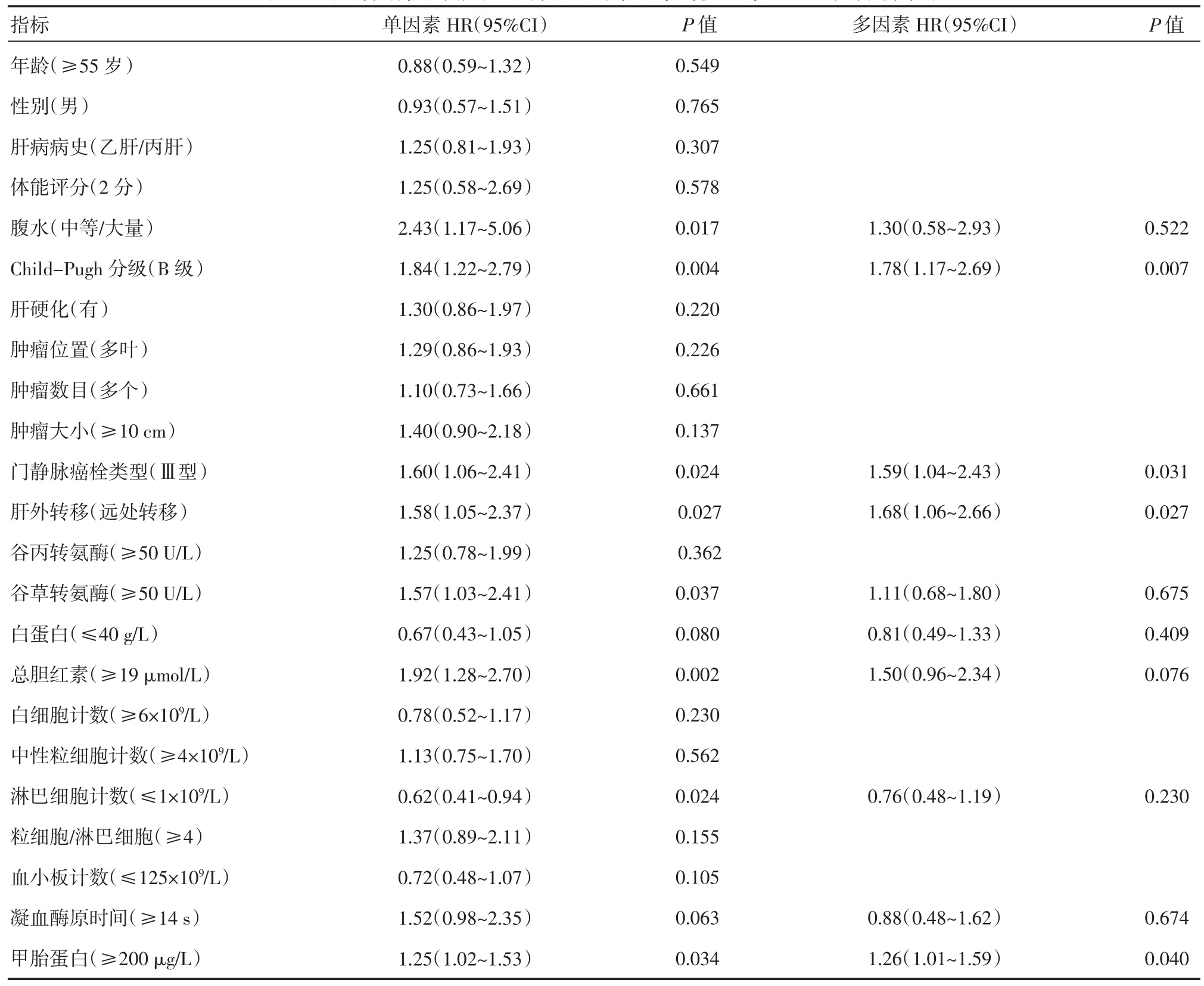
表2 影響晚期肝細胞性肝癌預后的單因素與多因素Cox回歸分析結果
四、不同Child-Pugh分級患者的生存情況比較
Child-Pugh A級患者的生存期優于B級患者,差異有統計學意義(P=0.003),見圖2A。對于Child-Pugh A級患者,治療方案不同,患者生存期也明顯不同,聯合治療明顯優于單純TACE治療(P=0.013),單純TACE治療明顯優于保守治療(P=0.015),見圖2B。對于Child-Pugh B級患者,同樣發現此結果,聯合治療明顯優于單純TACE治療(P=0.025),單純TACE治療明顯優于保守治療(P=0.023),見圖 2C。
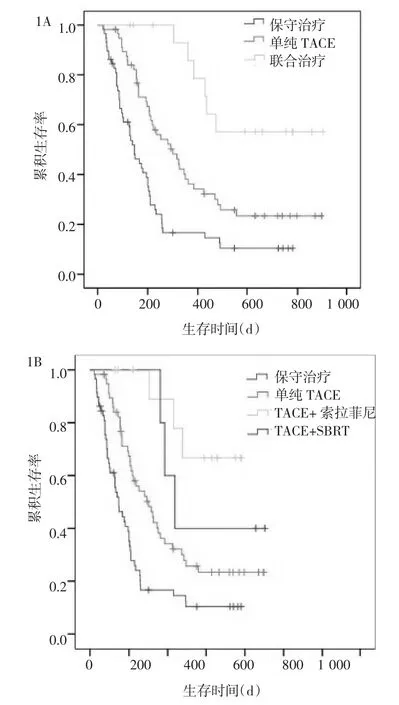
圖1 不同治療方式對晚期肝細胞性肝癌患者生存曲線的影響
討 論
我國HCC的發病率和致死率均居世界首位[1],并且由于惡性程度高、發病隱匿等原因,大部分患者被診斷為HCC已經處于晚期[3]。因為一旦發現門靜脈癌栓或者肝外轉移,不論癌栓類型和轉移部位,患者均被判定為晚期HCC,所以晚期HCC患者病情差異很大,臨床工作中對晚期HCC預后的估計較為困難,同時治療方案的選擇也頗為復雜。
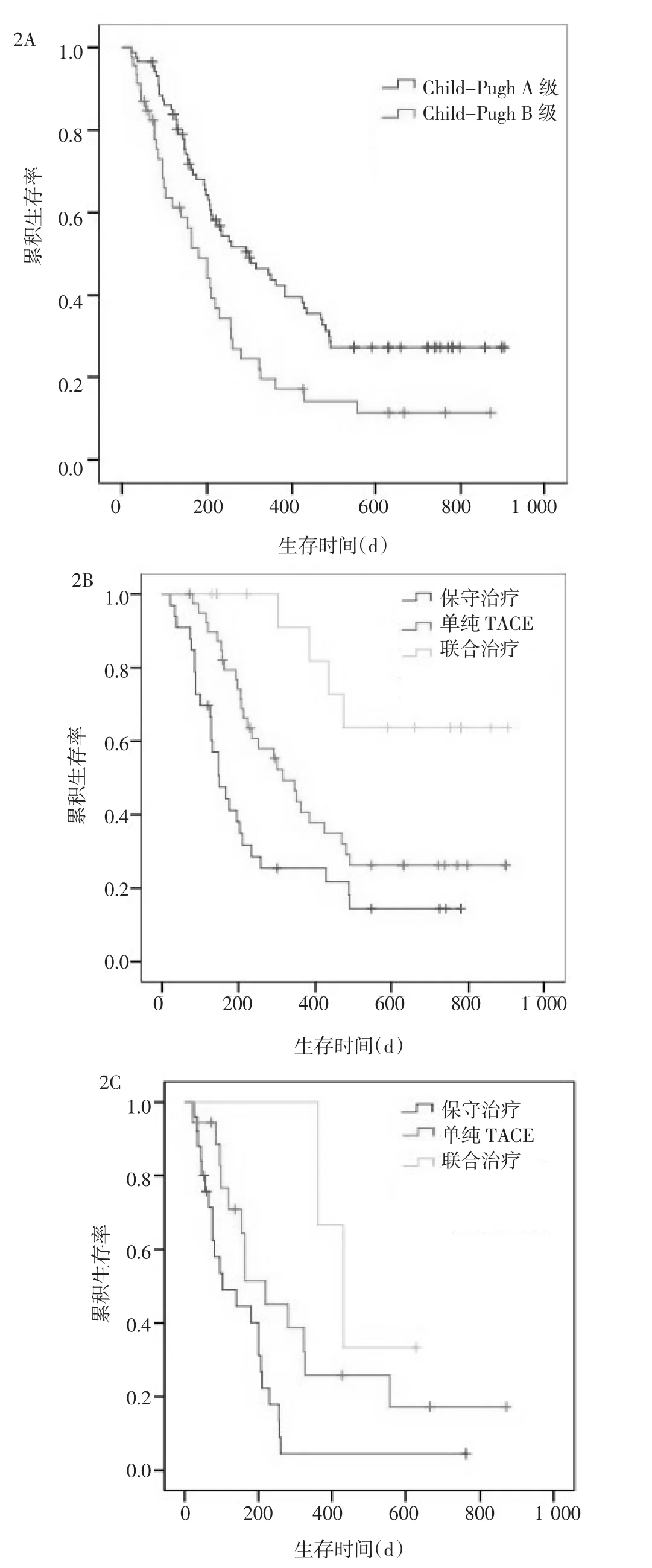
圖2 不同Child-Pugh分級晚期肝細胞性肝癌患者的生存曲線
本文回顧性分析我院2014年全年133例晚期HCC患者資料,結果顯示患者的中位生存期為7.6個月,半年、1年、2年的生存率分別為57%、30%、12%。患者Child-Pugh分級為B級、門靜脈癌栓類型為Ⅲ型、肝外轉移類型為遠處轉移以及AFP水平高是影響晚期HCC預后的獨立危險因素。Child-Pugh分級A級與B級患者生存期差異顯著,分別為10個月和6個月,A級明顯優于B級。肝功能不僅直接關系到患者預后,同時還影響患者治療方案的選擇,所以晚期HCC患者需非常重視肝功能的保護。門靜脈癌栓類型和肝外轉移類型也是患者預后的獨立影響因素,因為其可以反映患者病情嚴重程度,從而影響治療方案的選擇。
治療方法上,TACE聯合索拉菲尼與TACE聯合SBRT患者的生存期無明顯差異。遂將治療方案分為3類:聯合治療組、單純TACE組、保守治療組,結果顯示生存期聯合治療組>單純TACE組>保守治療組。將患者按照Child-Pugh分級分為A、B級,A級患者的生存期優于B級,兩組內的生存期也均是聯合治療組>單純TACE組>保守治療組。
索拉菲尼通過抑制RFA/MEK/ERK信號通路,直接抑制腫瘤生長,同時可抑制血管內皮生長因子(vascular endothelial growth factor,VEGF) 受體和血小板衍生生長因子(Platelet derived growth factor,PDGF)受體,阻斷腫瘤新生血管生成,抑制腫瘤細胞生長[12-13],為聯合治療提供理論基礎。TACE聯合索拉菲尼治療可有效控制肝內和肝外病灶生長,減少腫瘤的復發與轉移。對于無法接受索拉菲尼的患者,TACE聯合SBRT也是一種可行的方案[8-9]。對于無法行聯合治療的患者,單純TACE治療也可作為一種治療方案,安全有效。
參考文獻
[1]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2): 87-108.
[2]Forner A,Llovet JM,Bruix J.Hepatocellular carcinoma[J].Lancet,2012,379(9822): 1245-1255.
[3]Park JW,Chen M,Colombo M,et al.Global patterns of hepatocellular carcinoma management from diagnosis to death:the BRIDGE Study[J].Liver Int,2015,35(9):2155-2166.
[4]Llovet JM,Ricci S,Mazzaferro V,et al.Sorafenib in advanced hepatocellular carcinoma[J].N Engl J Med,2008,359(4):378-390.
[5]李蘭起,鮑堯堂.肝癌介入治療的進展 [J].實用放射學雜志,2001,17(3):219-221.
[6]安鋒,韓國宏,郭永斌,等.經肝動脈化療栓塞治療中晚期肝癌療效及預后影響因素分析[J].胃腸病學和肝病學雜志,2006,15(4):401-404.
[7]Liu L,Zhang C,Zhao Y,et al.Transarterial chemoembolization for the treatment of advanced hepatocellular carcinoma with portal vein tumor thrombosis:prognostic factors in a single-center study of 188 patients[J].Biomed Res Int,2014,2014: 194278.
[8]張波,李曉敏,李巧芳,等.三維適形放療聯合肝動脈化療栓塞術治療中晚期肝癌的臨床研究 [J].胃腸病學和肝病學雜志,2014,23(7): 816-818.
[9]Nakazawa T,Hidaka H,Shibuya A,et al.Overall survival in response to sorafenib versus radiotherapy in unresectable hepatocellular carcinoma with major portal vein tumor thrombosis:propensity score analysis[J].BMC Gastroenterol,2014,14: 84.
[10]中國抗癌協會肝癌專業委員會.原發性肝癌的臨床診斷與分期標準[J].中華肝臟病學雜志,2001,9(6):324.
[11]Edge SB,Compton CC.The American Joint Committee on Cancer:the 7th edition of the AJCC cancer staging manual and the future of TNM[J].Ann Surg Oncol,2010,17(6): 1471-1474.
[12]Cheng AL,Kang YK,Chen Z,et al.Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised,double-blind,placebocontrolled trial[J].Lancet Oncol,2009,10(1):25-34.
[13]Cabrera R,Pannu DS,Caridi J,et al.The combination of sorafenib with transarterial chemoembolisation for hepatocellular carcinoma[J].Aliment Pharmacol Ther,2011,34(2):205-213.

