銀屑病患者外周血濾泡輔助性T細胞比例、血清IL-21水平變化及其與病情的關系
呂萌,沈萃萃
(廣州中醫藥大學臨床醫學院,廣州510405)
銀屑病是一種自身免疫性疾病,其發病機制尚未完全明確,可能與遺傳、內分泌、免疫功能異常及微循環障礙等有關[1,2]。濾泡輔助性T細胞(Tfh)是近年發現的CD4+T細胞亞群[3,4],已被證實可參與自身免疫性疾病的發生。Tfh主要以膜表面表達CXC趨化因子受體5(CXCR5)以及誘導共刺激分子(ICOS)表達等為特征[5]。CXCR5是Tfh區別于其他CD4+T細胞的標志,ICOS表達在活化Tfh細胞中。Tfh可分泌IL-21[6],但血清IL-21并不全是由Tfh分泌,輔助性T細胞17(Th17)也能分泌IL-21。本研究觀察了銀屑病患者外周血Tfh、活化Tfh、Th17比例及血清IL-21水平變化,并探討其在銀屑病發生、發展中的作用。
1 資料與方法
1.1 臨床資料 選擇2015年10月~2017年2月廣州中醫藥大學第一附屬醫院收治的銀屑病患者77例(觀察組),男44例、女33例,年齡33~62(44.2±5.3)歲,銀屑病皮損面積與嚴重程度評分(PASI評分)[7](總分72分,得分越高,病情越重)≥10分42例、<10分35例。所有患者符合趙辯主編《臨床皮膚病學》[8]中的相關診斷標準。排除自身免疫系統疾病、感染性疾病以及其他慢性疾病者,入院前30天內接受過可能會影響免疫功能的藥物治療者,合并惡性腫瘤者。另選同期在廣州中醫藥大學第一附屬醫院接受體檢的健康者70例(對照組),男41例、女29例,年齡32~63(44.4±5.5)歲。兩組性別、年齡具有可比性。本研究經廣州中醫藥大學第一附屬醫院醫學倫理委員會批準,患者均知情同意。
1.2 外周血Tfh(CD4+CXCR5+T細胞)、活化Tfh(CD4+CXCR5+ICOS+T細胞)及Th17比例檢測 所有研究對象(觀察組入院次日)采集清晨空腹靜脈血6 mL,均分為2份,取任意一份EDTA抗凝,與等體積的PBS混勻,加入Ficoll淋巴細胞分離液獲取外周血單個核細胞;將單個核細胞保存在含有10%胎牛血清的二甲基亞砜培養液中。用PBS重懸上述細胞,分別加入CD45-PC7、CD3-ECD、CD4-FITC、CXCR5-PC以及ICOS-PE抗體各20 μL,充分震蕩后置于陰暗處孵育20 min。滴加PBS 2 mL,離心后去除上清液,重復洗滌2次;滴加PBS 500 μL重懸,流式細胞儀檢測CD4+CXCR5+T細胞、CD4+CXCR5+ICOS+T細胞。采用RPMI 1640培養液調整上述單個核細胞密度為8.0×105個/mL,隨后將細胞懸液接種于6孔板中,加入50 ng/mL的佛波酯、500 ng/mL離子霉素、1 mmol/L布雷非德菌素A,在37 ℃、5% CO2培養箱中培養4 h,加入CD45-PC7、CD3-ECD、CD8-PE各20 μL,室溫避光條件下孵育20 min,PBS重復洗滌2次,離心處理去除上清液;固定劑固定15 min,PBS洗滌1次,離心處理去除上清液;加入破膜劑在室溫下孵育5 min,離心處理去除上清液;加入IL-17抗體,室溫避光條件下孵育20 min,離心處理去除上清液;加入PBS 500 μL重懸,上流式細胞儀檢測Th17。
1.3 血清IL-21檢測 取另一份空腹靜脈血標本,分離血清后采用ELISA法檢測血清IL-21。嚴格按照試劑盒說明書操作。

2 結果
2.1 兩組外周血Tfh、活化Tfh、Th17比例及血清IL-21水平比較 觀察組外周血Tfh、活化Tfh、Th17比例及血清IL-21水平均高于對照組(P均<0.05)。見表1。
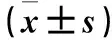
表1 兩組外周血Tfh、活化Tfh、Th17比例及血清IL-21水平比較
注:與對照組比較,*P<0.05。
2.2 觀察組PASI評分≥10分者與<10分者外周血Tfh、活化Tfh、Th17比例及血清IL-21水平比較 觀察組PASI評分≥10分者外周血活化Tfh比例及血清IL-21水平均高于PASI評分<10分者(P均<0.05),但二者外周血Tfh、Th17比例比較P均>0.05。見表2。
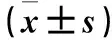
表2 觀察組PASI評分≥10分者與<10分者外周血Tfh、 活化Tfh、Th17比例及血清IL-21水平比較
注:與PASI評分<10分者比較,*P<0.05。
3 討論
研究認為,免疫功能異常可參與銀屑病發生、發展[9,10]。Tfh是一種功能強大的T細胞亞群,是CD4+效應T細胞的一個亞群,因其表達CXCR5和IL-21等,故可存在于淋巴濾泡中并輔助B細胞活化和分化。IL-21為Tfh分泌的主要細胞因子,也是其最主要的效應執行分子。目前主要通過檢測T細胞表面CXCR5和ICOS蛋白的方法來確定Tfh。外周血Tfh比例在多種自身免疫性疾病患者(如系統性紅斑狼瘡)中升高,故筆者推測Tfh細胞可能參與銀屑病的發生、發展。國內外多項研究報道,自身免疫性疾病患者外周血Tfh比例明顯升高,且其升高程度和致病性抗體水平呈正相關關系,提示外周血Tfh可參與自身免疫性疾病的發生。本研究結果顯示,觀察組外周血Tfh、活化Tfh比例均明顯高于對照組。表明外周血Tfh在銀屑病的發生、發展過程中具有至關重要的作用。薛國輝等[11,12]報道,銀屑病患者外周血Tfh比例升高,本研究結果與之相符。表明外周血Tfh在銀屑病的發生、發展過程中具有重要作用。觀察組外周血Th17比例明顯高于對照組,表明Th17細胞也可能參與了銀屑病的發生、發展過程,與文獻[13~16]報道相符。觀察組血清IL-21水平明顯高于對照組,表明IL-21作為Thf的效應分子參與銀屑病的發生、發展。
本研究結果顯示,觀察組PASI評分≥10分者外周血活化Tfh比例及血清IL-21水平均明顯高于PASI評分<10分者,表明檢測外周血活化Tfh比例及血清IL-21水平有助于患者病情判斷。Tfh細胞可自分泌或旁分泌IL-21,Th17也可分泌IL-21。綜合本研究結果,筆者認為觀察組血清IL-21水平高于對照組是由于活化Tfh比例升高而不是由于Th17分泌增多所致。表達ICOS的活化Tfh可能是在銀屑病發病過程中起致病作用的主要效應細胞,其可嚴重影響Tfh的存活狀態,同時對Tfh分泌IL-21的能力進行調控。因此認為,活化Tfh可能是通過調控IL-21的分泌而參與銀屑病的發生、發展。活化Tfh可調控IL-21的分泌,影響外周血IL-21水平,繼而影響炎癥反應過程,導致銀屑病的發生、發展。
綜上所述,檢測外周血活化Tfh比例及血清IL-21水平有助于輔助評估銀屑病患者病情。
參考文獻:
[1] Deng J, Yao D, Lu C, et al. Oral Chinese herbal medicine for psoriasis vulgaris: protocol for a randomised, double-blind, double-dummy, multicentre clinical trial[J]. BMJ Open, 2017,7(11):14475-14476.
[2] 樊超,向華國,陳宏翔,等.紅斑型銀屑病患者他克莫司治療前后IL-17A、IL-22和IL-6的變化分析[J].醫學分子生物學雜志,2016,13(5):276-280.
[3] Sawatsubashi S.Update on recent progress in vitamin D research. Vitamin D in the treatment of psoriasis[J]. Clin Calcium, 2017,27(11):1629-1635.
[4] 王潔,徐蓉,李斌,等.加味芩珠涼血方聯合他扎羅汀凝膠治療血熱證尋常型銀屑病的療效觀察[J].上海交通大學學報(醫學版),2016,36(11):1610-1612.
[5] 雷田兵,羅模桂,劉官智,等.阿維A聯合窄譜中波紫外線治療尋常性銀屑病的療效及其對患者外周血細胞因子IFN-γ、IL-4及IL-17的影響[J].海南醫學,2016,27(13):2118-2120.
[6] 葉柱均,葉耀佳,葉錦波,等.尋常型銀屑病患者血清IL-17、IL-22水平檢測及其與病情相關性探討[J].中國醫藥科學,2016,6(12):216-218.
[7] 楊璐,鄭擎,任雅君,等.卡介菌多糖核酸聯合紫外線光療對銀屑病患者細胞免疫功能影響[J].浙江醫學,2017,39(7):512-514.
[8] 葉柱均,葉淑霞,陳麗仙,等.IL-17、IL-22和CRP在銀屑病患者血清中的表達[J].國際檢驗醫學雜志,2016,31(2):254-255.
[9] 吳麗興,陳長鏡,羅軍敏,等.Th17細胞及其相關因子在銀屑病發病中的作用及其分子機制[J].細胞與分子免疫學雜志,2015,31(2):282-284.
[10] 湯雯劍,羅浩,趙金濤,等.銀屑病患者血清中IL-10與IL-21水平監測的臨床應用[J].現代檢驗醫學雜志,2015,30(2):65-67.
[11] 薛國輝,華琳,劉曉峰,等.外周血循環濾泡輔助性T細胞及IL-21在銀屑病中的表達及意義[J].中國免疫學雜志,2016,32(11):1645-1648.
[12] 王曉琴,慕珍珍,韓秀萍,等.CCL20、CCR6及IL-17A在尋常型銀屑病患者血清中的表達及意義[J].中國中西醫結合皮膚性病學雜志,2017,16(2):122-124.
[13] 房武寧.尋常型銀屑病患者血清IL-21及IL-31的表達及臨床意義[J].現代中西醫結合雜志,2016,25(12):1297-1299.
[14] 劉秀卿,李卓成,吳文中,等.雷公藤多苷對咪喹莫特誘導銀屑病樣小鼠Wnt/Frizzled信號傳導通路的影響[J].海南醫學院學報,2016,22(11):1044-1047.
[15] Shin D, Kim DS, Kim SH, et al. Decreased PD-1 positive blood follicular helper T cells in patients with psoriasis[J]. Arch Dermatol Res, 2016,308(8):593-599.
[16] Niu J, Song Z, Yang X, et al. Increased circulating follicular helper T cells and activated B cells correlate with disease severity in patients with psoriasis[J]. J Eur Acad Dermatol Venereol, 2015,29(9):1791-1796.

