房顫患者射頻消融術前心電圖f波振幅與病情及左心房纖維化的關系
夏鶯,喻杰,付勇南,文淵,殷然
(1江西省人民醫院,南昌330006;2南昌大學第一附屬醫院)
心房纖維化是心房顫動(簡稱房顫)發生、發展的病理基礎,也是影響房顫患者射頻消融療效的重要因素[1,2]。目前臨床上評估心房纖維化的方法主要有左房高密度電壓標測、延遲增強磁共振(DE-MRI)、心肌聲學密度分析技術等,均存在有創、昂貴、診斷性能不穩定等缺點,而關于無創檢測指標如心電圖、血清生化標志物等能否用于評估心房纖維化的相關研究較少[3]。研究證實,房顫發生時體表心電圖f波振幅與左心房內徑及射頻消融術后復發等密切相關[4];竇性心律條件下對左心房進行基質標測并通過設定恰當的電壓閾值所得到的低電壓區及瘢痕區與DE-MRI檢查顯示的心房纖維化區域基本吻合[5],可作為評價心房纖維化程度的方式之一。本研究觀察了不同臨床分型的房顫患者射頻消融術前心電圖f波振幅改變,并探討其與左心房基質標測所得纖維化區域面積的關系,以期為心電圖f波振幅在心房纖維化程度評價中的應用提供依據。
1 資料與方法
1.1 臨床資料 選擇2013年1月~2014年12月在江西省人民醫院接受射頻消融術的房顫患者96例,根據臨床分型分為陣發性房顫患者59例(Pa-Af組)、持續性房顫患者22例(Pe-Af組)、長程持續性房顫患者15例(Lsp-Af組)。所有患者符合房顫診療指南射頻消融適應證[6]。排除標準:①合并嚴重器質性疾病,包括肝腎功能不全、風濕性心臟病、肥厚型心肌病、擴張型心肌病、冠心病、三度房室傳導阻滯等;②年齡>75歲;③合并甲狀腺功能亢進;④食管超聲心動圖檢查顯示合并左心房血栓形成;⑤左心房直徑>55 mm;⑥肺靜脈多排螺旋CT造影檢查顯示肺靜脈形態和解剖變異。Pa-Af組男35例、女24例,年齡(56.3±20.1)歲,病程(27.3±11.8)個月,合并高血壓15例、糖尿病7例,左心房內徑(LAD)為(36.8±3.1)mm,左室射血分數(LVEF)為(58.1±6.3)%。Pe-Af組男12例、女10例,年齡(55.6±18.7)歲,病程(23.6±13.5)個月,合并高血壓6例、糖尿病3例;LAD為(41.5±4.3)mm,LVEF為(55.4±5.8)%。Lsp-Af組男9例、女6例,年齡(57.2±19.3)歲,病程(39.6±17.1)個月,合并高血壓4例、糖尿病2例,LAD為(48.7±6.4)mm,LVEF為(54.6±5.4)%。Lsp-Af組病程長于Pa-Af組和Pe-Af組,LAD高于Pa-Af組和Pe-Af組(P均<0.05),三組間性別、年齡、LVEF、合并疾病等均具有可比性。本研究經江西省人民醫院醫學倫理委員會批準,患者及家屬均知情同意。
1.2 心電圖f波振幅檢測 三組手術前均行心電圖檢查。患者于平靜狀態下取平臥位,采用Kenz108型心電圖機(日本Suzuken公司)描記V1長導聯24 s,走紙速度為50 mm/s,定標電壓為20 mm/mV。為避免QRS綜合波、T波及U波的影響,自QRS波后2~3個f波開始測量,共測量20個f波振幅,取其平均值。f波振幅(mV)=波峰垂直至波谷的距離(mm)×0.05,即得到常規走紙速度(25 mm/s)和定標電壓(10 mm/mV)條件下的f波振幅[6]。
1.3 射頻消融手術及左心房纖維化區域面積檢測 兩組均由 Ensite Velocity3.0系統引導下行房顫射頻消融手術。常規建立靜脈輸液通路及鼻導管吸氧。局部麻醉下穿刺左鎖骨下靜脈和股靜脈,放置10極冠狀靜脈竇標測電極和4極右心室標測電極。通過房間隔穿刺置入兩根8.5F Swartz長鞘至左心房,進入左心房后立即給予100 IU/kg肝素靜脈注射,手術每延長1 h追加肝素1 000 IU靜脈注射。通過穿刺鞘行左心房及肺靜脈造影,顯示左心房-肺靜脈連接處。將Lasso電極置于肺靜脈,由Ensite Velocity3.0三維標測系統指引,應用Coolpath冷鹽水灌注消融導管,并在肺靜脈前庭逐點消融。消融儀參數設置:輸出功率30~35 W、溫度43 ℃、鹽水灌流速度 17 mL/min。心電生理儀連續檢測和記錄體表心電圖和雙極心內電圖,消融結束前應用 Lasso導管再次檢查肺靜脈隔離情況[7]。對于經上述射頻消融治療后房顫仍不能終止者,直接應用體外直流電復律轉律。于竇性心律條件下采用Ensite Velocity3.0自帶的電壓標測功能對左心房進行基質標測,記錄左心房低電壓區和瘢痕區分布情況。正常電壓點定義為雙極電壓>0.5 mV,電解剖模型上顯示為紫色;低電壓點定義為雙極電壓為0.1~0.5 mV,電解剖模型上顯示為紫色與灰色之間的過渡色;瘢痕點定義為雙極電壓<0.1 mV或導管貼靠較好但電位標記不到[8],電解剖模型上顯示為灰色。于電壓圖上顯示瘢痕點、低電壓點,其分布區域分別為瘢痕區及低電壓區,使用離線軟件中面積計算工具計算兩者面積,以兩者面積占左心房面積的百分比表示左心房纖維化區域面積。分析f波振幅與左心房纖維化面積的關系。

2 結果
Pa-Af組心電圖f波振幅明顯高于Pe-Af組、Lsp-Af組,Pe-Af組明顯高于Lsp-Af組(P均<0.05)。Pa-Af組左心房纖維化區域面積比例明顯低于Pe-Af組、Lsp-Af組,Pe-Af組明顯低于Lsp-Af組(P均<0.05)。見表1。Spearman秩相關分析顯示,心電圖f波振幅與左心房纖維化區域面積比例呈負相關關系(r=-0.393,P<0.05)。
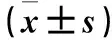
表1 各組心電圖f波振幅、左心房纖維化區域面積比例比較
注:與Lsp-Af組比較,*P<0.05;與Pe-Af組比較,#P<0.05。
3 討論
近年來,以三維電解剖標測系統指導下環肺靜脈前庭電隔離為基礎的射頻消融術得到大規模臨床應用,為房顫的根治帶來了希望,但射頻消融的療效尚不盡如人意。陣發性房顫患者射頻消融術治療成功率約為70%,而持續性和長程持續性房顫患者術后復發率為30%~50%[1]。房顫患者射頻消融術后復發的一個重要原因是心房纖維化,心房纖維化與房顫互為因果關系,一方面心房纖維化是房顫發生并持續的結構基礎,另一方面長期房顫能使心房發生電解剖重構,從而加劇心房纖維化[2~4]。纖維化的心肌電壓低于正常心肌,利用腔內電極感應技術高密度標測心腔內各區電壓值能間接反映心肌纖維化水平,但該方法有創且無法在術前完成[5]。以超聲背向散射積分為基礎的心肌聲學密度分析技術已初步應用于心肌纖維化分析,但探查聲窗具有一定的局限性,且回聲特征的非特異性問題仍亟待解決。DE-MRI技術通過給心肌注入對比劑后進行增強磁共振,可發現纖維化心肌明顯比正常心肌延遲增強。有研究對擬行射頻消融術的房顫患者術前行DE-MRI檢查并定量分析心房纖維化程度,隨訪顯示纖維化水平越高者術后復發率越高[9,10]。但DE-MRI需要患者長時間屏氣,引起的心律不齊等會影響圖像的精準度,且該檢測價格昂貴,限制了其在臨床中的應用。
房顫的診斷依賴12導聯體表心電圖,表現為心房規律有序的電活動喪失,代之以快速無序的顫動波,即f波。根據f波振幅大小可將房顫分為細顫(<0.1 mV)和粗顫(≥0.1 mV)。研究發現,f波振幅與房顫病史、左心房內徑密切相關[11~13];f波振幅>0.1 mV患者術中消融終止房顫的概率較高,術后復發率則較低[14,15]。實際上f波振幅取決于心房除極的綜合向量,同一時間心房除極的綜合向量越大,體表心電圖f波振幅就越高。與正常心肌相比,纖維化心肌一方面引起電傳導不均導致局部傳導阻滯或折返,另一方面亦會導致除極的心肌細胞數量減少和除極時間延長,從而可能造成體表心電圖f波振幅降低。因此,我們推測體表心電圖f波振幅的高低可間接反映心肌纖維化程度。本研究結果顯示,Pa-Af組心電圖f波振幅明顯高于Pe-Af組、Lsp-Af組,Pe-Af組明顯高于Lsp-Af組;而Pa-Af組左心房纖維化區域面積比例明顯低于Pe-Af組、Lsp-Af組,Pe-Af組明顯低于Lsp-Af組。說明隨著房顫的發展,即由陣發性房顫逐漸轉變為持續性或長程持續性房顫過程中,患者左心房纖維化區域面積逐漸增大,體表心電圖f波振幅逐漸降低。本研究Spearman秩相關分析顯示,心電圖f波振幅與左心房纖維化面積比例呈負相關關系。既往研究證實,于竇性心律下對左心房進行基質標測,通過設定恰當的電壓閾值所得到的低電壓區及瘢痕區與DE-MRI探測到的心房纖維化區域基本吻合[15,16]。因此,房顫患者射頻消融術前體表心電圖f波振幅可初步評估左心房纖維化程度,具有簡單易行的特點,對患者病情及預后判斷具有重要的臨床意義。
綜上所述,房顫患者射頻消融術前心電圖f波振幅隨著病情加重而逐漸降低,并與左心房纖維化程度有關。由于本研究樣本量相對較小,體表心電圖f波振幅與左心房纖維化程度的關系及其機制有待于進一步研究證實。
參考文獻:
[1] Cheema A, Dong J, Dalal D, et al. Long term safety and efficacy of circumferential ablation with pulmonary vein isolation[J]. J Cardiovasc Electrophysiol, 2006,17(10):1080-1085.
[2] Marrouche NF, Wilber D, Hindricks G, et al. Association of atrial tissue fibrosis identified by delayed enhancement MRI and atrial fibrillation catheter ablation: the DECAAF study[J]. JAMA, 2014,311(5):498-506.
[3] Kourliouros A, Savelieva I, Kiotsekoglou A, et al. Current concepts in the pathogenesis of atrial fibrillation[J]. Am Heart J, 2009,157(2):243-252.
[4] Wijffels MC, Kirchhof CJ, Dorland R, et al. Atrial fibrillation begets atrial fibrillation: a study in awake chronically instrumented goats[J]. Circulation,1995,92 (7):1954-1968.
[5] Sanders P, Morton J B, Davidson N C, et al. Electrical remodeling of the atria in congestive heart failure: electrophysiological and electroanatomic mapping in humans[J]. Circulation 2003,108(12):1461-1468.
[6] Nault I, Lellouche N, Matsuo S, et al. Clinical value of fibrillatory wave amplitude on surface ECG in patients with persistent atrial fibrillation[J]. J Interv Card Electrophysiol 2009,26(1):11-19.
[7] 殷然,彭景添,李賓公,等.消融導管近遠端激動間距定位左房-肺靜脈電位傳導縫隙的價值[J].中國心臟起搏與心電生理雜志,2014,28(4):322-325.
[8] Verma A, Wazni OM, Marrouche NF, et al. Pre-existing left atrial scarring in patients undergoing pulmonary vein antrum isolation[J]. J Am Coll Cardiol, 2005,45(2):285-292.
[9] Oakes RS, Badger TJ, Kholmovski EG, et al. Detection and quantification of left atrial structural remodeling with delayed-enhancement magnetic resonance imaging in patients with atrial fibrillation[J]. Circulation, 2009,119(13):1758-1767.
[10] Akoum N, Daccarett M, McGann C, et al. Atrial fibrosis helps select the appropriate patient and strategy in catheter ablation of atrial fibrillation: a DE-MRI guided approach[J]. J Cardiovasc Electrophysiol, 2011,22(1):16-22.
[11] Aysha MH, Hassan AS. Diagnostic importance of fibrillatory wave amplitude: a clue to echocardiographic left atrial size and etiology of atrial fibrillation[J]. J Electrocardiol, 1988,21(3):1247-1251.
[12] Morganroth J, Horowitz LN, Josephson ME, et al. Relationship of atrial fibrillatory wave amplitude to left atrial size and etiology of heart disease[J]. Am Heart J, 1989,97(2):184-186.
[13] Xi Q, Sahakian AV, Frohlich TG, et al. Relationship between pattern of occurrence of atrial fibrillation and surface electrocardiographic fibrillatory wave characteristics[J]. Heart Rhythm, 2004,1(6):656-663.
[14] Raygor VP, Ng J, Goldberger JJ. Surface ECG f-wave analysis of dofetilide drug effect in the atrium[J]. J Cardiovasc Electrophysiol, 2015,26(6):644-648.
[15] Lim HS, Derval N, Denis A, et al. Distinct localized reentrant drivers in persistent atrial fibrillation identified by noninvasive mapping: relation to f-wave morphology[J]. Card Electrophysiol Clin, 2015,7(1):153-155.
[16] 李菲,孟旭,韓杰,等.心房顫動患者左心房纖維化對射頻消融術后心律的影響[J].中華胸心血管外科雜志,2013,29(9):537-540.

