線性-樹枝狀嵌段共聚物用于蛋白質藥物的遞送
鐘淵博,王 旭
(山東大學 國家膠體材料工程技術研究中心,山東 濟南 250100)
1 前 言
自從20世紀80年代胰島素作為首個人源重組蛋白質藥物應用于糖尿病的治療開始,蛋白質藥物治療作為一種安全且直接的療法已經取得了長足的發展[1-3]。目前,美國食品藥品監督管理局已經批準130余種蛋白質藥物用于各種疾病的治療[4]。然而由于蛋白質藥物自身結構及性質的特點,其在應用中仍存在著一系列的問題,比如其分子結構復雜、穩定性差易失活、體內半衰期短、穿透細胞膜等生物屏障的能力差等[3]。藥物遞送系統能夠提高蛋白質藥物的穩定性、優化其在體內的代謝動力學和組織分布、提高其生物膜穿透能力,從而提高其藥效[5, 6]。蛋白質的聚乙二醇化(PEGylation)研究已經有很長的歷史,這種方法能夠延長蛋白質藥物在體內的循環時間,提高藥物的穩定性并降低藥物的免疫原性[7-10]。在可生物降解的聚合物微球中封裝蛋白質藥物是另外一種較為常用的提高蛋白質藥物穩定性的方法[11-16]。在各種化學修飾或物理封裝過程中,最重要的一點就是要保留蛋白質的結構及活性。然而,在修飾或封裝過程中所使用的有機溶劑或冷凍干燥等過程可能會造成蛋白質的聚集并在一定程度上破壞蛋白質藥物的結構與活性[17]。將蛋白質藥物封裝在納米凝膠[18, 19]或水凝膠[20, 21]中這一過程無需有機溶劑的參與,也不涉及冷凍干燥等可能破壞蛋白質結構的操作。但是,納米凝膠或水凝膠的制備往往依賴于聚合或化學交聯反應,這會降低蛋白質藥物封裝的可控性,而且進行聚合或交聯時所使用的化學試劑可能會影響這些體系應用于生物體內時的安全性。將蛋白質藥物在中性水溶液中原位負載進入聚合物納米粒子無疑是一種最為安全可靠的封裝方法[22]。蛋白質表面通常含有大量的帶電基團及疏水區域[23, 24],如果能夠根據蛋白質的帶電及疏水區域進行有針對性的聚合物載體設計,通過靜電及疏水作用力的協同效應使聚合物與蛋白質最大程度復合,無疑將大大提高蛋白質藥物封裝的穩定性及可靠性[22]。
2 線性-樹枝狀嵌段共聚物用于蛋白遞送
線性-樹枝狀嵌段共聚物(telodendrimer)[25-27]是由線性聚合物嵌段與樹枝狀嵌段通過化學鍵連接而成的一類拓撲結構的雜化共聚物。兩親性的線性-樹枝狀嵌段共聚物在水溶液中可通過自組裝形成納米粒子,其已被廣泛應用在小分子藥物傳遞領域:Li等[28]合成了可交聯型線性-樹枝狀嵌段共聚物,利用硼酸鹽和鄰苯二酚之間的可逆交聯反應穩定抗癌藥物紫杉醇的封裝;相比于未交聯的納米粒子,交聯后的納米粒子具有更加緩慢藥物釋放速度,并可以通過微酸性或甘露醇的刺激加速藥物的釋放。Kenyon等[29]報道了利用含膽酸的線性-樹枝狀嵌段共聚物納米粒子對地塞米松進行封裝,用于治療哮喘模型小鼠;使用納米粒子封裝的地塞米松組與未封裝的地塞米松組相比,其免疫反應更低,呼吸受阻更低,從而表明納米粒子對抗炎藥物的封裝和保護可提高藥物的使用效果。Zhang等[30]采用聚乙二醇(PEG)及farnesylthiosalicylate構建線性-樹枝狀嵌段共聚物,并利用其封裝紫杉醇治療胸腺癌,取得了較好的治療效果。Choi等[31]采用線性-樹枝狀嵌段共聚物封裝乙酰唑胺,實現了藥物的高效裝載,增強了使膠質瘤細胞凋亡的作用。
相比于樹枝狀高分子,線性-樹枝狀共聚物的合成方法往往更為簡單,所合成的多分支結構具有多終端的功能基團,并且具有可調控性,從而可以根據不同的用途進行調整設計[32]。與具有自由線團結構的線性聚合物相比,樹枝狀嵌段的球形結構往往會影響線性-樹枝狀嵌段共聚物的物理化學性質[33, 34]。Gitsov等[35, 36]報道了線性聚乙二醇-樹枝狀聚芐醚嵌段共聚物可以與漆酶的多糖結構有效作用,通過為底物提供疏水腔進而提高其酶活性;而線性聚乙二醇-聚苯乙烯嵌段共聚物則持續降低漆酶的催化活性。該研究預示了利用線性-樹枝狀共聚物有效遞送蛋白質藥物的可能。
除了特殊的分子結構對蛋白質活性的影響外,線性-樹枝狀嵌段共聚物還具有精確可調的化學組成及結構[27, 37],這為穩定負載及靶向輸送蛋白質藥物以及根據蛋白質藥物結構進行聚合物載體的定制化設計提供了良好的材料學基礎。下面將介紹4個利用線性-樹枝狀嵌段共聚物或其雜化體系對蛋白質藥物進行有效封裝及靶向輸送的成功實例。
2.1 線性-樹枝狀嵌段共聚物納米粒子用于蛋白質的原位封裝與遞送
受到生物體系中多重協同作用力的啟發,Wang等[22]利用線性-樹枝狀嵌段共聚物高度可控的化學組成及結構,根據蛋白質的結構及性質,合成了與蛋白質具有多重雜化超分子相互作用力的線性-樹枝狀嵌段共聚物,并用于蛋白質的穩定封裝及靶向遞送。這種線性-樹枝狀嵌段共聚物由線性的聚乙二醇及樹枝狀的寡聚氨基酸骨架構成。其中,寡聚氨基酸的末端含有功能性基團,可進一步進行功能化修飾。如圖1a所示,這些功能性基團可以為帶正電的氨基或胍基,也可以為帶負電的羧酸基。這些帶正電或負電的基團可以與蛋白質表面的帶電基團通過靜電相互作用力復合。此外,不同的疏水基團(如十七酸、膽固醇、維他命E等)也可以被修飾在寡聚氨基酸的末端,從而促進線性-樹枝狀嵌段共聚物與蛋白質通過疏水-疏水相互作用進行復合[22]。這種設計具有以下3個優點:① 樹枝狀的雜化功能性基團可以最大程度地貼合蛋白質各向異性的表面及溝槽,從而提高線性-樹枝狀嵌段共聚物與蛋白質發生作用的可能性與穩定性;② 多重相互作用可以提高線性-樹枝狀嵌段共聚物與蛋白質之間作用力的強度;③ 線性-樹枝狀嵌段共聚物中疏水基團的存在可以有效降低周圍環境的極性,從而顯著提高靜電相互作用力的強度[38-40],進而形成穩定的蛋白質/線性-樹枝狀嵌段共聚物復合納米粒子。
優化的線性-樹枝狀嵌段共聚物可以與蛋白質(如牛血清白蛋白BSA、胰島素Insulin等) 復合形成直徑小于30 nm的納米粒子。其負載量最高可達200%(線性-樹枝狀嵌段共聚物 ∶蛋白質=1 ∶2,質量比)。研究表明,線性-樹枝狀嵌段共聚物中帶電基團的選擇應遵守電荷互補原則,即利用帶正電的基團負載負電性的蛋白質(如牛血清白蛋白、胰島素等),利用負電基團負載正電性的蛋白質(如溶菌酶、胰蛋白酶等)。此外,胍基具有很好的細胞膜穿透性,所以利用含胍基的線性-樹枝狀嵌段共聚物可以進行蛋白質的細胞內傳遞[22]。線性-樹枝狀嵌段共聚物中的疏水官能團的種類會對蛋白質封裝的穩定性產生影響。實驗結果表明,含有維他命E的線性-樹枝狀嵌段共聚物與模型蛋白質牛血清白蛋白具有較強的結合作用,可用于其穩定封裝。相比于未封裝的自由蛋白質,利用上述納米粒子可以將蛋白質藥物有效地遞送至HT-29結腸癌裸鼠移植瘤部位(圖1b)。這一方面是因為利用線性-樹枝狀嵌段共聚物進行穩定的蛋白質封裝可有效延長蛋白質在小鼠體內的循環時間,另一方面則是因為小尺寸的納米粒子基于實體瘤高通透性和滯留效應(the enhanced permeability and retention effects)[41]可富集在腫瘤部位。這種利用線性-樹枝狀嵌段共聚物封裝蛋白質藥物的方法可在中性水溶液中直接進行而不需要任何的催化劑或有機溶劑。這種原位封裝蛋白質藥物的方法可以在最大程度上保留蛋白質藥物的活性,利用這種方法可以實現蛋白質藥物的穩定封裝及靶向遞送,從而更好地實現利用蛋白質藥物對疾病進行有效治療。

圖1 線性-樹枝狀嵌段共聚物的結構及蛋白質封裝示意圖 (a);結腸癌裸鼠移植瘤活體成像(b),未封裝的自由熒光蛋白質(上,#A1) 及線性-樹枝狀嵌段共聚物封裝的熒光蛋白質(下,#A2)通過靜脈注射給藥,圖中黑線圈出了腫瘤部位[22]Fig.1 Schematic illustrations of telodendrimer structures and protein encapsulation (a); In vivo animal images of HT-29 colon cancer bearing nude mice xenograft models (#A1 and #A2) after tail vein injection of free Cy5-protein, and Cy5-protein-loaded telodendrimer nanoparticles (b), the black circles in (b) indicate the tumor sites[22]
2.2 類脂質/線性-樹枝狀嵌段共聚物雜化納米粒子運載蛋白質藥物治療原位腦瘤
多形性膠質母細胞瘤(glioblastoma multiforme)是一種常見且難以治愈的腦腫瘤[42]。血腦屏障會阻止絕大多數小分子藥物及幾乎所有大分子藥物的通過[43],即限制了藥物分子作用于腦腫瘤部位。增強對流遞送(convection-enhanced delivery)是一種持續的局部注射療法,與擴散的方法相比能將輸注藥物的滲透能力提高一個量級,從而將無法通過血腦屏障的藥物遞送至腦瘤部位[42]。然而現階段,利用增強對流遞送方法結合聚合物載體進行藥物的輸送還停留在小分子藥物的遞送階段[44]。很多蛋白質藥物對腫瘤具有非常好的治療效果,比如白喉毒素[45]。據報道,單個白喉毒素分子進入腦瘤細胞后通過抑制蛋白質的合成就足以殺死一個腦瘤細胞[45-47]。然而,白喉毒素的非特異性毒性限制了其作為蛋白質藥物治療腦瘤的應用。為了克服其非特異性毒性,科學家們開發了截短型白喉毒素(DT390)[48]。然而截短型白喉毒素自身卻無法進入細胞,更無法發揮藥效[46]。所以需要有針對性地設計載體用于穩定負載截短型白喉毒素并進行其細胞內的傳遞。綜上,合理的開發載體運載截短型白喉毒素進入細胞并結合增強對流遞送手段,則有望實現對原位腦瘤的有效治療。
依據上述思路,Wang等[49]開發了一種類脂質(lipidoid)/線性-樹枝狀嵌段共聚物雜化納米粒子(圖2a)。該納米粒子具有精細可調的粒子尺寸及表面化學。優化的納米粒子具有56 nm的水力學直徑及中性的表面電勢,它可以有效負載蛋白質藥物并實現其細胞內傳遞。這種負載有蛋白質藥物的雜化納米粒子通過增強對流遞送手段運送至原位腦瘤后具有良好的腫瘤內擴散性及長的保留時間,從而可以實現對腦瘤的長效給藥。如圖2b和2c所示,負載有牛血清白蛋白的雜化納米粒子及未封裝的自由截短型白喉毒素對比組對原位腦瘤均無明顯的治療效果,而負載有截短型白喉毒素的雜化納米粒子治療組則能顯著抑制腦瘤的生長。此研究將促進增強對流遞送在納米載體輸送蛋白質藥物治療原位腦瘤方面的發展。
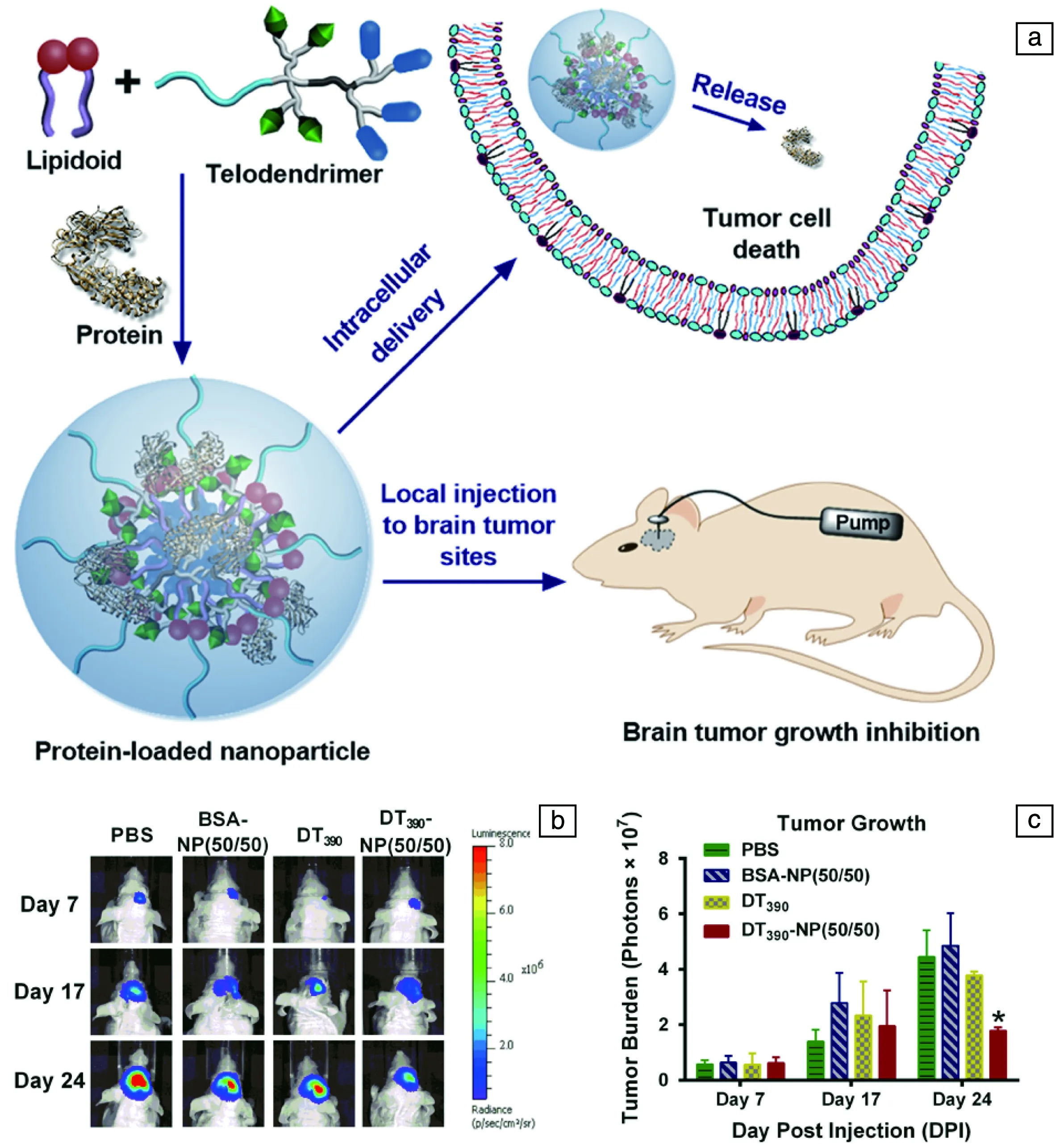
圖2 負載有蛋白質藥物的類脂質/線性-樹枝狀嵌段共聚物雜化納米粒子制備及原位腦瘤治療示意圖 (a),在接種U87腫瘤細胞于 小鼠顱內后的第7、17及24 d時,基于不同的治療方式下小鼠的生物發光成像指出腦瘤大小 (b),負載截短型白喉毒素的 類脂質/線性-樹枝狀嵌段共聚物雜化納米粒子有效抑制腦瘤的生長(c) [ 49]Fig.2 Schematic illustrations of the formation of protein-loaded lipidoid-telodendrimer hybrid nanoparticles and brain tumor treatment (a), Typical bioluminescence images of mice injected with intracranial U87 tumors treated with different formulations at different days after the cell intracranial implantation (b), DT390-incorporated nanoparticle delivery suppresses tumor growth on mice injected with intracranial U87 tumors, *P < 0.05 as comparison to each control group (c) [49]
2.3 基于線性-樹枝狀嵌段共聚物的蛋白質藥物載體定制化設計
前面介紹了兩個基于靜電作用及疏水作用協同進行蛋白質藥物有效負載及靶向輸送的例子。在此類納米載體中,帶電基團的選擇往往相對容易,即在考慮電荷互補原則的基礎上根據遞送需求進行帶電基團的選擇。比如,當目標蛋白質藥物為負電性的截短型白喉毒素時,需要選擇胍基、叔胺基等作為帶電基團以便實現蛋白質藥物的細胞內傳遞;而當目標蛋白質藥物為負電性的胰島素時,則一般選擇毒性較低的伯氨基作為帶電性基團,這樣一方面伯氨基可以與負電性的胰島素通過靜電相互作用結合,另一方面伯氨基的使用也會避免胰島素在遞送過程中發生不必要的細胞攝取(胰島素能夠結合細胞表面的受體進而引發葡萄糖的注入,所以胰島素需要在細胞外釋放,而應避免聚陽離子引起的胰島素細胞攝取),從而最大程度地發揮胰島素的藥效[50]。相比于帶電基團的選擇,疏水基團的合理選擇要困難許多。如何根據目標蛋白質藥物的結構進行疏水基團的合理選擇及納米載體構建是一項巨大的挑戰。
以線性-樹枝狀嵌段共聚物為材料基礎,Wang等[50]提出了一個計算機虛擬篩選輔助聚合物載體定制的概念。如圖3a所示,首先選擇一個小分子數據庫,利用分子對接等計算模擬方法計算小分子與蛋白質藥物胰島素的對接能,并按對接能高低將這些小分子進行排序;然后將這些小分子利用化學反應接枝在預先修飾有正電性基團的線性-樹枝狀嵌段共聚物上從而制備了一個聚合物庫,并利用這些聚合物封裝胰島素從而制備了一個胰島素納米制劑庫;接下來對該納米制劑庫進行系統的評估及優化,主要研究利用聚合物對胰島素進行封裝的穩定性、胰島素體外釋放動力學、胰島素體內代謝動力學、血糖抑制情況等;最后利用實驗結果來驗證計算機預測結果的正確性。研究表明,計算機預測與實驗結果具有很好的一致性,即含有與胰島素具有較低對接能的分子的聚合物納米粒子具有較高的胰島素封裝穩定性及較長時間的血糖抑制效果(圖3b和3c),這驗證了該聚合物載體定制化設計方法的可行性。通過該方法篩選出的優化的聚合物載體能夠有效封裝胰島素并調控其釋放動力學,從而有效延長了單次注射胰島素對血糖的控制時間,從而有望減輕由于頻繁注射胰島素給糖尿病患者帶來的巨大痛苦。綜上,利用該方法可實現根據蛋白質藥物的結構進行聚合物載體的定制化設計,這很大程度上提高了聚合物載體設計及制備的針對性與目的性。利用這種方法制備的藥物制劑有望實現對疾病更好的治療。
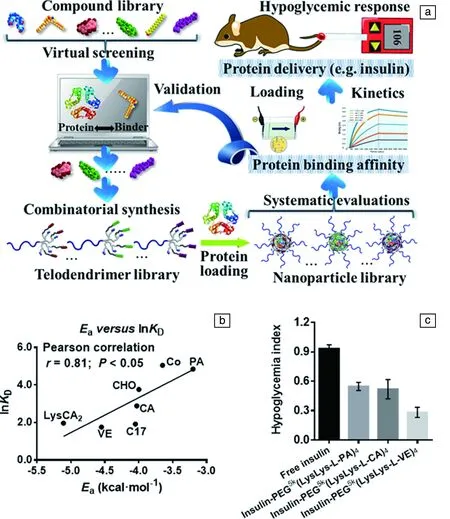
圖3 計算機輔助虛擬篩選優化聚合物載體設計用于胰島素遞送示意圖 (a),平衡解離常數的自然對數與平均對接能的關系曲 線 (b),不同聚合物載體遞送胰島素對低血糖生成指數的影響 (c) [50]Fig.3 Schematic illustrations of rational design and combinatorial synthesis of telodendrimers for protein delivery (a); Natural logarithm of equilibrium dissociation constant (lnKD) plotted against average docking energy (Ea) (b), linear regression was fit via Ordinary Least Square to calculate the Pearson correlation coefficient r and the associated P values; Quantification of hypoglycemia index (c) [50]
2.4 陽離子聚合物/線性-樹枝狀嵌段共聚物復合物用于蛋白質的細胞內遞送
陽離子聚合物作為一種高效的非病毒型載體材料已被廣泛應用于基因遞送領域[51-55],其最近也被嘗試應用于蛋白質藥物的細胞內傳遞[3, 56]。然而,陽離子聚合物自身的一些特點(包括高細胞毒性、高溶血性、非特性粘附或聚集性等)[52, 57]卻嚴重限制了其作為蛋白質藥物載體的應用。針對這一問題,Wang等[58]設計并制備了一種含有負電基團及疏水基團的線性-樹枝狀嵌段共聚物,其通過靜電作用、疏水作用與陽離子聚合物、蛋白質復合,作為可移除的保護層在降低陽離子聚合物細胞毒性、溶血性、非特異粘附及聚集性的同時,提高其細胞內傳遞蛋白質分子的能力。
蛋白質、陽離子聚合物(如聚乙烯亞胺PEI)與線性-樹枝狀嵌段共聚物的復合發生在中性水溶液中且不需要任何的催化劑或有機溶劑。這種基于多重雜化超分子相互作用力的復合具有較高的穩定性。綠色熒光染料異硫氰酸熒光素(FITC)被用于標記牛血清白蛋白(圖4a~4c)或線性-樹枝狀嵌段共聚物(圖4d)。同大多數蛋白質分子一樣,模型蛋白質分子牛血清白蛋白自身無法穿透細胞膜進入細胞(圖4a);當利用陽離子聚合物作為載體遞送牛血清白蛋白時,除了引入高細胞毒性及溶血性外,還造成了在細胞外與培養液中各種生物大分子的嚴重聚集(圖4b),其影響了蛋白質的細胞內傳遞效率;使用線性-樹枝狀嵌段共聚物保護層不但可以降低陽離子聚合物引起的細胞毒性及溶血性,還可完全消除聚集現象且可以有效地將牛血清白蛋白遞送至細胞內(圖4c);線性-樹枝狀嵌段共聚物不僅作為保護層以降低載體引起的細胞毒性、溶血性及聚集性,而且在蛋白質進入細胞這一過程中,線性-樹枝狀嵌段共聚物會自發地從蛋白質-陽離子聚合物復合物上解離而不會隨蛋白質進入細胞(圖4d),這將在最大程度上保持(或恢復)陽離子聚合物的高胞內傳遞能力。這種以線性-樹枝狀嵌段共聚物作為可移除的保護層輔助陽離子聚合物進行有效的蛋白質分子細胞內傳遞的策略將在蛋白質藥物治療領域有廣闊的應用前景。
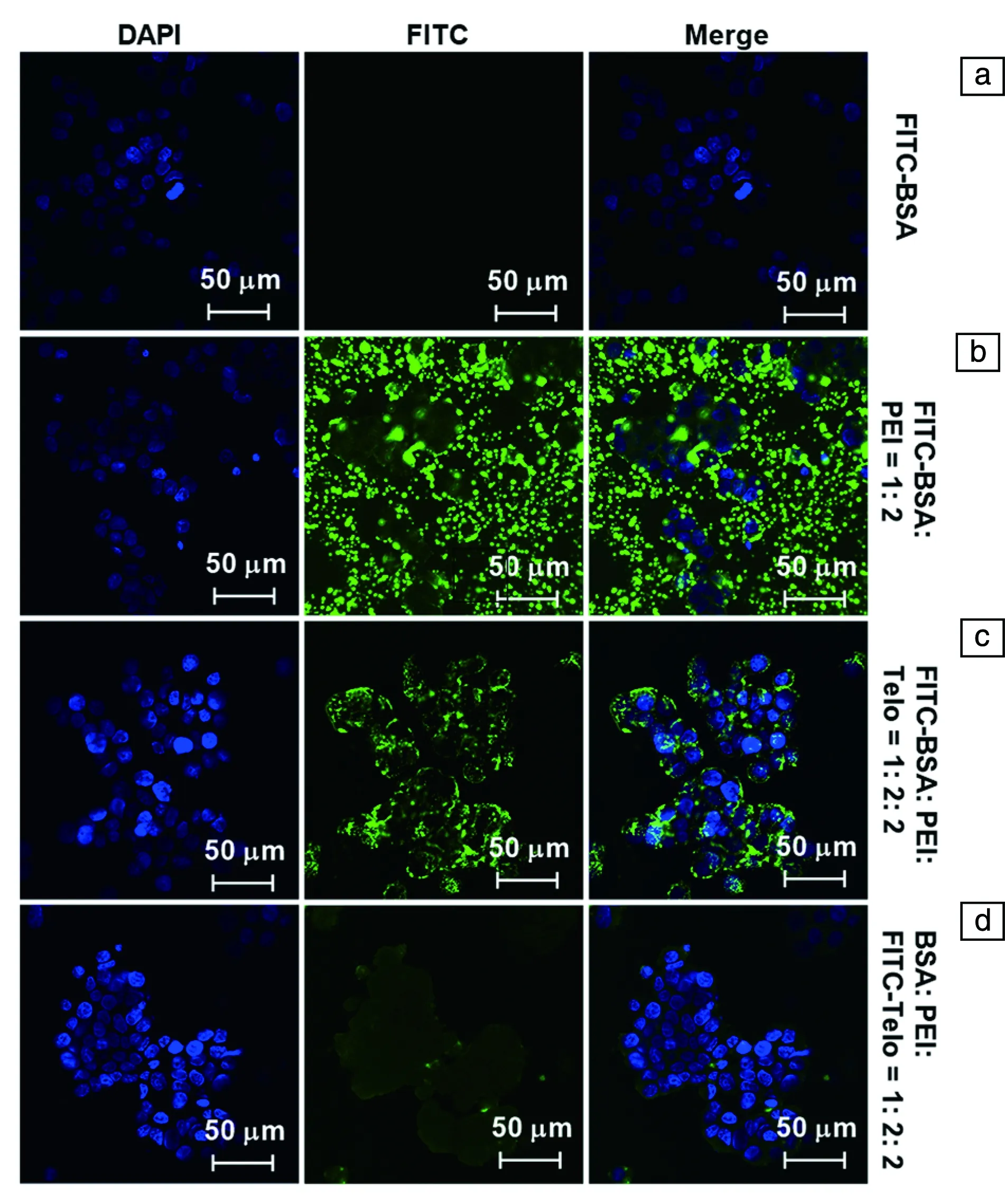
圖4 結腸癌細胞的共聚焦熒光顯微鏡照片,細胞分別使用下述 試劑在37 ℃下進行共培養3 h:(a) 未封裝的自由熒光蛋 白質,(b) 熒光蛋白質/陽離子聚合物復合物(1 ∶2,質量 比),(c) 熒光蛋白質/陽離子聚合物/線性-樹枝狀嵌段共 聚物復合物(1 ∶2 ∶2,質量比),(d) 蛋白質/陽離子聚合 物/熒光線性-樹枝狀嵌段共聚物復合物(1 ∶2 ∶2,質量比) [58]Fig.4 Confocal fluorescence microscopy images of HT-29 cells incubated with free FITC-BSA (a), FITC-BSA:PEI (1 ∶2, w/w) (b), FITC-BSA:PEI:telodendrimer (1 ∶2 ∶2, w/w) (c), and BSA: PEI:FITC-telodendrimer (1 ∶2 ∶2, w/w) (d) at 37 ℃ for 3 h[58]
2.5 線性-樹枝狀嵌段共聚物的分子設計及納米粒子制備
上面介紹了4個利用線性-樹枝狀嵌段共聚物或其復合納米粒子對蛋白質藥物進行有效封裝及靶向輸送的例子[22, 49, 50, 58]。合理的設計并制備線性-樹枝狀嵌段共聚物是實現上述功能的關鍵。在本節中,將闡述線性-樹枝狀嵌段共聚物分子設計的基本原則(表1)。在結構上,由于聚乙二醇分子具有良好的親水性及低免疫原性等特點,所以上述4個例子中所使用的線性-樹枝狀嵌段共聚物的線性高分子均為PEG5k(分子量為5000道爾頓的聚乙二醇)。具有雙氨基結構的賴氨酸是構筑樹枝狀寡聚氨基酸骨架的理想選擇。當利用線性-樹枝狀嵌段共聚物封裝負電性蛋白質藥物(如胰島素、截短型白喉毒素等)時應選擇正電性分子進行線性-樹枝狀嵌段共聚物的功能化;其中精氨酸上所帶的胍基誘導細胞攝取納米粒子的效果較好[22],而賴氨酸結構上的靈活性使其所帶的氨基能夠與蛋白質的羧基形成穩定的離子鍵及氫鍵相互作用[50],所以應針對所需遞送的蛋白質的種類合理選擇正電性分子對線性-樹枝狀嵌段共聚物進行修飾。當利用線性-樹枝狀嵌段共聚物結合正電性蛋白(如溶菌酶等)或與陽離子聚合物(如PEI等)形成復合物時,則應選擇含羧酸基團的負電性分子對線性-樹枝狀嵌段共聚物進行功能化[22, 58]。線性-樹枝狀嵌段共聚物中的疏水基團主要用于與蛋白質藥物或類脂質的疏水區域或基團通過疏水相互作用結合[22, 49],所以應根據蛋白質藥物或類脂質的結構選擇合適的疏水分子對線性-樹枝狀嵌段共聚物進行修飾。此外,上述線性-樹枝狀嵌段共聚物的合成所使用的是多肽化學[22],所以所制備的線性-樹枝狀嵌段共聚物不但具有良好的生物相容性,還具有可生物降解性,其可以作為一種安全的蛋白質藥物載體應用于體內研究。

表1 線性-樹枝狀嵌段共聚物分子設計及納米粒子制備概述
*Other component in the telodendrimer-based hybrid nanoparticles
3 結 語
利用線性-樹枝狀嵌段共聚物遞送蛋白質藥物是一項新興且十分有意義的研究。線性-樹枝狀嵌段共聚物精確可控的化學組成及結構為根據蛋白質藥物的結構、性質及功能定向設計并制備聚合物載體提供了可能。而以線性-樹枝狀嵌段共聚物為基礎的雜化體系的開發也豐富了納米載體的制備手段并促進了蛋白質藥物的胞內傳遞及靶向傳遞。相信隨著對線性-樹枝狀嵌段共聚物及其雜化體系認識的不斷加深,人們會開發出越來越多的先進功能型納米載體用于遞送蛋白質藥物以實現對各種疾病的有效治療。
參考文獻 References
[1] Goeddel D V, Kleid D G, Bolivar F,etal.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica[J], 1979, 76 (1): 106-110.
[2] Wang M, Alberti K, Sun S,etal.AngewandteChemieInternationalEdition[J], 2014, 53 (11): 2893-2898.
[3] Wu J, Kamaly N, Shi J,etal.AngewandteChemieInternationalEdition[J], 2014, 53 (34): 8975-8979.
[4] Leader B, Baca Q J, Golan D E.NatureReviewsDrugDiscovery[J], 2008, 7 (1): 21-39.
[5] Jiang Qian(姜 倩), Yue Dong(岳 冬), Gu Zhongwei(顧忠偉).MaterialsChina(中國材料進展)[J], 2017, 36 (11): 813-826.
[6] Zhang Wenjing(張文晶), Gao Changyou(高長有).MaterialsChina(中國材料進展)[J], 2012, 31 (6): 19-30.
[7] Chen J, Zhao M, Feng F,etal.JournaloftheAmericanChemicalSociety[J], 2013, 135 (30): 10938-10941.
[8] Liu M, Johansen P, Zabel F,etal.NatureCommunications[J], 2014, 5: 5526.
[9] Li Li(李 力), Zheng Yiduan(鄭意端).TheChineseJournalofClinicalPharmacology(中國臨床藥理學雜志)[J], 2003, 04 (3): 153-154.
[10] Wang Liangyou(王良友), Liu Keliang(劉克良).ChineseJournalofOrganicChemistry(有機化學)[J], 2003, 23 (11): 1320-1323.
[11] Kobsa S, Saltzman W M.PediatricResearch[J], 2008, 63 (5): 513-519.
[12] Mo R, Jiang T, Di J,etal.ChemicalSocietyReviews[J], 2014, 43 (10): 3595-3629.
[13] Nie L, Zhang G, Hou R,etal.ColloidsandSurfacesB:Biointerfaces[J], 2015, 125: 51-57.
[14] Hua Su(華 蘇), Xu Xiangyang(許向陽), Zhou Jianping(周建平).ProgressinPharmaceuticalSciences(藥學進展)[J], 2009, 33 (10): 451-457.
[15] Mei Lin(梅 林), Long Dahong(龍大宏), Huang Wandan(黃婉丹),etal.AnatomyResearch(解剖學研究)[J], 2010, 32 (1): 1-5.
[16] Du Lina(杜麗娜), Guo Qingdong(郭慶東), Liu Yan(劉 燕),etal.ChinaPharmaceuticals(中國藥業)[J], 2005, 14 (5): 49-50.
[17] Lu W, Park T G.PDAJournalofPharmaceuticalScienceandTechnology[J], 1995, 49 (1): 13-19.
[18] Ayame H, Morimoto N, Akiyoshi K.BioconjugateChemistry[J], 2008, 19 (4): 882-890.
[19] Morimoto N, Hirano S, Takahashi H,etal.Biomacromolecules[J], 2012, 14 (1): 56-63.
[20] Peppas N A, Wood K M, Blanchette J O.ExpertOpiniononBiologicalTherapy[J], 2004, 4 (6): 881-887.
[21] Vermonden T, Censi R, Hennink W E.ChemicalReviews[J], 2012, 112 (5): 2853-2888.
[22] Wang X, Shi C, Zhang L,etal.Biomaterials[J], 2016, 101: 258-271.
[23] Chothia C, Janin J.Nature[J], 1975, 256 (5520): 705-708.
[24] Chothia C.Nature[J], 1974, 248 (5446): 338-339.
[25] Gitsov I, Wooley K L, Hawker C J,etal.Macromolecules[J], 1993, 26 (21): 5621-5627.
[26] Luo J, Xiao K, Li Y,etal.BioconjugateChemistry[J], 2010, 21 (7): 1216-1224.
[27] Shi C, Guo D, Xiao K,etal.NatureCommunications[J], 2015, 6: 7449.
[28] Li Y, Xiao W, Xiao K,etal.AngewandteChemieInternationalEdition[J], 2012, 51 (12): 2864-2869.
[29] Kenyon N J, Bratt J M, Lee J,etal.PloSOne[J], 2013, 8 (10): e77730.
[30] Zhang X, Huang Y, Zhao W,etal.MolecularPharmaceutics[J], 2014, 11 (8): 2807-2814.
[31] Choi J, Moquin A, Bomal E,etal.MolecularPharmaceutics[J], 2017, 14 (8): 2607-2615.
[32] Wurm F, Frey H.ProgressinPolymerScience[J], 2011, 36 (1): 1-52.
[33] Gillies E R, Fréchet J M.DrugDiscoveryToday[J], 2005, 10 (1): 35-43.
[34] Kakkar A, Traverso G, Farokhzad O C,etal.NatureReviewsChemistry[J], 2017, 1: 0063.
[35] Gitsov I, Hamzik J, Ryan J,etal.Biomacromolecules[J], 2008, 9 (3): 804-811.
[36] Gitsov I, Wang L, Vladimirov N,etal.Biomacromolecules[J], 2014, 15 (11): 4082-4095.
[37] Wang L, Shi C, Wright F A,etal.CancerResearch[J], 2017, 77 (12): 3293-3305.
[38] Dao-Pin S, Anderson D, Baase W,etal.Biochemistry[J], 1991, 30 (49): 11521-11529.
[40] Walther T H, Ulrich A S.CurrentOpinioninStructuralBiology[J], 2014, 27: 63-68.
[41] Cabral H, Matsumoto Y, Mizuno K,etal.NatureNanotechnology[J], 2011, 6 (12): 815-823.
[42] Allard E, Passirani C, Benoit J P.Biomaterials[J], 2009, 30 (12): 2302-2318.
[43] Lockman P R, Mumper R J, Khan M A,etal.DrugDevelopmentandIndustrialPharmacy[J], 2002, 28 (1): 1-13.
[44] Zhou J, Patel T R, Sirianni R W,etal.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica[J], 2013, 110 (29): 11751-11756.
[45] Rustamzadeh E, Vallera D A, Todhunter D A,etal.JournalofNeuro-Oncology[J], 2006, 77 (3): 257-266.
[46] Zhang Y, Schulte W, Pink D,etal.PloSOne[J], 2010, 5 (5): e10498.
[47] Schmohl J U, Todhunter D, Oh S,etal.Toxins[J], 2015, 7 (10): 4067-4082.
[48] Rustamzadeh E, Hall W A, Todhunter D A,etal.InternationalJournalofCancer[J], 2007, 120 (2): 411-419.
[49] Wang X, Bodman A, Shi C,etal.Small[J], 2016, 12 (31): 4185-4192.
[50] Wang X, Shi C, Zhang L,etal.ACSMacroLetters[J], 2017, 6 (3): 267-271.
[51] De Smedt S C, Demeester J, Hennink W E.PharmaceuticalResearch[J], 2000, 17 (2): 113-126.
[52] Guan X, Guo Z, Wang T,etal.Biomacromolecules[J], 2017, 18 (4): 1342-1349.
[53] Chen Jianhai(陳建海).ActaPharmaceuticaSinica(藥學學報)[J], 2003, 38 (4): 316-320.
[54] Ren Youyue(任先越), Yang Liqun(楊立群), Liang Xuan(梁 玄),etal.ChineseJournalofBiotechnology(生物工程學報)[J], 2013, 29 (5): 568-577.
[55] Chen Hailiang(陳海靚), Liang Wenquan(梁文權).ChinesePharmaceuticalJournal(中國藥學雜志)[J], 2004, 39 (1): 11-13.
[56] Lee A L, Wang Y, Ye W H,etal.Biomaterials[J], 2008, 29 (9): 1224-1232.
[57] Guan X, Li Y, Jiao Z,etal.ACSAppliedMaterials&Interfaces[J], 2015, 7 (5): 3207-3215.
[58] Wang X, Shi C, Wang L,etal.ColloidsandSurfacesB:Biointerfaces[J], 2018, 162: 405-414.

