聯合應用經顱多普勒超聲(TCD)及定量腦電圖(qEEG)評估單側大腦中動脈重度狹窄或閉塞者腦功能改變的臨床價值
李曼婷, 韓 珂, 吳 江
大腦中動脈(middle cerebral artery,MCA)狹窄或閉塞是中國人缺血性腦卒中的重要原因[1]。先前的研究多集中在癥狀性MCA狹窄,Coutts等[2]對MCA閉塞但臨床無卒中癥狀的報道,引起了對無癥狀性MCA狹窄或閉塞的關注。非急性MCA狹窄或閉塞者多在側支代償不足腦組織低灌注時,才會引起神經元功能障礙,從而出現腦梗死或者短暫性腦缺血發作(transient ischemic attack,TIA)[3]。在頸動脈內膜剝脫術或者頸動脈支架置入術中,當腦血流下降到一定程度、不能滿足神經元的正常電活動供血時,腦電圖顯示神經元電活動的背景節律將發生異常改變,為術中是否分流提供信息,降低了術中或術后卒中的風險[4,5]。鑒于卒中事件高發病率、高致殘率及高死亡率,如果能夠早期發現MCA狹窄或閉塞者由于腦灌注下降導致的異常電活動,早期客觀評價腦功能改變,對是否需要進一步選擇個體化的干預治療,預防卒中發生尤為重要。本研究旨在探討聯合經顱多普勒超聲(transcranial doppler,TCD)及定量腦電圖(quantitative electroencephalogram,qEEG)作為一種無創、實時動態監測腦血流、神經元電活動的評估工具,早期篩查腦功能改變,對血管狹窄的患者進行分層,有助于臨床醫生篩查腦梗死的高危人群,從而指導臨床選擇個體化治療方案。
1 資料和方法
1.1 研究對象 收集2012年5月-2014年9月吉林大學第一醫院神經內科經TCD診斷單側MCA重度狹窄或閉塞者74例(重度狹窄31例,閉塞43例)作為病例組,男性54例,女性20例,年齡18歲~90歲,平均年齡(55.56±11.9)歲。根據有無責任癥狀分為癥狀組(45例)及無癥狀組(29例)。及年齡和性別匹配的體檢健康者25例作為對照組。病例組的納入標準:(1)能配合腦電圖(electroencephalogram,EEG)及TCD檢查;(2)經TCD檢查診斷為單側MCA重度狹窄或閉塞;(3)且經MRA/CTA/DSA證實為單側MCA重度狹窄或閉塞;(4)臨床表現為頭痛、頭暈、眩暈、胸悶等非特異性癥狀或無任何癥狀者納入無癥狀組;(5)符合WHO標準的腦梗死或TIA者納入癥狀組。排除標準:(1)顳窗穿透不良者;(2)TCD提示對側MCA狹窄程度>50%;(3)伴頸動脈嚴重狹窄(>70%)或閉塞者;(4)癥狀與狹窄側MCA不匹配者;(5)伴動脈瘤、顱內占位或動靜脈畸形者;(6)24 h內有發熱、服藥苯巴比妥、精神類抑制藥物等引起腦電圖改變的藥物;(7)癲癇;(8)其他非腦缺血引起的EEG異常;(9)腦部出血性疾病;(10)肝、腎功能不全。本研究已經通過吉林大學第一醫院倫理委員會的審核批準,且所有入組者均簽署知情同意書。
1.2 檢查方法 所有受試者均應用神經監護儀(NSD-8100,深圳市德力凱醫療設備股份有限公司生產),于清醒、平臥、閉目、安靜環境下進行EEG、TCD及心率、脈搏、血壓、血氧飽和度等生命體征監測。受試者需預先清洗頭部,并且應用磨砂膏去除局部頭皮表面皮脂及污垢,然后應用T20導電膏固定盤狀電極,表面用3M加壓固定膠帶固定,各導聯電阻控制在10 KΩ,電極安裝采用國際10~20系統,常規雙極導聯、耳極作為參考電極進行描記。對照阻抗界面連接電極。腦電信號采集時參數設定:16通道,時間基準為30 mm/s、時間常數0.3、靈敏度為10 μv/mm、濾波1~30 Hz,阻抗設置為10 KΩ,采樣頻率250 Hz,相對波段功率(Relative Band Power,RBP)頻帶設置為1~4 Hz,δ波;4~8 Hz,θ波;8~13 Hz,α波;13~30 Hz,β波。TCD用監護頭架固定探頭,監測雙側MCA血流速度,深度為50~60 mm。同時連接血壓、血氧飽和度、心電等生命體征監測裝置。同時記錄數據至少30 min。應用核磁共振灌注成像(perfusion weight imaging,PWI)行腦組織灌注檢查,記錄腦血流量(cerebral blood flow,CBF)、腦血容量(cerebral blood volume,CBV)、平均通過時間(mean transit time,MTT)、達峰時間(time to peak,TTP)等參數。應用美國國立衛生研究院卒中量表(national institute of health stroke scale,NIHSS)評分。數據分析時,腦電圖需要排除偽差部分,同時為減少因皺眉等引起的偽差,RBP模式中需要排除FP1、FP2兩個不位于MCA供血區域的導聯。利用NSD-8100自帶的RBP模式對數據進行分析轉化,得到不同頻帶的RBP數值。檢查醫師和數據分析者為雙盲。
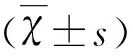
2 結 果
2.1 一般資料分析 99例受試者的年齡、性別無統計學差異(P>0.05),其他相關因素無統計學差異(P>0.05)(見表1)。
2.2 3組間qEEG相對波段功率的比較 (1)3組間全腦各波段RBP值的比較(見表2)。癥狀組δ波、θ波RBP值高于無癥狀組及對照組(P<0.05),α波RBP值低于以上兩組(P<0.05);而無癥狀組僅α波RBP值低于對照組(P<0.05)。(2)病例組狹窄側MCA分布區與對照組相應區域間各波段RBP值的比較(見表3)。癥狀組狹窄側MCA分布區δ波、θ波RBP值高于無癥狀組及對照組(P<0.05),α波RBP值低于以上兩組(P<0.05);無癥狀組狹窄側MCA分布區α波RBP低于對照組(P<0.05)。(3)3組間狹窄側與健側MCA分布區各波段RBP值的比較(見表4)。癥狀組狹窄側MCA分布區δ波RBP值高于健側(t=3.91,P=0.000),α波RBP值、β波RBP值低于健側(t=-2.99,P=0.005,s=-4.29,P=0.000);而無癥狀組狹窄側MCA分布區僅有δ波段RBP高于健側(t=2.08,P=0.048),雙側α波RBP值、β波RBP值未見明顯差異(P=0.497;P=0.246);對照組雙側腦區各波段RBP值均無差異(P>0.05)。(4)3組間患側與健側枕區各波段RBP值的比較(見表5)。癥狀組患側枕區δ波RBP值高于健側枕區(t=4.77,P=0.000),α波RBP值、β波RBP值低于健側枕區(t=-3.58,P=0.001,s=-215.50,P=0.000)。(5)病例組健側枕區與對照組對應枕區各波段RBP值的比較(見表6)。癥狀組健側枕區δ波、θ波RBP值高于對照組(P<0.05),α波RBP值低于對照組(P<0.05);而無癥狀組與對照組相比,δ波RBP值升高(P<0.05)、α波RBP值降低;癥狀組與無癥狀組相比較,α波RBP值降低(P<0.05)。(6)癥狀組RBP值與NIHSS分值的相關性分析:癥狀組全腦區δ波RBP值與NIHSS呈正相關性(r=0.83,P=0.000),全腦區α波RBP值、β波RBP值與NIHSS分值呈負相關(r=-0.73,P=0.004;r=-0.64,P=0.019)。癥狀組雙側腦區、雙側枕區δ波RBP差值均與NIHSS呈正相關(r=0.59,P=0.032;r=0.76,P=0.002);雙側腦區α波段RBP之差與NIHSS呈負相關(r=-0.57,P=0.042)。
2.3 3組間TCD血流動力學參數的比較 對照組左側與右側MCA、ACA、PCA的收縮期峰值流速(systolic velocity,Vs)比較均無統計學意義(P=0.882;P=0.875;P=0.146),所以將對照組左側的Vs作為病例組狹窄側的對照,右側與病例組非狹窄側對照。3組間血流速度的比較(見表7)。癥狀組與無癥狀組的nvMCA、dvACA、nvACA、dvPCA、nvPCA均高于正常對照組(P<0.01);無癥狀組dvACA、dvPCA高于癥狀組(P<0.05)。
2.4 qEEG與PWI的相關性 (1)CBV、CBF與各波段RBP值的相關性:CBV正常組與CBV異常組之間各波段RBP值均未見差異;CBF下降組狹窄側MCA分布區、狹窄側枕區的δ波RBP值比CBF正常組明顯增高(F=6.36,P=0.033;F=8.81,P=0.016),狹窄側枕區α波RBP值明顯下降(F=5.63,P=0.042);(2)MTT、TTP與各波段RBP值的關系:MTT/TTP延長組與MTT/TTP正常組比較,在狹窄側MCA分布區及狹窄側枕區以及全腦區均表現為δ、θ波RBP值升高,α波RBP值下降(P<0.05)。

表1 研究對象的人口統計學和臨床資料

表2 3組間全腦區各波段RBP值(%)
與對照組比較*P<0.05;與無癥狀組比較#P<0.05,qEEG:quantitative electroencephalogram,定量腦電圖;RBP:relative band power,相對波段功率

表3 病例組狹窄側MCA分布區與對照組相應區域的各波段RBP值(%)
與對照組比較*P<0.05;與無癥狀組比較#P<0.05

表4 3組狹窄側與健側MCA分布區各波段RBP值(%)
與對照組比較*P<0.05

表5 3組間患側與健側枕區各波段RBP值(%)
與對照組比較*P<0.05;與無癥狀組比較#P<0.05

表6 癥狀組、無癥狀組健側枕區與對照組對應枕區各波段RBP值(%)
與對照組比較*P<0.05;與無癥狀組比較#P<0.05

表7 3組間大腦中、前、后動脈的血流速度(Vs,cm/s)
與對照組比較*P<0.05;與無癥狀組比較#P<0.05
MCA:middle cerebral artery,大腦中動脈;ACA:anterior cerebral artery,大腦前動脈;PCA:posterior cerebral artery,大腦后動脈;Vs:systolic velocity,收縮期峰值血流速度;v:velocity,血流速度;n:病例組的非狹窄側及對照組的右側;d:病例組的狹窄側及對照組的左側
3 討 論
本研究主要結果如下:癥狀性MCA重度狹窄或閉塞者qEEG缺血改變明顯,與對照組比較主要表現為δ波RBP值顯著升高,α波、β波RBP值顯著下降,且全腦區δ波RBP值越高,α波、β波RBP值越低,患者的神經功能缺損程度也就越嚴重;患側ACA、PCA血流速度輕度增快,側支開放不足;PWI呈低灌注改變。無癥狀MCA重度狹窄或閉塞患者qEEG無缺血改變或僅有輕微改變,與對照組比較表現為僅有輕微α波RBP值下降、或輕微δ波RBP值升高甚至無改變;患側ACA、PCA血流速度顯著代償性增快、側支開放充分;PWI灌注改變輕微。
神經監測是一個新興領域,重要組成部分是腦電(electroencephalogram,EEG)監護,研究顯示腦電圖對腦組織缺血檢測具有高敏感性及特異性,能檢測出可逆的腦功能改變[6,7]。普通腦電圖的判讀存在較大的主觀性及偏倚,而定量腦電圖 (quantitative electroencephalogram,qEEG)是應用快速傅立葉轉換方法,通過函數模型,將原始腦電圖的基本參數,如頻率、節律、波幅、波形等,轉化為各種量化參數,其中相對波段功率(relative band power,RBP)是將腦電波幅隨時間變化轉化為腦電功率隨頻率的變化,是各波段(δ、θ、α、β) 功率所占總功率的百分比[8],用于定量反映腦波的分布、比例與波幅變化,且RBP的異常率高于EEG[9]。
國內研究顯示[10]急性大面積腦梗死,發病24 h內CT未顯影者腦電監測100%異常,提示腦梗死超早期或早期時EEG的敏感性高。國外也有類似發現[11],蛛網膜下腔出血后的遲發性腦梗死發病48 h內 EEG異常的敏感性達89%,而特異性達77%。不同部位梗死的EEG表現不一樣[12~14],腦葉梗死多表現為局灶性的異常δ、θ波,基底節區梗死則多表現為彌漫性的異常δ、θ波,而位置較深的后循環腦梗死如小腦和腦干梗死,腦電圖多數表現為正常。本研究中,45例癥狀組腦電背景活動兩側不對稱,病灶側α波、β波減少,慢波增多,其中8例大面積腦梗死患者MCA分布區發生高波幅的δ波爆發,這與Burghaus等[15]研究結果一致;29例無癥狀組中11例患側背景節律出現不同程度的慢化,θ活動增多,偶見δ波,α波、β波減少,15例背景節律為雙側正常對稱,部分出現α泛化,腦缺血發作時也可見間斷性θ波,提示癥狀性和無癥狀性MCA狹窄的腦功能改變程度不同。
癥狀組中有2例癥狀嚴重但發病時間在6個月以上的患者,其EEG已基本恢復正常,雙側MCA分布區EEG大致對稱,以α波及θ波為主,電壓偶不對稱,枕區表現為α波為主,且雙側對稱,提示腦梗死后期雖然影像學的形態改變顯著,但腦功能逐漸恢復或被代償,故EEG相應改善,提示EEG監測有時間窗限制,越早期缺血表現越明顯。
癥狀組單側MCA閉塞的MRI可見多發腔隙性梗死灶,常規EEG顯示雙側MCA分布區θ波為主,但無法確認雙側波形是否對稱,枕區EEG表現正常且對稱,但qEEG中可明顯發現該患者狹窄側θ波RBP明顯高于健側,提示RBP的異常率高于EEG。
與無癥狀組及對照組比較,癥狀組狹窄側MCA分布區δ波、θ波RBP值顯著增大,α波RBP值顯著降低,提示癥狀組急性腦缺血對于腦部受損皮質的抑制性改變;而無癥狀組狹窄側MCA分布區僅α波RBP輕微降低,提示無癥狀組腦組織并無缺血改變或者僅有輕微改變,癥狀性MCA狹窄腦功能損傷程度較無癥狀重;且驗證了α波對輕度腦缺血最敏感,可能是因為狹窄側枕區血管代償MCA狹窄或者盜血引起的遠隔區EEG 異常,也提示枕葉qEEG改變能間接反映血管狹窄后腦功能的變化。
另外,癥狀組的全腦區δ波、α波、β波RBP值均與NIHSS評分相關,δ波RBP值越大,α波、β波RBP值越小,患者NIHSS分值越高,預后越差,臨床應用中,qEEG的RBP將彌補影像學檢查及神經科查體的不足,提示癥狀性和無癥狀性MCA狹窄的腦功能改變程度不同[16]。
當腦動脈嚴重狹窄或閉塞時,血液可通過側支循環的血管吻合到達缺血腦組織[17],有助于維持腦灌注、改善患者預后。側支循環的存在與梗死面積和臨床結局之間是正相關[18]。Rutgers等認為MCA 狹窄或閉塞后ACA、PCA的分支與 MCA的分支在皮質軟腦膜內吻合,對MCA支配區域進行代償,表現為 ACA、PCA血流速度代償性增快[19]。本研究中TCD也發現,無癥狀組MCA重度狹窄或閉塞側ACA、PCA血流速度明顯高于癥狀組,說明無癥狀組的ACA-MCA、PCA-MCA的側支血流代償要優于癥狀組。但TCD只能反映顱內大動脈的供血情況,而不能檢測小的分支血管。而qEEG可反映大腦的供血情況,彌補TCD的不足,可對MCA狹窄后的側支代償、灌注改變及腦功能改變程度進行評估,且優于形態學,在急性腦缺血的診斷工具中最敏感。
PWI通過測量CBF、CBV、MTT、TTP等參數,早期顯示血管狹窄后腦灌注的改變。但PWI需要注射造影劑、價格昂貴、且難以進行動態監測,不能作為臨床篩查工具。本研究發現RBP與CBF之間有相關性,且CBF可能與δ波RBP值密切相關;MTT、TTP與RBP之間均有相關性,且MTT可能與α波RBP值的相關性更強,TTP與θ波RBP值相關性更強。van Putten[20]發現在頸動脈內膜切除手術中,單側ICA夾閉時,腦電圖空間對稱指數(spatial brain symmetry index,sBSI)會明顯升高,當腦血流灌注恢復正常時sBSI也會隨之下降。Nagata等[21]研究發現腦電圖θ、δ波百分比、功率比指數(PRI)與卒中急性期、亞急性期rCBF和腦氧代謝率CMRO2下降有關,以上均證明了EEG與腦灌注改變密切相關。Diedler等[22]研究發現嚴重腦卒中的qEEG相對功率比(DTABR、RAP、DAR)的降低與腦灌注壓的下降有一定的正相關性。
本研究作為前瞻性研究,灌注樣本量過小,且灌注參數未定量,需進一步明確qEEG與灌注的關系。
綜上,由于qEEG能夠敏感監測到腦血流下降的神經元的異常電活動,與腦灌注下降到使細胞處于梗死風險而尚未發生梗死的腦血流量的改變程度、腦梗死的病灶中心及缺血半暗帶細胞水腫區,及腦功能的復雜性與腦卒中的預后均提供重要價值;而TCD則能準確評估腦血管狹窄后血流動力學及側支循環的改變,故qEEG聯合TCD,早期客觀評價腦功能改變,對是否需要進一步選擇個體化的干預治療,預防卒中發生尤為重要。
[參考文獻]
[1]Ojha R,Huang D,An H,et al.Distribution of ischemic infarction and stenosis of intra-and extracranial arteries in young Chinese patients with ischemic stroke[J].BMC Cardiovasc Disord,2015,15:158.
[2]Coutts SB.Mild Neurological symptoms despite middle cerebral artery occlusion[J].Stroke,2004,35(2):469-471.
[3]吳 江,賈建平,崔麗英.神經病學[M].北京:人民衛生出版社,第2版,2010.40.
[4]Diedler J,Sykora M,Bast T,et al.Quantitative EEG correlates of low cerebral perfusion in severe stroke[J].Neurocrit Care,2009,11(2):210-216.
[5]Schneider JR,Novak KE.Carotid endarterectomy with routine electroencephalography and selective shunting[J].Semin Vasc Surg,2004,17(3):230-235.
[6]Cecile C,de Vos,Susan M,et al.Continuous EEG monitoring during thrombolysis in acute hemispheric stroke patients using the brain symmetry Index[J].Journal of Clinical Neurophysiology,2008,25(2):77-82.
[7]Finnigan S,van Putten MJ.EEG in ischaemic stroke:quantitative EEG can uniquely inform (sub-) acute prognoses and clinical management[J].Clin Neurophysiol,2013,124(1):10-19.
[8]Jonkman J,de Weerd AW,Poortvliet DC,et al.Neurometrics in cerebral ischemia and uremic encephalopathy[J].Brain Topogr,1992,4(4):277-284.
[9]Claassen J,Hirsch LJ,Kreiter KT,et al.Quantitative continuous EEG for detecting delayed cerebral ischemia in patients with poor-grade subarachnoid hemorrhage[J].Clin Neurophysiol,2004,115(12):2699-2710.
[10]沈新天,濮孟久,劉建英,等.腦電圖對CT尚未顯影的大面積腦梗死定位診斷與意義[J].中國實用神經疾病雜志,2008,5:56-58.
[11]Gollwitzer S,Groemer T,Rampp S,et al.Early prediction of delayed cerebral ischemia in subarachnoid hemorrhage based on quantitative EEG:A prospective study in adults[J].Clinic Neurophysiol,2015,126(8):1514-1523.
[12]MolnaiM,Csuhaj R,Horvath S,et al.Spectral and complexity features of the EEG changed by visual input in a case of subcortical stroke compared to healthy controls[J].Clin Neurophysiol,2006,117(4):771-780.
[13]Diedler J,Sykora M,Juttler E,et al.EEG power spectrum to predict prognosis after hemicraniectomy for space-occupying middle cerebral artery infarction[J].Cerebrovasc Dis,2010,29(2):162-169.
[14]Sheorajpanday RV,Nagels G,De Deyn PP,et al.Quantitative EEG in ischemic stroke:correlation with infarct volume and functional status in posterior circulation and lacunar syndromes[J].Clin Neurophysiol,2011,122(5):884-890.
[15]Burghaus L,Hilker R,Dohmen C,et al.Early electroencephalography in acute ischemic stroke:prediction of a malignant course[J].Clin Neurol Neurosurg,2007,109(1):45-49.
[16]Jennifer Wu,Ramesh Srinivasan,Erin Burke Quinlan,et al.Utility of EEG measures of brain function in patients with acute stroke[J].J Neurophysiol,2016,115(5):2399-2405.
[17]Liebeskind DS,Cotsonis GA,Saver JL,et al.Collaterals dramatically alter stroke risk in intracranial atherosclerosis[J].Ann Neurol,2011,69(6):963-974.
[18]Kim JJ,Fischbein NJ,Lu Y,et al.Regional angiographic grading system for collateral flow:correlation with cerebral infarction in patients with middle cerebral artery occlusion[J].Stroke,2004,35(6):1340-1344.
[19]Rutgers DR,Klijn CJ,Kappelle LJ,et al.Recurrent stroke in patients with symptomatic carotid artery occlusion is associated with high-volume flow to the brain and increased collateral circulation[J].Stroke,2004,35(6):1345-1349.
[20]van Putten MJ.Extended BSI for continuous EEG monitoring in carotid endarterectomy[J].Clin Neurophysiol,2006,117(12):2661-2666.
[21]Nagata K,Tagawa K,Hiroi S,et al.Electroencephalographic correlates of blood flow and oxygen metabolism provided by positron emission tomography in patients with cerebral infarction[J].Electroencephalogr Clin Neurophysiol,1989,72(1):16-30.
[22]Diedler J,Sykora M,Bast T,et al.Quantitative EEG correlates of low cerebral perfusion in severe stroke[J].Neurocrit Care,2009,11(2):210-216.

