氯硝柳胺抑制小膠質細胞炎癥作用研究*
楊嘉穎,趙胤安,宋 欣,彭美琪,陳霜霜,賈 佳
蘇州大學藥學院(蘇州215123)
·基礎研究·
氯硝柳胺抑制小膠質細胞炎癥作用研究*
楊嘉穎,趙胤安,宋 欣,彭美琪,陳霜霜,賈 佳?
蘇州大學藥學院(蘇州215123)
*國家自然科學基金資助項目(81371278)
國家級大學生創新創業訓練計劃項目(201510285048Z)
?通訊作者
目的:探討氯硝柳胺對脂多糖(LPS)誘導小膠質細胞炎癥作用的影響。方法:建立脂多糖(LPS)誘導小膠質細胞系BV2炎癥反應模型;采用Griess法檢測細胞上清中NO釋放量,MTT法檢測細胞活性;實時定量 PCR (qPCR)檢測促炎癥因子iNOS、COX-2、TNF-α和IL-6的表達量。分析氯硝柳胺對小膠質細胞炎癥的影響。結果:氯硝柳胺能夠顯著抑制LPS激活的BV2細胞中NO釋放量;qPCR 結果顯示,與正常細胞組相比,LPS組BV2中促炎因子的表達水平明顯升高;氯硝柳胺顯著降低LPS誘導的BV2細胞中促炎因子表達。結論:氯硝柳胺對LPS誘導的小膠質細胞炎癥反應有明顯抑制作用。
近年大量研究表明,中樞神經系統中的炎癥損傷參與神經退行性疾病的發生與發展。異常激活的小膠質細胞在神經退行性疾病中發揮了重要作用。小膠質細胞異常激活后表現為促炎癥狀態,即M1表型,釋放白細胞介素-1β(IL-1β)、白細胞介素(IL-6)、腫瘤壞死因子-α(TNF-α)等細胞促炎癥因子介導神經炎癥,造成腦組織功能和器質性損傷。氯硝柳胺(Nclosamide),化學名5,2’-二氯-4’-硝基-水楊乙酰苯胺,該藥物首次在1958年第六屆國際熱帶醫學與瘧疾大會上首次被報導,之后用于多種疾病的治療。研究顯示,氯硝柳胺在許多疾病模型中具有抑制炎癥的作用,如子宮內膜異位癥模型[1]、類風濕性關節炎模型[2]等。然而,氯硝柳胺是否參與中樞神經系統的炎癥反應目前未有報道。本研究以LPS誘導的小膠質細胞為炎癥模型,探討氯硝柳胺對LPS誘導的小膠質細胞炎癥反應的影響。
材料與方法
1 材 料 DEME培養基(Hyclone公司);胎牛血清(Gibco公司);青霉素/鏈霉素(Hyclone公司);LPS及氯硝柳胺(美國 Sigma 公司);MTT(碧云天生物科技有限公司);RNAiso Plus,cDNA逆轉錄試劑盒及SYBR Green (寶生物工程有限公司)。
2 實驗方法
2.1 BV-2細胞培養:含有10%胎牛血清以及1%青霉素/鏈霉素的DMEM培養基中。將培養皿置于溫度為37 ℃以及一氧化氮含量為5%的環境下培養。細胞面積占據培養皿80%時可以被用來做實驗。
2.2 NO含量測定:用Griess試驗檢測培養基中亞硝酸鹽的濃度來評估NO的含量,根據NO溶于水后形成亞硝酸鹽的原理。小膠質細胞在有或沒有LPS(100 ng/ml, Sigma)刺激的情況下培養24 h。從4 ℃冰箱中取出A、B液,置于室溫下平衡30 min。繪制亞硝酸鹽的標準曲線。將待測樣本上清加入96孔板中,設置3個復孔,每孔加入50μl樣品。加入A液50μl,室溫避光孵育10 min;之后加入B液50μl,避光孵育10 min,在30 min內利用酶標儀在550 nm波長處測量吸光率,利用標準曲線計算出亞硝酸鹽含量。
2.3 MTT法測細胞活力:將狀態良好的BV2細胞以1×104/孔的密度鋪于96孔板中,置于37 ℃、5%CO2環境中培養。棄孔內培養基,加入50μl質量濃度為0.5 mg/ml的MTT溶液,置于37 ℃、5%CO2環境下培養。2 h后,棄孔內液體,每孔加入500μl的DMSO,置于脫色搖床上低速震蕩以使結晶物充分溶解。在全自動酶標儀中檢測570 nm條件下的吸光率,以此定量反映細胞的活性。
2.4 實時熒光定量PCR(Real-time Quantitative PCR, qPCR):收集BV-2細胞,用預冷PBS洗滌3次,加入1 ml Trizol,用移液槍輕輕混勻并吹下細胞至離心管,室溫靜置5 min,參照Takara公司Trizol試劑說明步驟提取BV-2細胞中的總RNA。用Nanodrop檢測RNA的濃度,將濃度單位設定為ng/μl,取1 μg RNA用于逆轉錄,采用Takara公司生產的RT-PCR 反應試劑盒配置混合物,逆轉錄合成cDNA。將cDNA樣品稀釋,將引物、DEPC水和SYBR Green混合,配置混合液。96孔板劃分對照組與實驗組,設置三個復孔,每孔中加入1.5μl cDNA與8.5μl混合液,封膜,上機,在ABI StepOnePlus PCR 儀上進行實時熒光定量PCR檢測。反應條件:95 ℃ 3 min;95 ℃ 30 s, 55 ℃ 30 s,72 ℃ 30 s (×40 cycles)。以GAPDH為內參,引物序列見表1。
2.5 統計學方法:采用Sigma Scan統計學軟件,計量資料以均數±標準差表示,兩獨立組間比較采用t檢驗,多組間用one-way ANOVA 檢驗。P<0.05 為差異有統計學意義。

表1 引物序列表
結 果
1 氯硝柳胺抑制LPS誘導的BV2細胞NO釋放 LPS激活的小膠質細胞釋放大量的NO參與中樞神經系統的炎癥損傷,利用Griess法檢測不同濃度氯硝柳胺處理LPS誘導的BV-2小膠質細胞24 h后,其細胞上清中NO的釋放量。結果如圖1所示:溶劑對照組中單純用LPS誘導小膠質細胞NO釋放量呈現多組中的最高值。實驗組分為五組,氯硝柳胺濃度呈倍數遞增,結果顯示,NO的釋放量在一定范圍內呈現明顯的濃度依賴性:當氯硝柳胺濃度為1.5256μM時,與對照組相比NO釋放量降低不明顯;當氯硝柳胺濃度為3.125~25μM時,NO釋放量顯著降低,呈濃度依賴性,且組間差異具有統計學意義;當氯硝柳胺濃度為50μM時,NO釋放量與前一組氯硝柳胺濃度為12.5μM相比基本持平,與對照組相比,差異明顯且結果具有統計學意義。該結果表明,氯硝柳胺能夠抑制LPS誘導BV-2細胞NO的釋放,并且氯硝柳胺的最適濃度在12.5~25μM之間。
2 氯硝柳胺對BV-2細胞活力的影響 為明確氯硝柳胺對LPS誘導BV-2細胞NO釋放量的抑制作用不是由于其對細胞產生毒性作用所致,我們通過MTT法檢測了化合物對LPS處理的BV-2細胞的細胞活力。結果如圖2所示,與未加LPS組相比,濃度范圍為1.5256~50μM氯硝柳胺作用于LPS誘導的BV-2細胞,對小膠質細胞的活力無顯著影響。
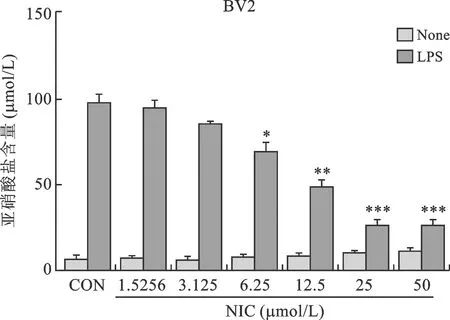
與對照組比較,*P<0.05,**P<0.01,***P<0.001
圖1 NO釋放量測定圖
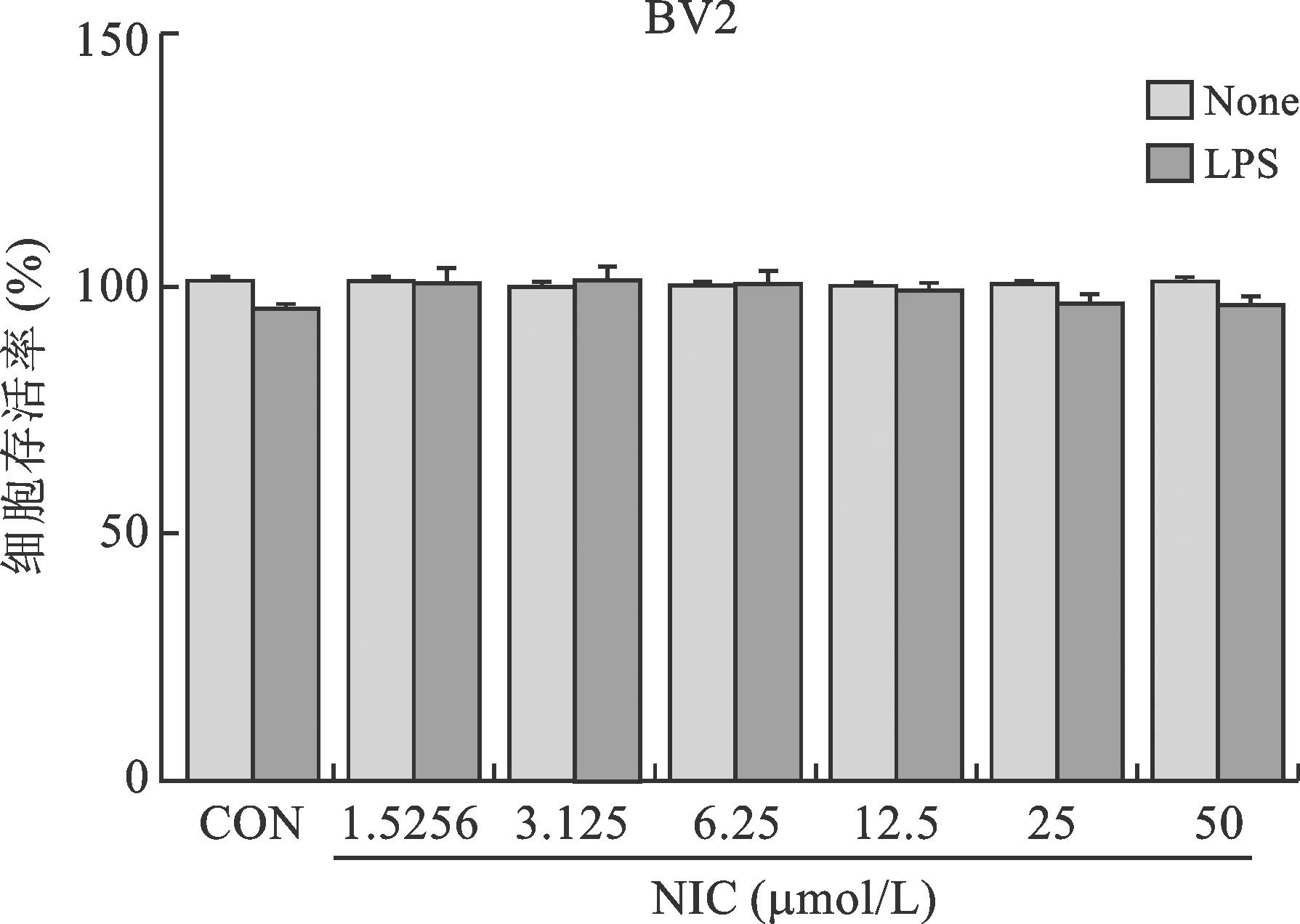
圖2 MTT細胞活力測定圖
3 氯硝柳胺明顯降低LPS誘導小膠質細胞促炎因子的表達 激活的小膠質細胞能釋放大量炎癥介質,如iNOS、COX-2、TNF-α、IL-6等。為了探究氯硝柳胺是否有抑制炎癥介質產生的作用,利用q-PCR技術,檢測LPS誘導的小膠質細胞上清中iNOS、COX-2、TNF-α、IL-6的mRNA表達量。結果如圖3所示:未加入LPS處理時,對照組和單獨給藥處理組相關促炎因子mRNA表達水平很低,而給予LPS刺激后,iNOS、COX-2、TNF-α、IL-6的表達水平明顯增高。氯硝柳胺(25μM)處理能明顯抑制LPS誘導的小膠質細胞上清中這四種促炎因子的mRNA表達,且差異具有統計學意義。說明氯硝柳胺對LPS激活的BV-2細胞產生的炎癥應答具有抑制作用。
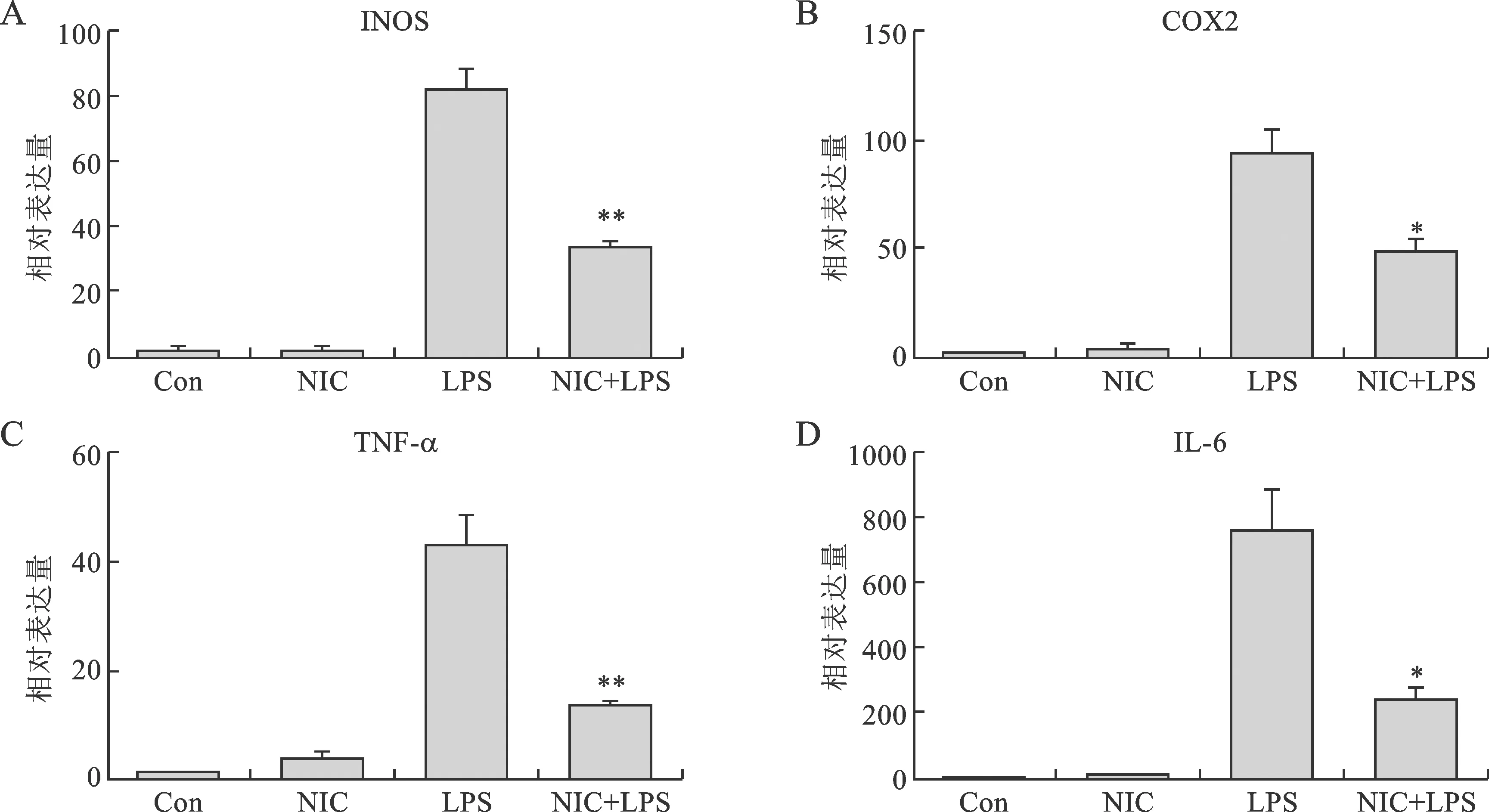
與LPS組比較,*P<0.05,**P<0.01
討 論
神經退行性病變是一類主要由于神經元死亡,突觸丟失[3]導致的一系列神經系統疾病,例如阿爾茲海默癥(Alzheimer disease, AD)、帕金森病(Parkinson disease, PD)、亨廷頓舞蹈癥(HD)、肌萎縮性側索硬化(Amyotrophic lateral sclerosis, ALS)等。疾病的主要病理表現為神經元的過度凋亡和(或)神經元結構與功能障礙。 根據目前研究進展,關于神經退行性疾病的發生和發展機制較多,例如自由基引起的氧化應激損傷、線粒體功能障礙、死亡受體途徑和線粒體途徑介導[4-5]的細胞凋亡[6]及炎癥等。破壞的血腦屏障[7]、隨循環系統入腦的外周免疫細胞與神經毒性因子、激活的膠質細胞[8]成為神經炎癥的三個基本原因。神經炎癥是腦部抵御神經元損傷以及感染性物質的重要防御機制[9]。
一氧化氮(Nitric oxide, NO)是一種非經典的神經遞質,能夠作為逆信使參與中樞神經系統中的信息傳遞[10]。腦組織中過量的一氧化氮具有神經毒性作用,能夠誘導多種類型的神經元凋亡。過度激活的小膠質細胞產生的活性氧(Reactive oxygen species,ROS)與誘導型一氧化氮合酶(Inducible nitric oxidase,iNOS),能夠促使腦組織中的L-精氨酸轉變為一氧化氮,增加谷氨酸的毒性損傷[11]。本研究發現,氯硝柳胺能顯著抑制LPS誘導的小膠質細胞中iNOS mRNA的表達,說明其具有一定的神經保護作用。氯硝柳胺能夠明顯抑制LPS誘導的BV-2小膠質細胞NO的釋放量:當氯硝柳胺濃度為3.125~25μM時,NO釋放量顯著降低且呈濃度依賴性。
小膠質細胞是中樞神經系統(Central nervous system,CNS)中含量最豐富的單核-巨噬細胞,約占細胞總數的10%。它的存在有利于維持神經元的穩態,并且在神經炎癥過程中占有重要地位[12]。靜息狀態下的小膠質細胞呈分支狀,其豐富的軸突與樹突使其與星形膠質細胞,神經元以及血管之間建立聯系,形成一張巨大的網絡覆蓋整個腦區,并對微環境的穩態起到一定得監視作用。一旦中樞神經系統受到損傷和(或)產生炎癥反應,小膠質細胞迅速由分支狀轉變為阿米巴樣,伸出偽足以覆蓋更多區域,參與中樞神經系統的一系列病理生理過程[11]。小膠質細胞受LPS、IFN-γ等持續刺激異常激活后表現為促炎癥狀態,即M1表型,釋放大量的炎癥介質,誘導并加重神經元的損害以及導致神經退行性疾病。本研究發現未加入LPS處理時,對照組和單獨給藥處理組相關促炎因子mRNA表達水平很低,而給予LPS刺激后,iNOS、COX-2、TNF-α、IL-6的表達水平明顯增高。而氯硝柳胺(25μM)處理能明顯抑制LPS誘導的小膠質細胞上清中這四種促炎因子的mRNA表達,且差異具有統計學意義。說明氯硝柳胺對LPS誘導的小膠質細胞炎癥因子的釋放有一定抑制作用。然而,持續激活的細胞對中樞神經系統的損害有一定的保護以及修復作用,清除錯構蛋白等。Shinjo R 等[13]研究發現在神經元華勒變性后,M1極化的小膠質細胞能夠促進其軸索再生。在阿爾茲海默癥模型中,M1極化的小膠質細胞有利于清除大腦中已經存在的淀粉樣蛋白斑[14]。氯硝柳胺被證實對LPS誘導的小膠質細胞炎癥因子的釋放有一定抑制作用,由于只是初步進行體外實驗,未能在動物模型上驗證氯硝柳胺是否真正能夠抑制神經炎癥,以及藥物作用是否是利大于弊仍然有待進一步實驗研究。
同時氯硝柳胺是一種NF-κB抑制劑。NF-κB信號通路在神經退行性疾病中具有重要地位,它能夠調節一系列炎癥因子的產生,如:iNOS、TNF-α、IL-6、COX-2等[15]。最新研究顯示,蜜環菌提取物作用于LPS誘導的小膠質細胞模型上,明顯降低p56的磷酸化水平,阻斷NF-κB信號通路,并且炎性介質表達均有所下調[16]。由此可見,NF-κB信號通路在小膠質細胞炎癥模型中具有重要作用。而本實驗發現氯硝柳胺(25μM)處理能明顯抑制LPS誘導的小膠質細胞上清中iNOS、COX-2、TNF-α、IL-6的mRNA表達,且差異具有統計學意義。說明氯硝柳胺能顯著抑制LPS誘導的小膠質細胞促炎因子的表達,提示NF-κB信號通路極有可能參與其中,這為我們下一步探討氯硝柳胺在小膠質細胞參與的神經退行性疾病中的機制研究提供了一定思路。
作為一種驅蟲藥,氯硝柳胺的臨床價值不斷提高。研究顯示,氯硝柳胺在許多動物模型中具有抑制炎癥的作用。Genna R等將氯硝柳胺用于子宮內膜異位癥的研究中,發現氯硝柳胺有抑制異常細胞增殖并且抑制炎癥反應的作用,主要通過影響NF-κB與STAT3的激活[1]。Liang L等的研究顯示,氯硝柳胺能夠抑制TNF-α誘導的類風濕性關節炎的滑膜細胞導致的炎癥作用,下調TNF-α、IL-1β、IL-6炎性細胞因子的表達,并且阻斷TNF-α介導的IKK, IκBα的磷酸化[2]。我們的研究表明氯硝柳胺對LPS誘導的小膠質細胞炎癥損傷有顯著抑制作用,為下一步探索其參與中樞神經炎癥作用和具體抗炎作用機制提供一定基礎,同時有助于為神經退行性疾病提供新的治療思路。
[1] Prather GR, Mac Lean IIJA, Shi M,etal. Niclosamide as a potential nonsteroidal therapy for endometriosis that preserves reproductive function in an experimental mouse model[J].Biology of Reproduction ,2016,95: 71-74.
[2] Liang L, Huang M, Xiao Y,etal. Inhibitory effects of niclosamide on inflammation and migration of fibroblast-like synoviocytes from patients with rheumatoid arthritis[J]. Inflammation Research ,2015,64:225-233.
[3] Hambright WS, Fonseca RS, Chen L,etal. Ablation of ferroptosis regulator glutathione peroxidase 4 in forebrain neurons promotes cognitive impairment and neurodegeneration [J].Redox Biology ,2017,12:8-17.
[4] Tatton WG, Chalmers-Redman R, Brown D,etal. Apoptosis in Parkinson's disease: Signals for neuronal degradation[J]. Annals of Neurology ,2003,53:S61-S72.
[5] Cheung ECC, Melanson-Drapeau L, Cregan SP,etal. Apoptosis-inducing factor is a key factor in neuronal cell death propagated by BAX-dependent and BAX-independent mechanisms[J]. The Journal of Neuroscience ,2005,25:1324-1334.
[6] 薛小燕, 郭小華, 李 敏, 等. 神經退行性疾病發病機制研究進展[J]. 中國老年學雜志, 2015,35:3149-3152.
[7] Aragon MJ, Topper L, Tyler CR,etal.Serum-borne bioactivity caused by pulmonary multiwalled carbon nanotubes induces neuroinflammation via blood-brain barrier impairment[J]. Proceedings of the National Academy of Sciences,2017,114:E1968-E1976.
[8] Duffy CM, Xu H, Nixon JP,etal. Identification of a fatty acid binding protein4-UCP2 axis regulating microglial mediated neuroinflammation[J]. Molecular and Cellular Neuroscience,2017,80:52-57.
[9] Hanisch U-K, Gertig U. Microglial diversity by responses and responders[J].Frontiers in Cellular Neuroscience,2014,8.
[10] Watkins LR, Milligan ED, Maier SF. Glial activation: a driving force for pathological pain[J]. Trends in Neurosciences, 2001,24:450-455.
[11] Colonna M, Butovsky O. Microglia function in the central nervous system during health and neurodegeneration[J]. Annu Rev Immunol,2017,35(1):441.
[12] Kwon Y-W, Cheon SY, Park SY,etal. Tryptanthrin suppresses the activation of the LPS-treated BV2 microglial cell line via Nrf2/HO-1 antioxidant signaling[J]. Frontiers in Cellular Neuroscience ,2017,11.
[13] Shinjo R, Imagama S, Ito Z,etal. Keratan sulfate expression is associated with activation of a subpopulation of microglia/macrophages in Wallerian degeneration[J]. Neuroscience Letters,2014,579:80-85.
[14] Doty KR, Guillot-Sestier MV, Town T. The role of the immune system in neurodegenerative disorders: Adaptive or maladaptive[J] .Brain Research ,2015,1617:155-173.
[15] Jung HW, Yoon CH, Park KM,etal. Hexane fraction of Zingiberis Rhizoma Crudus extract inhibits the production of nitric oxide and proinflammatory cytokines in LPS-stimulated BV2 microglial cells via the NF-kappaB pathway[J]. Food and Chemical Toxicology ,2009,47:1190-1197.
[16] Geng Y, Zhu S, Cheng P,etal. Bioassay-guided fractionation of ethyl acetate extract from Armillaria mellea attenuates inflammatory response in lipopolysaccharide (LPS) stimulated BV-2 microglia[J]. Phytomedicine ,2017,26:55-61.
(收稿:2017-04-18)
Anti-inflammatoryeffectsofNiclosamideinlipopolysaccharidestimulatedmicroglia
Yang Jiaying, Zhao Yin’an, Song Xin, et al.
College of Pharmaceutical Sciences, Suzhou University (Suzhou 215123)
Objective: To explore the inflammatory effects of Niclosamide in microglia stimulated by lipopolysaccharide. Methods: The effects of Niclosamide on inflammation were observed in BV-2 microglia stimulated by LPS. Nitric oxide production from microglia was assessed by measuring the nitrite concentration in the culture medium using Griess reagent. The cell viability was determined by MTT test. The production of pro-inflammatory factors containing inducible NO synthase(iNOS),tumor necrosis factor-α(TNF-α), interleukin-1β(IL-1β) and interleukin-6(IL-6)were examined by q-PCR. To analyze whether Niclosamide has effects on the inflammation of microglia. Results: Niclosamide significantly inhibited the release of NO from BV-2 microglia stimulated by LPS. qPCR results showed that Niclosamide remarkably decreased the mRNA expression of pro-inflammatory factors in activated BV-2 microglia induced by LPS.Conclusion: Niclosamid has an anti-inflammatory effect on lipopolysaccharide stimulated microglia.
Inflammation Niclosamide/pharmacology Microglia Lipopolysaccharides
炎癥 氯硝柳胺/藥理學 神經小膠質細胞 脂多糖類
R967
A
10.3969/j.issn.1000-7377.2018.03.001

